今日頭條
貝來干細(xì)胞療法獲批老年癡呆臨床。貝來生物1類生物制品“人臍帶間充質(zhì)干細(xì)胞注射液”獲國家藥監(jiān)局批準(zhǔn)開展針對(duì)阿爾茨海默病適應(yīng)癥的臨床研究。2020年7月,國際期刊《Advanced Science》在線發(fā)表了軍事科學(xué)院軍事醫(yī)學(xué)研究所等研究團(tuán)隊(duì)的研究成果表明:臍帶間充質(zhì)干細(xì)胞(hUC-MSCs)具有修復(fù)損傷神經(jīng)細(xì)胞的功能,能夠通過HGF-cMet-AKT-GSK3β通路調(diào)節(jié)tau蛋白磷酸化,顯著提高阿爾茨海默病模型動(dòng)物的學(xué)習(xí)記憶和認(rèn)知能力。
國內(nèi)藥訊
1.科倫HER2-ADC報(bào)產(chǎn)。科倫藥業(yè)靶向HER2的ADC藥物A166的上市申請(qǐng)獲CDE受理,用于既往經(jīng)二線及以上抗HER2治療失敗的HER2陽性不可切除的局部晚期、復(fù)發(fā)或轉(zhuǎn)移性乳腺癌。A166能夠靶向HER2表達(dá)的腫瘤細(xì)胞,通過內(nèi)吞進(jìn)入細(xì)胞后,在胞內(nèi)溶酶體中切割并釋放毒素分子高效殺傷腫瘤細(xì)胞,兼具抗體藥物的靶向性以及傳統(tǒng)化療藥物的高殺傷性等特點(diǎn),是科倫博泰首個(gè)提交上市許可申請(qǐng)的ADC藥物。
2.再鼎引進(jìn)「瑞普替尼」擬納入優(yōu)先審評(píng)。再鼎醫(yī)藥從Deciphera公司引進(jìn)的酪氨酸激酶抑制劑瑞普替尼(Ripretinib)的新適應(yīng)癥上市申請(qǐng)獲CDE擬納入優(yōu)先審評(píng),用于治療ROS1陽性的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌成人患者。Ripretinib是全球獲批用于四線治療晚期胃腸道間質(zhì)瘤(GIST)患者的首款新藥,在Ⅲ期臨床INVICTUS中,Ripretinib顯著降低GIST患者85%的疾病進(jìn)展或死亡風(fēng)險(xiǎn)。2021年3月,該新藥用于治療GIST已獲批國內(nèi)上市。
3.遠(yuǎn)大醫(yī)藥引進(jìn)RDC獲批I期臨床。遠(yuǎn)大醫(yī)藥從Isotope公司引進(jìn)的肽受體放射性核素偶聯(lián)藥物(RDC)ITM-11獲國家藥監(jiān)局臨床默示許可,擬開展單臂、開放標(biāo)簽I期臨床,評(píng)估治療胃腸胰腺神經(jīng)內(nèi)分泌瘤(GEP-NETs)的安全性、輻射劑量學(xué)和藥代動(dòng)力學(xué)特征及初步有效性。ITM-11將無載體177Lu與生長抑素類似物偶聯(lián),通過與GEP-NETs表面高水平表達(dá)的生長抑素受體(SSTR)結(jié)合靶向殺傷腫瘤細(xì)胞。去年年底,該新藥已獲得FDA授予快速通道資格。
4.阿斯利康A(chǔ)SO藥物中國報(bào)IND。阿斯利康1類化藥eplontersen注射液的臨床試驗(yàn)申請(qǐng)獲CDE受理。這是一款反義寡核苷酸(ASO)療法,已于今年3月在美國遞交上市申請(qǐng),治療遺傳性轉(zhuǎn)甲狀腺素蛋白(TTR)介導(dǎo)的淀粉樣變性多發(fā)性神經(jīng)病。公布于AAN年會(huì)上的III期NEURO-TTRansform研究66周分析數(shù)據(jù)顯示,與安慰劑相比,eplontersen治療顯著降低患者血清TTR濃度較基線的降幅(82%vs11%,p<0.0001)。
5.邁威B7-H3靶向ADC報(bào)IND。邁威生物1類生物制品“注射用7MW3711”的臨床試驗(yàn)申請(qǐng)獲CDE受理。7MW3711是一款靶向B7-H3的ADC藥物,可與腫瘤細(xì)胞表面的抗原結(jié)合進(jìn)入腫瘤細(xì)胞,通過特定酶解作用,定向釋放小分子,從而實(shí)現(xiàn)對(duì)腫瘤的精準(zhǔn)殺傷。在臨床前研究中,7MW3711在多種動(dòng)物腫瘤模型中均顯示出積極的腫瘤殺傷作用;并在食蟹猴等動(dòng)物安全性評(píng)價(jià)模型中顯示出良好的藥物安全性及藥代特性。
國際藥訊
1.阿斯利康C5補(bǔ)體抑制劑獲批新適應(yīng)癥。阿斯利康長效C5補(bǔ)體抑制劑Ultomiris(ravulizumab)獲歐盟批準(zhǔn)新適應(yīng)癥,用于治療抗水通道蛋白4抗體陽性的視神經(jīng)脊髓炎(NMOSD)。在III期CHAMPION-NMOSD研究中,中位治療為73周時(shí),Ultomiris較安慰劑降低98.6%(p<0.0001)的疾病復(fù)發(fā)風(fēng)險(xiǎn)。在美國,該藥已獲批治療多種自身免疫性疾病,包括陣發(fā)性睡眠性血紅蛋白尿、非典型溶血尿毒綜合征以及全身型重癥肌無力。
2.法布里病創(chuàng)新療法獲FDA批準(zhǔn)上市。Chiesi Global Rare Diseases與Protalix公司聯(lián)合開發(fā)的聚乙二醇化酶替代療法(ERT)Elfabrio(pegunigalsidase alfa)獲FDA批準(zhǔn)上市,用于治療法布里病成年患者。在關(guān)鍵Ⅲ期臨床中,與酶替代療法agalsidase beta相比,Elfabrio治療組患者24個(gè)月時(shí)腎功能改善達(dá)到非劣效性標(biāo)準(zhǔn),而且藥物總體耐受性良好。5月初,該新藥也在歐盟獲批上市。
3.高劑量阿柏西普啟動(dòng)頭對(duì)頭III期研究。拜耳8mg劑量水平阿柏西普啟動(dòng)一項(xiàng)III期QUASAR研究,旨在評(píng)估與標(biāo)準(zhǔn)治療方案Eylea(阿柏西普2mg)相比,用于繼發(fā)于視網(wǎng)膜靜脈阻塞(RVO)的黃斑水腫中以延長治療間隔的方式給藥的有效性和安全性。今年2月份,aflibercept的生物制品許可申請(qǐng)(BLA)已獲得FDA受理,F(xiàn)DA同時(shí)授予其優(yōu)先審評(píng),PDUFA日期為今年6月27日。
4.BI雙重激動(dòng)劑減肥Ⅱ期臨床積極。勃林格殷格翰與Zealand Pharm聯(lián)合開發(fā)的GLP-1/GCG雙重激動(dòng)劑BI 456906,在治療肥胖癥或無2型糖尿病的超重患者的Ⅱ期臨床達(dá)到主要終點(diǎn)。與安慰劑相比,BI 456906皮下注射治療顯著減少患者46周后的體重,體重減輕高達(dá)14.9%。完整數(shù)據(jù)將在2023年美國糖尿病協(xié)會(huì)年會(huì)上公布。此前,該新藥已獲得FDA授予用于治療非酒精性脂肪性肝炎(NASH)的快速通道資格。
5.吉利德收購生物技術(shù)公司XinThera。吉利德宣布收購位于圣地亞哥的生物技術(shù)公司XinThera,并獲得該公司腫瘤學(xué)PARP1小分子抑制劑和炎癥&免疫學(xué)MK2小分子抑制劑共5項(xiàng)處于IND的早期管線資產(chǎn)。PARP1小分子抑制劑能夠促進(jìn)PARP1在DNA上的截留,但不截留PARP2,從而減輕一代PARP抑制劑造成的血液學(xué)毒性副作用,同時(shí)在同源重組缺陷(HRD)的癌癥模型中表現(xiàn)出皮摩爾濃度的選擇性抗腫瘤活性。本次收購具體收購價(jià)格暫未披露。
6.鹽野義2022年新冠藥收入8億美元。5月10日,鹽野義制藥公布2022財(cái)務(wù)報(bào)表,公司總營收4267億日元(約為32.68億美元),同比增長27.3%;凈利潤1490億日元(約11.41億美元),同比增長35.1%;研發(fā)投入1024億日元(約7.84億美元),同比增長40.3%。其中,新冠藥物Xocova(ensitrelvir)在本財(cái)年收入1047億日元(約8.02億美元),占總收入25%。
7.拜耳17億美元開發(fā)多款RDC。拜耳與Bicycle Therapeutics將利用后者開發(fā)雙環(huán)肽的專有噬菌體平臺(tái),針對(duì)拜耳指定的多個(gè)腫瘤靶標(biāo),合作開發(fā)放射性偶聯(lián)候選藥物。根據(jù)協(xié)議,Bicycle將獲得總計(jì)高達(dá)17億美元的款項(xiàng),包括4500萬美元的預(yù)付款,以及開發(fā)和商業(yè)化的里程碑潛在付款。拜耳將負(fù)責(zé)候選藥物的進(jìn)一步的臨床前和臨床開發(fā)、生產(chǎn)和商業(yè)化活動(dòng)。
醫(yī)藥熱點(diǎn)
1.肯尼亞發(fā)生不明傳染病。據(jù)肯尼亞衛(wèi)生部當(dāng)?shù)貢r(shí)間10日表示,該國馬薩比特郡出現(xiàn)不明傳染病,已致9人死亡,另有80多人感染。當(dāng)?shù)蒯t(yī)護(hù)人員表示,大部分患者出現(xiàn)流感癥狀、眼睛發(fā)黃并伴有嚴(yán)重頭痛。首例病例出現(xiàn)在兩周前,他們已及時(shí)上報(bào)衛(wèi)生部,并對(duì)患者進(jìn)行檢測(cè),由于部分患者瘧疾檢測(cè)呈陽性,所以衛(wèi)生部表示不排除當(dāng)?shù)乇┌l(fā)瘧疾疫情的可能性。
2.抗生素?zé)o處方銷售問題嚴(yán)峻。近日,華中科技大學(xué)同濟(jì)醫(yī)學(xué)院公共衛(wèi)生學(xué)院殷曉旭教授團(tuán)隊(duì)在國際期刊《柳葉刀·傳染病》上發(fā)表綜述,系統(tǒng)闡述全球零售藥店抗生素?zé)o處方銷售現(xiàn)狀及其相關(guān)因素。分析結(jié)果顯示,全球零售藥店抗生素?zé)o處方銷售率高達(dá)63.4%,低收入國家顯著高于高收入國家。當(dāng)前全球零售藥店抗生素的無處方銷售仍然較為嚴(yán)峻,近20年來零售藥店抗生素的無處方銷售狀況無明顯改善,有必要重新審視當(dāng)前的政策法規(guī)。
3.日本科學(xué)家發(fā)現(xiàn)腫瘤內(nèi)細(xì)菌可發(fā)揮溶瘤作用。2023年5月7日,日本先進(jìn)科學(xué)技術(shù)研究所的研究人員在《Advanced Science》發(fā)表了研究論文。該研究表明,與天然光合細(xì)菌相關(guān)的腫瘤內(nèi)細(xì)菌具有生物相容性和較強(qiáng)的免疫原性抗癌作用。它們優(yōu)先在腫瘤環(huán)境中生長和增殖,這有效地導(dǎo)致免疫細(xì)胞浸潤腫瘤,并在小鼠模型中產(chǎn)生強(qiáng)烈抗癌效果,顯著延長其生存期。
評(píng)審動(dòng)態(tài)
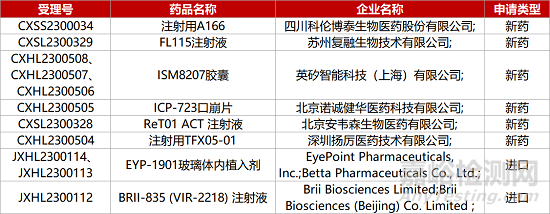
1. CDE新藥受理情況(05月11日)
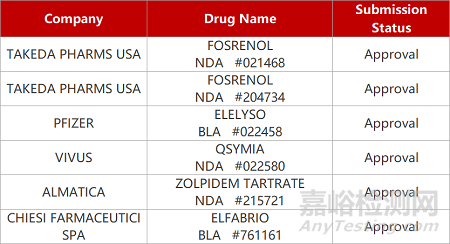
2. FDA新藥獲批情況(北美05月10日)