無菌產品的生產需滿足其質量和預定用途的要求,應當最大限度降低微生物、各種微粒和熱原的污染。無菌產品按滅菌生產工藝可分為兩類:采用最終滅菌工藝的為最終滅菌產品,以及部分或全部工序采用無菌生產工藝的為非最終滅菌產品。無菌工藝生產操作是質量風險管理關注的焦點。
1.與無菌相關的名詞
無菌產品:要求不含活的微生物且滿足內毒素限度標準。
無菌工藝:是指送風、物料、設備和人員在受控環境下避免微生物和微粒物質污染而處理無菌物料的過程。
內毒素:細菌細胞壁中的熱源物質(如脂多糖)內毒素可導致患者在接受注射時導致發熱甚至死亡反應。
無菌工藝的獨特性:無菌如得不到保障或內毒素超標很可能給患者帶來危害。無菌和內毒素的不合格的可探測性很低。
最終滅菌法:罐裝后對密封好的容器進一步處理從而去除微生物污染
工藝過程無菌:通過過程控制無菌制造的一種方法
無菌產品質量風險管理:適用于無菌工藝和最終滅菌工藝中產品微生物風險的辯識、控制和減少內毒素的污染,是基于科學和風險的決策。
2.ICH Q9 (R1)質量風險管理最新指南主要更新內容
2022年,ICH對ICHQ9(R1)質量風險管理指南進行了更新并發布。更新后的指南主要增加了4個方面的內容:包括風險識別改為危害源識別;增加了兩個小章節的內容,包括質量風險管理的正式性和基于風險的決策;附錄的名稱由“風險管理方法與工具”更新為“質量風險管理方法與工具”;在附錄2增加了一個小章節:供應鏈控制中的質量風險管理。
ICHQ9(R1)的更新,主要是想在四個方面加以改進,包括改善風險評估和QRM輸出結果主觀性太強的問題;改善QRM在供應和產品應用方面的管理不足;增加對QRM工作正式性的理解;明確如何以風險為基礎來做決定。通過以上四個方面的強化,希望達到監管方和企業的資源、建立更為有效的、以科學為基礎的控制策略,來改善生產的持續一致性、降低費用成本、減少質量缺陷、召回和藥品短缺的可能性。
在質量風險管理流程圖(圖1)中,包括了風險的啟動、評估、控制、溝通和回顧。新版指南中與前一版指南中不同的地方在于,“風險的識別”更改為“危害源的識別”,只有識別到了危害的根源,才能識別到會有什么危害,然后進行入到風險的分析與評價。這是新版指南中很重要的一個理念上的提升。
圖1:質量風險管理流程圖
質量風險的管理工具有很多,包括,失敗模式和影響分析,還有失效模式、影響與關鍵性分析,故障樹分析,危害源分析及關鍵控制點,危害源及可操作性分析,初步危害源分析,以及風險排序及篩選。本文 中的無菌產品生產的質量風險管理模式,主要會使用失敗模式與影響分析工具。
3.失敗模式和影響分析(FMEA)介紹
FMEA模式的準備,要有高質量的輸入,使得風險評估更加的客觀和有效。第一是確定問題,范圍是從無菌工藝生產的廠房,設備,系統或者工藝中需要被評估的地方。第二需要得到管理層的支持,有一個多學科的專家小組,分配各必要的資源,進行對風險的評估。第三是要有文件記錄:記錄所有的假設、范圍、邊界,背景和基線信息。最后一個是需要有工藝的知識,要了解當前的規范,標準和指南文件。了解最新的工藝數據,有了這些之后才能做一個好的風險評估,降低主觀性,做出的決策會是基礎評估出的風險做出的。
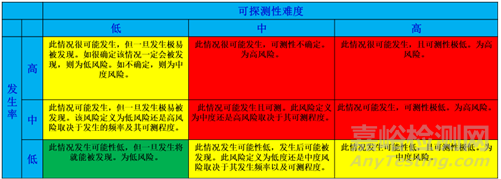
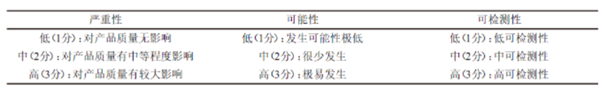
風險定性排序有三種因素(圖2),分別為嚴重性、發生率和可探測性。三種風險因素高的為紅色,非期望事件非常嚴重,經常發生,以及過程失效探測不到,都為高。相對于高,還有中和低的兩種排序。
圖2: 風險定性排序
根據非期望事件的發生率和可探測性的難度進行風險分級。可以看出,發生可能性低與可探測性高兩者結合為風險低;中度風險有四種,高度風險有四種,如圖3。
圖3: 風險定性分級判定
無菌過程風險的評估模式可以通過此下圖4來進行:操作編號,步驟單元,非期望事件,嚴重性,隱患是什么?發生的可能性,現在的控制,以及可探測性,風險的級別,以及對風險是否認可,建議改進的措施,改進后的風險嚴性,發生可能性,可探測性,以及風險的級別。
圖4: 生產過程風險評估模式
4. 質量風險評估對無菌產品生產過程的檢查案例
案例1:凍干瓶制劑軋蓋的質量風險評估
工藝描述:凍干機是經過驗證并建立了泄漏率,凍干前和后時充入無菌過濾空氣,此時有輕微的真空,然后進入壓蓋的階段。
手工把裝有半塞的西林瓶的托盤卸下,并轉移至非A級的壓蓋進瓶區。
進料口是沒有探測膠塞升起的設備,壓蓋機也有可能損壞瓶子的風險;如果膠塞硅膠過大,在壓蓋的過程中會出現膠塞擠出的情況。這個地方也應建立控制系統,從而避免非期望事件的發生。
瓶子的加蓋和脫蓋密封性都是令人滿意的。西林瓶和膠塞的尺寸在接收時也是經過驗證的確認的。在做無菌驗時的培養基灌裝,膠塞和壓蓋步驟之間的持續時間也是經過驗證的。
西林瓶加塞和壓蓋后的會100%進行物理性外觀的檢查。
圖5: 凍干制劑的生產流程圖
針對該無菌制劑生產進程的風險評估進行一些準備。
確定問題:有工藝描述和流程圖,同時更新任何時間進行評估時所得的數據。
風險的鑒定:對于每個操作單元確定有可能造成非無菌操作或環境的潛在原因。操作失敗的嚴重等級始終為高。
現有風險控制的確定:通過一些工序,預防產品上市后對患者帶來的健康方面的影響。
風險分析:三個因素,嚴重性,發生的可能性和可探測性,分別進行定性或者定量,同時使用不種顏色表示。
然后利用風險評估的工具對西林瓶從凍干劑中出來后的單元操作進行分步的評估。如下圖6。
圖6:風險評估對無菌生產進行檢查
首先西林瓶在凍干機中,沒有任何明確的原因顯示會有無菌操作失敗的風險。
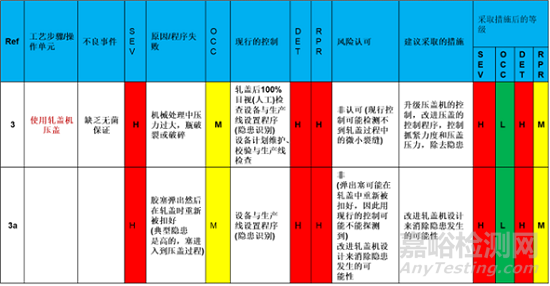
當西林瓶從凍干機中移走托盤時,轉移至壓蓋機中,缺少無菌的保證。第一個隱患是西林瓶的膠塞被擠出或者遺失。當前的控制為使用目視檢查膠塞是否會有被擠出或者遺失的風險,發生的可能性為中等;是否發生只有通過目測,因此可探性不高,風險為高。綜合評估下來的風險定級為高。
建議的措施是在軋蓋的進料口加一個100%的機械膠塞檢測裝置,這個將增加發現的可能性,因此降低了不被探測的風險。
同時設計處理系統,杜絕膠塞補擠出或遺失的可能性,從而降低該風險發生的可能性,兩者結合,整體由于膠塞被擠出或遺失的風險非常低,即可解決這個步驟導致的缺少無菌保證的風險。
第二步,是使用軋蓋機壓蓋,這一步的操作也是缺乏無菌保證。第一個情況是機械軋蓋過程中,可能會因為壓力過大,導致西林瓶破裂或者破碎。這種情況發生的可能性還是有的,為中等。現有的控制方式還是通過100%的人工目測,以及設備的維護和生產線檢查。這種措施對于微小裂縫可探測性不高,因此風險定級為高。采取的措施有升級壓蓋機的控制,改進壓蓋機的程序,控制壓力,去除隱患。
該步驟第二程序失敗的情況是膠塞可能被彈出,然后在軋蓋時重新被扣好。發生的可能性還是有的,為中等。但被檢測的可能性不高,因此風險為高。采取的措施是改進軋蓋機的設計,從而消除隱患發生的可能性。
同時,增加西林瓶真空的探測,大大增加了可探測性,減少不良事件的發生。
進一步將壓蓋的操作環境改為在A級環境中操作。因此結合上述的措施:升級壓蓋機的控制,改進壓蓋機的設計,增加真空的探測性,同時將壓蓋的環境改善,西林瓶的壓蓋的非無菌保障的風險可以降到最低。
案例2:內毒素限度超標的質量風險評估
過程描述:原料和部件從批準的外部供應商購買,然后放在塑料袋中,保存在倉庫。
質量部門按照建立的規格進行取樣和放行。檢測人員都經過培訓。
根據批記錄指令,在經用蒸氣清潔合格的罐內,溶解原料藥于注射用水,最終過濾除菌,進行灌裝。本風險評估關注的工藝過程主要為原料和部件的接收、放行,以及密封件的滅菌和去熱源。
工藝生產簡化流程圖如圖7。識別到的內毒素潛在污染的風險點有三個:進廠粉狀原料被內毒素污染;進廠密封性包材被污染;密封性包材沒有正確的去熱源。
圖7: 無菌灌裝產品的工藝流程圖
對這三個識別到的風險點進行失敗因素影響分析。
圖8:進廠原料/密封性包材的內毒素污染的質量風險評估
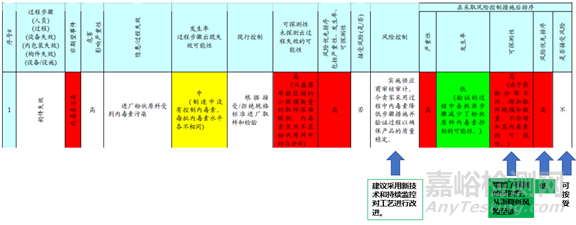
第一個是進廠原料被內毒素污染。針對這個風險點的最初控制是是根據現有的進廠標準進行取樣檢測。那因為取樣是單獨容器的進行的,原料被污染的可能性是有的,為中風險;部分原料被內毒素污染的可探測性很低,為高風險。因此整體風險的定級為高風險;采取的措施是實施供應商的審計,可以降低風險發生的可能性。同時建議采用新技術和持續監控的工藝改進,這樣可以增加可探測性,從使得發生率和可探測性的風險都降低,最后風險定級為可低,可接受。
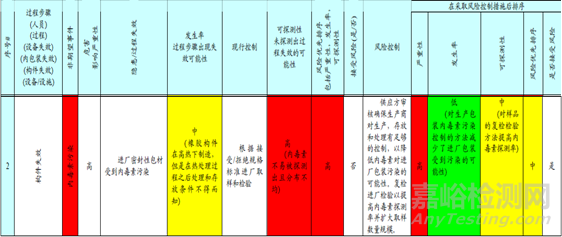
第二個風險是對于進廠密封包材的污染。 目前的控制措施為根據現有進廠程序進行取樣和放行。這種風險的發生依然是存在的,為中風險。
包材的內毒素可探測性很低,因此風險較高。采取的措施為供應商審計。確保部件放行是有保證的。同時入廠也擴大取樣規規,從而降低探測性方面的風險。風險雖然中,但已經可以接受。
第三個風險是密封性包材沒有除熱源的風險。依然有可能發生,風險為中。現行的控制方式是驗證過程保證一定的時間,人員培訓,注射用水,入廠檢測等措施。這些措施的失敗后,內毒素的可探測水平依然不高,有風險。因此需要采取措施,使用自動化驗證過的密封性包材,同時有出廠檢驗和入廠檢驗,入廠檢驗增加樣品的取樣量。從而使得密封性包材被污染的風險為低,是可接受的。
案例3:無菌粉針劑產品(分裝工藝)共線生產風險評估
ISPE指南《基于風險分析的制藥產品生產》提出了“初始暴露原理”。初始暴露原理,即暴露/交叉污染如何產生的,應考慮以下四個基本因素:
(1)混淆,即錯誤的物料;
(2)清潔(殘留),不充分的清潔;
(3)機械轉移過程,將殘留風險從一件產品轉移到另一產品;
(4)空氣轉移,即空氣中的粉塵接觸產品、設備。
這四個基本因素歸納起來便是混淆與交叉污染。
因此,從混淆與交叉污染兩個層面,對無菌粉針劑產品共線生產的風險進行評估與分析。
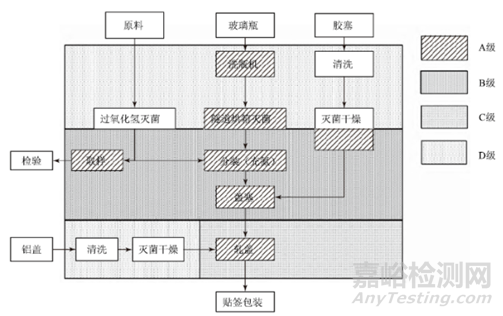
本案例的主要工藝點包括:原料藥的取樣、玻璃瓶的清洗干燥滅菌、膠塞的清洗滅菌、分裝及分裝器具的清洗滅菌、鋁蓋的清洗滅菌及軋蓋、貼簽包裝,應對每一個工藝點可能產生混淆、污染與交叉污染的風險點進行識別,具體流程如圖9。
圖9:無菌粉針劑的生產流程圖
同樣使用失效模式和影響分析工具,對三個因素分別打分,然后進行相乘,得到風險系數。風險系統的接受標準為小于等于10。計算方法:風險系數(RPN)=嚴重性(S)×可能性(O)×可檢測性(D)。風險系數接受標準:RPN ≤ 10
通過列表分析,可以看出,在取樣工具和清洗池中的交叉污雜的風險較高。玻璃瓶的儲存容易出現混淆。膠塞的清洗存放易出現混淆。分裝粉針使用的工具易出現交叉污染。
圖10:無菌粉針劑產品共線生產各工藝點的風險評估
針對上述易出現交叉污染和混淆的點,制定了控制措施。取樣工具的清洗方法進行清潔驗證,存在的配伍禁忌產品單獨使用取樣工具,從而使得原料的取樣工具交叉污染的風險系數降低。
對于玻璃瓶的清洗后儲存,加強品種的清場和檢查,降低風險。對于膠塞的清洗后儲存,規定出料時間,加強檢查。從而降低混淆的風險。
對于分裝的器具清洗交叉污雜,增加清洗驗證,減少交叉污染的風險。
圖11:制定必要的風險控制措施,然后進行二次FMEA分析
5. 小結
案例1和案例2對于無菌工藝的質量風險評估,運用了風險失效模式和影響分析對無菌制劑進行質量的評估。運用過程的描述和工藝流程圖了解和掌握生產工藝的風險隱患點。運用建立好的風險排序,定級系統和評估表格進行評估分析,并提出改進措施。風險降低后,與各方進行風險的接受,溝通和審核。
案例3是對共線生產無菌制劑存在混淆和交叉污染的風險評估,運用工藝描述和流程圖收集工藝知識。運用常見的評估工具進行風險點的識別和分析,最后進行必要的控制措施,進行二次FMEA分析,最后落實改進措施。
6. 參考文獻:
Technical report No.44:Quality risk management for aseptic processes, PDA, 2008
ICH Q9 (R1)質量風險管理, ICH, 2023.1
區菌粉針劑產品共線生產的風險評估與分析,毛述春等,機電分析,2017
FDA 483報告解讀精選,2022度,海螺研習社