您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2023-03-23 21:32
為縮短醋氯芬酸分散片的分散時間,本文對醋氯芬酸分散片制備工藝進行了技術改進,并對新工藝進行了驗證——以醋氯芬酸顆粒的性狀、水分、含量,分散片的性狀、鑒別、有關物質等為考察指標,對原制備工藝和新制備工藝進行對比研究。實驗結果證明,新工藝制得的分散片的各項參數均符合標準要求,且該工藝重現性好,產品分散均勻、有效成分溶出快,這為醋氯芬酸分散片的生產提供了有效的參考依據。
分散片是指在水中能夠迅速崩解,并均勻分散的片劑。分散片具有服用方便、崩解迅速、吸收快、生物利用度高等特點。較普通片劑或膠囊劑而言,分散片可縮短口服給藥的達峰時間,并提高峰濃度,具有臨床上的治療優勢。而且其便于年老體弱者、吞咽功能障礙者、嬰幼兒等特殊患者用藥,是很受歡迎的劑型[1-3]。醋氯芬酸常見的劑型為普通片劑和硬膠囊劑[4],適用于骨關節炎、類風濕性關節炎和強直性脊椎炎引起的疼痛和炎癥的治療。為充分利用分散片的優點,快速減輕患者病痛,增強醋氯芬酸強效解熱、鎮痛的效果,現將溶解性差的醋氯芬酸制成分散片,對醋氯芬酸分散片的制備工藝進行研究,為醋氯芬酸分散片的生產提供必要的參考依據。
Part1 實驗材料
1.1 設備與儀器
WF-30B萬能粉碎機、CH-200槽型混合機、YK160搖擺式顆粒機、FL-200沸騰制粒干燥機、SBH-800三維擺動混合機、ZP37旋轉式壓片機、JC-TP分析天平、BJ-2崩解測試儀、LC20AT高效液相色譜儀、SDR1911紫外可見分光光度計。
1.2 物料
醋氯芬酸、羧甲基淀粉鈉、微晶纖維素、低取代羥丙基纖維素、交聯聚維酮、十二烷基硫酸鈉、阿司帕坦等物料經檢驗均符合中國藥典2020年版規定的質量標準。
1.3 檢驗試劑
乙醇、0.6%鐵氰化鉀、0.9%氯化鐵、1%鹽酸、磷酸、醋酸鈉、冰醋酸、雙氯芬酸鈉、磷酸二氫鉀、氫氧化鈉、乙腈。
Part2 制備工藝對比
2.1 原制備工藝
醋氯芬酸分散片規格為0.1?g,取原料醋氯芬酸約40%,輔料:羧甲基淀粉鈉30%、微晶纖維素15%、低取代羥丙基纖維素10%,按制備工藝:將原料醋氯芬酸粉碎100目,細粉與輔料羧甲基淀粉鈉(內加25%)、微晶纖維素、低取代羥丙基纖維素等置混合機混合10?min→加入潤濕劑(純化水適量)→混合3?min→搖擺制粒(16目)→干燥(溫度70±5℃、時間約2.5?h)→搖擺整粒(16目)→總混20?min(加入羧甲基淀粉鈉5%、硬脂酸鎂2%)→壓片(沖頭Φ9?mm淺凹、轉速控制在25-30?r/min),進行壓片即得。
2.2 新制備工藝
醋氯芬酸分散片規格為0.1?g,取原料醋氯芬酸約40%,輔料:羧甲基淀粉鈉20%、微晶纖維素15%、低取代羥丙基纖維素10%、交聯聚維酮10%、十二烷基硫酸鈉0.2%[5-6],甜味劑和矯味劑阿司帕坦[7],按制備工藝:將原料醋氯芬酸粉碎100目,細粉與輔料羧甲基淀粉鈉(內加15%)、微晶纖維素、低取代羥丙基纖維素、交聯聚維酮、十二烷基硫酸鈉等置混合機混合10?min→加入親水性粘合劑(3%低取代羥丙基纖維素水溶液適量)→混合3?min→搖擺制粒(16目)→干燥(溫度65±5℃、時間約3?h)→搖擺整粒(16目)→總混20?min(加入羧甲基淀粉鈉5%、微粉硅膠2%、硬脂酸鎂2%)→壓片(沖頭Φ9?mm淺凹、轉速控制在25?r/min),進行壓片即得[8—10]。
2.3 顆粒檢查對比
按醋氯芬酸分散片原制備工藝和新制備工藝分別進行實驗3次,對其顆粒性狀、顆粒水分、顆粒含量進行檢查。
(1)合格標準
顆粒性狀:應為白色或類白色顆粒。
顆粒水分:≤2.5%。
顆粒含量:本品所含的醋氯芬酸(C16H13Cl2NO4)應為標示量的39.5%~42.5%。
(2)檢查結果對比

表1 原制備工藝和新制備工藝顆粒性狀、顆粒水分、顆粒含量檢查結果
結果對比見表1。顆粒含量高效液相色譜檢查對比結果見圖1、圖2。

圖1 原制備工藝顆粒含量高效液相色譜檢查(3次實驗疊加圖)

圖2 新制備工藝顆粒含量高效液相色譜檢查(3次實驗疊加圖)
(3)顆粒對比結論
經過對比得出:新制備工藝從處方設計上增加了優質崩解劑交聯聚維酮、表面活性劑十二烷基硫酸鈉,采用親水性粘合劑替代了原制備工藝潤濕劑純化水制粒,使得制粒更容易、操作更方便,原制備工藝和新制備工藝顆粒的性狀、水分、含量等各項檢查均符合質量標準要求,檢驗數據重現性好,檢查結果符合規定。
2.4 分散片檢查對比
按醋氯芬酸分散片原制備工藝和新制備工藝分別進行實驗3次,對分散片的性狀、有關物質、溶出度、分散均勻性、含量測定進行檢查。
(1)合格標準
性狀:應為白色或類白色片。
有關物質:供試品溶液的色譜圖中,如有與醋氯芬酸保留時間一致的色譜峰,按外標法以峰面積計算,不得超過醋氯芬酸標示量的0.4%,其他單個雜質(除阿司帕坦輔料峰外)的峰面積不得大于對照溶液中的醋氯芬酸峰面積(0.2%),其他各雜質峰面積的和不得大于對照溶液中醋氯芬酸峰面積的5倍(1.0%)。
溶出度:限度為不少于標示量的80%。
分散均勻性:3?min內應全部崩解并通過710?µm篩網。
含量測定:本品所含的醋氯芬酸(C16H13Cl2NO4)應為標示量的95.0%~105.0%。
(2)檢查結果對比
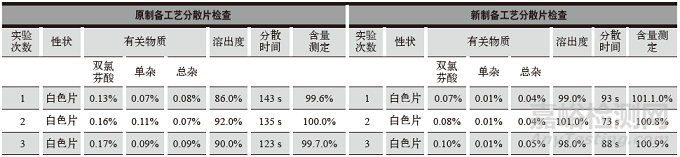
表2 原制備工藝和新制備工藝性狀、有關物質、溶出度、分散均勻性、含量檢查結果
結果對比見表2。含量測定高效液相色譜檢查對比見圖3、圖4。
圖3 原制備工藝分散片含量測定高效液相色譜檢查(3 次實驗疊加圖)

圖4 新制備工藝分散片含量測定高效液相色譜檢查(3 次實驗疊加圖)
(3)分散片對比結論
通過對比得出:新制備工藝從處方設計上增加了助流劑微粉硅膠與潤滑劑硬脂酸鎂,顆粒流動性更好,有利于壓片生產。新制備工藝分散片的有關物質醋氯芬酸、單雜、總雜,分散時間均優于原制備工藝。新工藝分散片的性狀、有關物質、溶出度、分散均勻性、含量等各項檢查均符合質量標準要求,檢驗數據重現性好,檢查結果符合規定。
Part3 結果與討論
新制備工藝從處方設計上增加了優質崩解劑交聯聚維酮、表面活性劑十二烷基硫酸鈉,增加了助流劑微粉硅膠與潤滑劑硬脂酸鎂,采用親水性粘合劑3%低取代羥丙基纖維素水溶液替代了原制備工藝中的潤濕劑純化水。新工藝通過以上這些措施加速了片劑的崩解,促進藥物的溶出。而且采用新工藝制得的半成品顆粒的性狀、水分、含量,分散片有關物質、溶出度、分散均勻性、含量等各項檢查均符合質量標準要求。
在實驗過程中,發現分散片的制備應根據原料特性(如難溶性藥物)考慮是否進行微粉化處理,由于崩解劑處方用量大,生產過程應注意防潮,產品包裝應選用合適的防潮包裝材料。
參考文獻
[1]黃大福.分散片研究進展[J].臨床醫藥文獻雜志,2017,4(47):9289-9291.
[2]康艷萍.丹參分散片制備工藝研究[J].海峽藥學,2018,30(05):8-10.
[3]藍美英,徐凱,曾華哲,鄭曉斌.克拉霉素分散片制備工藝研究[J].中國處方藥,2021,19(08):33-35.
[4]國家藥典委員會.中華人民共和國藥典(2020年版) 二部[M]北京:中國醫藥科技出版社,2020:1794-1796.
[5]王曉燕,劉韻,潘衛三.國內外交聯聚維酮在直壓工藝中的一致性研究[J].中南藥學,2019,17(04):536-541.
[6]謝英花,張冬梅,韓鈺,等.基于增溶作用的阿苯達唑分散片研究[J].河北科技大學學報,2021,42(06):619-626.
[7]國家藥典委員會.中華人民共和國藥典(2020年版) 二部[M]北京:中國醫藥科技出版社,2020:676.
[8]門靖,賈瑋,王偉,等.藥用輔料二氧化硅在醫藥制劑中的應用研究進展[J].有機硅材料,2018,32(05):416-420.
[9]黃淑萍,何華,吳青青,等.硬脂酸鎂對鹽酸特拉唑嗪膠囊溶出的影響[J].中國醫院藥學雜志,2018,38(03):254-257.
[10]張振梁,趙明.撲熱息痛分散片的制備工藝及穩定性研究[J].當代化工,2021,50(06):1362-1365.

來源:制藥工藝與裝備


