您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2023-02-14 16:23
本文適用于一次性使用醫用沖洗器產品。按照《醫療器械分類目錄》,一次性使用醫用沖洗器產品(以下簡稱沖洗器),分類編碼為14-07-01,管理類別為II類。
一、一次性使用醫用沖洗器的結構組成與工作原理
1. 結構組成
目前,沖洗器一般由噴管(如:淋浴狀噴管,刷狀噴管等)、槍體(含鎖環和扳機)、進液管、電源盒和吸引管等組成。典型的產品結構一般包括A鎖環、B淋浴狀噴管、C槍體、D進液管、E袋裝沖洗藥液(生理鹽水等,非系統的構件)、F刷狀噴管、G電源盒、H扳機、J吸引管等部件。產品結構參考示意圖見圖1。(說明:產品因電源內置或使用網電源等及其他結構性差異,與圖示情形可能不完全一致)
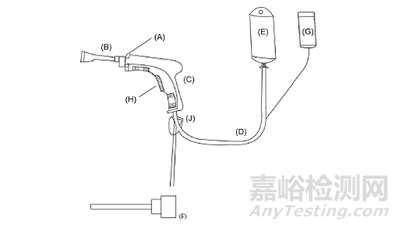
圖1 沖洗器結構示意圖
2.工作原理
槍體內的微型電機,帶動活塞往復運動,使活塞腔內容積發生變化,容積增大沖洗液被吸入,容積變小沖洗液被壓出,槍體前端可裝配不同類型的噴管,沖洗液通過不同類型噴管后的形態和沖擊力會有差異,達到沖洗手術創面的目的。沖洗器槍體內的主要部件有:A電機、B電機齒輪、C皇冠齒輪、D沖洗泵活塞、E齒輪芯軸、F控制器板手、G單向閥墊、H沖洗泵上蓋、I管路接頭、J管路連接壓圈。沖洗器槍體結構爆炸參考示意圖見圖2。產品配有吸引管路,與吸引器配套使用可同時吸引廢液。利用一定壓力下的脈動沖洗液流沖洗創面組織,使創面內的細菌、異物等與組織脫離,達到清潔目的。
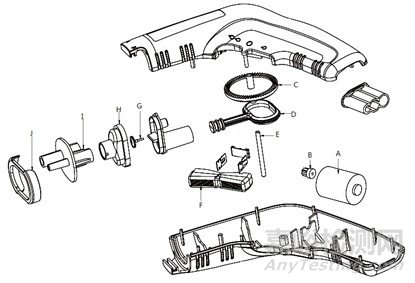
圖2 沖洗器槍體結構爆炸示意圖
二、一次性使用醫用沖洗器的主要風險
以下依據YY/T 0316《醫療器械風險管理對醫療器械的應用》中附錄E(表E.1)從各方面列舉了沖洗器產品的危險(源)分析。
表1 危險(源)、可預見事件序列、危險情況及傷害示例
|
危險(源) |
可預見事件序列 |
危險情況 |
傷害 |
|
能量危險(源) |
電能(電擊危險(源)) |
外殼絕緣性能不良,漏電流值超標,導致外殼漏電流超過安全值。 |
患者觸電受傷。 |
|
熱能 |
使用環境過熱,導致電子元器件發熱。 |
患者燙傷。 |
|
|
生物學危險(源) |
組成產品的各原材料有毒性(如:PC料、ABS料、粘合劑等)或環氧乙烷解析不徹底 |
患者接觸到還原性物質、環氧乙烷殘留量超標的產品。 |
患者機體發熱、局部組織壞死,嚴重時導致死亡。 |
|
產品內有細菌污染,如產品滅菌不徹底、注塑包裝材料和過程不符合要求等 |
患者接觸到細菌污染的產品。 |
引起患者感染,嚴重時導致死亡。 |
|
|
產品有熱源,如生產過程中初始污染菌超標或原材料熱源超標 |
患者接觸到有內毒素的產品。 |
患者發生熱源反應,嚴重時死亡。 |
|
|
包裝材料老化、破損等致使產品染菌和引起毒性 |
患者接觸到有毒性或細菌污染的產品。 |
引起患者感染,嚴重時導致死亡。 |
|
|
產品與藥物不相容 |
患者接觸到失效或有毒性的藥液。 |
無法達到清洗傷口的目的,嚴重時導致死亡。 |
|
|
環境危險(源) |
電磁場 |
沖洗器使用時與射頻通訊設備距離低于安全距離,或周圍電磁環境超出普通商業或醫院環境允許值。 |
產品使用時受到電磁干擾無法運行,影響手術進程。 |
|
儲存或運行偏離預定的環境條件 |
設備本身不能滿足規定的環境條件要求或工作環境得不到滿足。 |
設備不能夠正常運行。 |
|
|
由不正確的能量和物質輸出所產生的危險(源) |
電能 |
連接中斷時設備可觸及部分帶電。 |
電池短路、發熱、爆炸。 |
|
與醫療器械使用有關的危險(源) |
不適當的操作說明 |
沖洗器沒有使用說明書和技術說明書,或其內容不全。如缺少必要的警告說明、缺少詳細的使用方法、缺少必要的技術參數、缺少電路圖和元器件清單、缺少運輸和貯存環境條件的限制。 設備在單一故障狀態下運行。 |
產生危險。 |
|
產品有效期標識不清晰 |
患者接觸到過期有菌產品。 |
感染,嚴重時導致死亡。 |
|
|
庫房儲存環境不符合要求 |
產品材料老化。 |
感染,延誤治療。 |
|
|
一次性使用標識不清晰 |
產品被重復使用。 |
感染,嚴重時導致死亡。 |
|
|
產品說明書中沒有明確安全使用注意事項 |
醫務人員不能正確使用產品。 |
延誤治療。 |
|
|
提供的安全信息不完整或不規范 |
出現危險操作。 |
影響手術進程,危害患者健康。 |
|
|
功能的喪失或變壞 |
連接部位不密封,沖洗液體滲漏,或不能回吸廢液。 |
影響手術進程,危害患者健康。 |
三、一次性使用醫用沖洗器性能研發實驗要求
1.一次性使用醫用沖洗器主要技術指標
1.1外觀要求
1.2性能指標
1.2.1鎖環應能鎖緊槍頭,無松動現象。
1.2.2沖洗控制應靈敏可靠,無卡殼現象。準確控制開啟和停止。
1.2.3明確可用噴管形狀,噴出液體形態。如:選淋浴狀噴管時,可噴出呈圓錐狀液體;選刷狀噴管時,可噴出呈圓柱狀液體。
1.2.4明確在具體條件前提下,可控制噴射出的液體距離和流量。
1.2.5吸引管路應具有控制吸引的功能。
1.2.6連接部位應密封,牢靠無松脫。
1.2.7對重要零部件的關鍵尺寸進行明確。
1.3化學性能
1.3.1可萃取金屬含量
1.3.2酸堿度
1.3.3易氧化物
1.3.4環氧乙烷殘留量(如適用)
1.4無菌
1.5安全性能:符合GB 9706.1的要求。
1.6電磁兼容:應符合YY0505的要求。
2.一次性使用醫用沖洗器材料要求
2.1進液管和吸引管
對于采用醫用PVC (軟聚氯乙烯)的材料,管材應符合GB 10010《醫用軟聚氯乙烯管材》標準要求;瓶塞穿刺器應符合GB 8369《一次性使用輸血器》標準要求。
2.2噴管
對于采用醫用聚丙烯的材料,應符合YY/T 0242《醫用輸液、輸血、注射器具用聚丙烯專用料》標準要求。
3.一次性使用醫用沖洗器性能研究
開展產品性能研究以及產品技術要求的研究,明確功能性、安全性指標(如電氣安全與電磁兼容)以及與質量控制相關的其他指標,所采用的標準或方法、采用的原因及理論基礎。
4.生物相容性評價研究
對成品中與患者和使用者直接或間接接觸的產品部件,應當按GB/T 16886.1規定的原則進行生物相容性評價。
生物相容性評價研究應當包括:明確生物相容性評價的依據和方法;明確產品所用材料及與人體接觸的性質;明確實施或豁免生物學試驗的理由并論證;對于現有數據或試驗結果的評價。提示:應關注液路部件材質,性能,標準等要求。
5.滅菌/消毒工藝研究
5.1滅菌確認、包裝研究(無菌部件)
5.1.1生產企業滅菌:明確滅菌工藝(方法和參數)和無菌保證水平(SAL),并開展滅菌驗證及確認的相關研究。
5.1.2使用者滅菌:產品為無菌交付,一次性使用,不適用使用者滅菌。
5.2殘留毒性:若產品經滅菌或消毒后可能產生殘留物質,應當對滅菌或消毒后的產品進行殘留毒性的研究,開展研究明確殘留物信息及處理方法。
6.穩定性研究
6.1貨架有效期
應當開展貨架有效期和包裝研究,證明在貨架有效期內,在生產企業規定的運輸貯存條件下,產品可保持性能功能滿足使用要求,具有微生物限度要求的產品還應當符合微生物限度要求,以無菌狀態交付的產品還應保持無菌狀態。
6.2使用穩定性
應當開展使用穩定性/可靠性研究,證明在生產企業規定的使用期限/使用次數內,在正常使用、維護情況下,產品的性能功能滿足使用要求。
6.3運輸穩定性
應當開展運輸穩定性和包裝研究,證明在生產企業規定的運輸條件下,運輸過程中的環境條件(例如:震動、振動、溫度和濕度的波動)不會對醫療器械的特性和性能,包括完整性和清潔度,造成不利影響。
7.其他研究
該產品是《免于臨床評價醫療器械目錄》產品,開發應當按照《列入免于進行臨床評價醫療器械目錄產品對比說明技術指導原則》,從基本原理、結構組成、性能、安全性、適用范圍等方面,證明產品的安全有效性。

來源:嘉峪檢測網


