您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-11-17 12:19
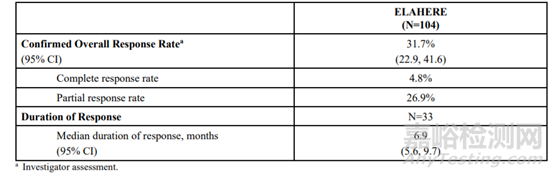
11月14日,FDA加速批準ELAHERE(Mirvetuximab soravtansine-gynx)用于葉酸受體α(FRα)陽性,鉑耐藥上皮性卵巢癌、輸卵管癌或原發性腹膜癌的成年患者,這些患者之前接受過一至三種全身治療方案。ELAHERE是一種抗體藥物偶聯物(ADC),FDA說明書顯示,在一項有104名鉑耐藥的卵巢癌患者參與的臨床試驗中,總緩解率為31.7%,其中完全緩解率為4.8%,部分緩解率為26.9%,中位持續緩解時間是6.9個月,臨床終點數據尚未成熟。
ELAHERE的初步療效數據
這是一款全新的卵巢癌療法,也是卵巢癌治療領域的第一款ADC,Mirvetuximab 是一種IgG1,可靶向于葉酸受體α,而小分子部分是一種微管抑制劑,該產品只需三周注射一次。11月15日,華東醫藥公告顯示,該產品為其子公司與ImmunoGen合作研發項目,已經于2021年3月在中國已經獲批IND,正處于臨床研究階段,計劃在2023年下半年向NMPA遞交BLA申請。

來源:藥事縱橫


