您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-08-11 07:27
本文我們來講講CDE和EDQM在藥學變更事項、分類和研究工作的異同。首先我們要清楚國內原料藥藥學變更最重要的指導原則為CDE制定發布的《已上市化學藥品藥學變更研究技術指導原則(試行)》(2021年2月10日發布,發布即生效)。該指導原則包含了化學原料藥(含無菌)和化學制劑的化學變更類型,其中具體跟原料藥相關的變更事項共有六項,分別為 三、變更原料藥生產工藝;七、變更生產批量;八、變更注冊標準;九、變更包裝材料和容器;十、變更有效期和貯藏條件;十二、變更生產場地。每種事項又根據對藥品安全性、有效性和質量可控性產生影響的潛在風險,分為三類:重大變更、中等變更、微小變更。而在EDQM遞交CEP變更時主要參照的指南為《GUIDELINE ON REQUIREMENTS FOR REVISION/RENEWAL OF CERTIFICATES OF SUITABILITY TO THE EUROPEAN PHARMACOPOEIA MONOGRAP》(2018年9月更新,2019年1月實施)。該指南適用于化學原料藥(含無菌),草藥,生物原料藥(TSE),不包含制劑。其中涉及化學原料藥藥學的變更有五項1.生產(Manufacture)2. 最終產品控制(Control of the final substance)3. 容器密閉系統(Container closure system) 4. 穩定性(Stability)5. 設計空間和批準后變更管理方案(Design space and Post-Approval Change Management Protocols)。根據變更對最終產品質量的潛在影響分為通知(AN)、立即通知(IN)、微小(MIN)、重大(MAJ)。
下圖為兩個指導原則變更事項的對應關系:
從下圖可以看出CDE和EDQM劃分的原料藥藥學變更的事項基本是一致的,除了EDQM的第5類:設計空間和批準后變更管理方案。目前國內還沒有實施該類變更,本文不做對比。
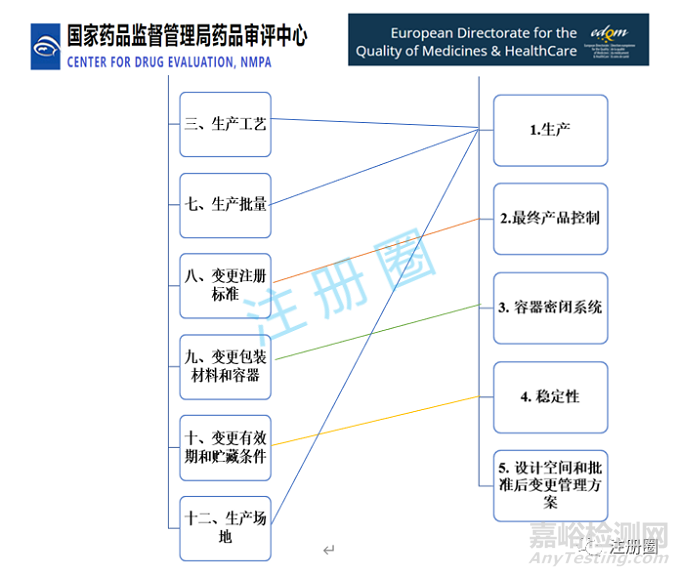
為了方便對比,下面按照CDE劃分的變更事項逐一對兩個藥監機構的變更級別和研究資料要求進行對比。對于EDQM需要提交的一些聲明信,在以下表格未列出。需要注意的是,CDE建議變更研究驗證采用商業化生產規模樣品,如采用中試規模樣品,應提供充分的依據。而EDQM要求至少為中試規模。
生產工藝
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
微小變更 |
1. 增加新的生產過程控制方法或制訂 更嚴格的過程控限度,以更好地控制 品生產和保證藥品質量。 如果上述變更是因為原料藥生產過程中發現存在工藝缺陷或穩定性問題而進行的,應按照重大變更進行申報。 2. 提高起始原料、中間體的質量標準。 3. 變更原料藥生產工藝中所用反應試劑、溶劑的質量標準或級別,但不降低反應試劑、溶劑的質量。 4. 變更最后一步反應之前的工藝步驟中使用的生產設備,或變更最后一步反應及之后工藝步驟中使用的生產設備且材質、設計和工作原理不變,原料藥雜質譜或關鍵理化性質(如粒度、晶型等)不變。 5. 變更起始原料的供應商(指實際生產者,以下同),起始原料的合成路線不變,且起始原料的質量不降低。 |
AN |
1. 增加新的成品中控檢測或增加起始物料/試劑/中間體質量標準項目/限度。 變更不是因為生產中意外事件引起的,且增加的項目不為關鍵項,例如不在其他步驟控制的含量,雜質,致突變雜質,元素雜質或所有關鍵物理特性,例如粒徑分布、松密度或振實密度、鑒別檢測、水分均為關鍵項。 2. 檢測方法不變的情況下,收緊中控檢測限度,或提高起始物料/試劑/中間體質量標準限度。 變更不是因為生產中意外事件引起。 3. 刪除不重要的中控檢測或起始物料/試劑/中間體 的質量標準項目。 變更不是因為生產中意外事件引起。 4. 輕微改變/更新中控/起始物料/試劑/中間體檢測方法。 已根據相關指南進行了適當的驗證研究,且顯示更新后的檢測方法至少等同于原來的檢測方法。 5. 中間體或成品生產工藝輕微變更,預期不會對成品的質量、安全性或控制策略產生影響。 成品或中間體的質量標準保持不變,對成品雜質譜沒有質和量的負面影響。(輕微指的是:合成路線保持不變,即中間體保持不變,沒有新的試劑、催化劑或溶劑用于生產工藝(例如,操作條件無重大調整、設備無重大變更、增加返工步驟,即直接重復已批準的步驟、同一步驟內重復洗滌/精制操作、改變/升級無菌級別物料以外的設備)。 |
|
研究工作 |
|
研究工作 |
1. 已批準的和新的中控檢測或起始物料/試劑/中間體質量標準項目/限度的對比表格;相關時,新的非藥典分析方法的詳細描述和驗證數據。 2. 已批準的和新的中控檢測限度或起始物料/試劑/中間體質量標準限度的對比表格。 3. 已批準的和新的中控檢測或起始物料/試劑/中間體質量標準項目/限度的對比表格;CEP 持有人對刪除的中控檢測沒有重大影響原因的風險評估。 4. 同1 5. 根據已批準的和新的工藝各生產的至少兩批(最小批量為中試批量)成品的批分析數據(采用比較表格);已批準和新的工藝的直接對比。 |
|
筆者說明 |
1. 從可閱讀性看,CDE發布的變更指導原則的變更類型和文件要求更為清晰明了,而EDQM的指南則對每種變更設定了很多前提條件。同屬于AN的變更,所要求的資料也按照實際變更進行了具體化的說明。在做CDE變更時,關于“對變更后的工藝進行研究”,如果不知道需要研究什么時,也可以參考EDQM的資料要求。 2. 關于CDE變更指導原則里的設備變更,EDQM全文是沒有該變更事項,筆者也專門聽了EDQM關于該指南的相關培訓,EDQM解釋是EDQM只要求申請人在初次遞交時對設備有一個大概的描述(generic description),EDQM在審評時也不會非常仔細的去看這一塊內容。如果后續設備發生了變化,需要申請人根據對產品質量的潛在影響自行進行變更分類。如干燥設備的變更,對于EDQM來說就會進行額外關注。而如何界定設備的設計和工作原理,建議參考FDA的相關指南Post-approval Changes to Drug Substances Guidance for Industry 和SUPAC: Manufacturing Equipment Addendum -Guidance for Industry。 3. 關于雜質譜不變的定義,CDE在變更指導原則也做了詳細的解釋,EDQM變更時可以參考。 4. 關于EDQM里的“分析方法的輕微改變”,EDQM也舉了例子,如,色譜柱長或柱溫變更,而不是改變方法所用柱子類型。(可參考Ph.Eur 2.2.46) 5. CDE指導原則中最后一步反應僅限于形成共價鍵的化學反應,成鹽等反應不包括在內。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
中等變更 |
1. 在批準工藝路線基礎上延長工藝路線,將原起始原料作為中間體,其中延長的工藝路線與原起始原料一致。 2. 變更起始原料的合成路線,起始原料的質量不降低。 3. 變更最后一步反應之前的工藝步驟中的反應試劑、溶劑種類、生產條件等(重大變更(4)除外),但原料藥雜質譜保持一致。如上述增加或變更的溶劑種類在變更前原料藥合成工藝中已使用,可按照微小變更管理。 4. 將返工工藝作為固定的生產步驟納入注冊生產工藝導致的注冊生產工藝變更。 5. 變更起始原料、中間體的質量標準(微小變更(2)除外),變更后起始原料、中間體的質量控制水平不得降低。 6. 變更最后一步反應及之后工藝步驟中使用的生產設備,材質、設計和工作原理發生變化,原料藥雜質譜或關鍵理化性質(如粒度、晶型等)不變。 7. 無菌原料藥的以下情形: ①變更除菌過濾過程的濾過參數(包括流速、壓力、時間、或體積,但孔徑不變),且超出原批準范圍的。 ②除菌工藝過濾器從單一過濾器改為兩個無菌級過濾器串聯。 |
IN |
1. 非無菌原料藥變更起始原料生產商(筆者注:這里變更指增加或替換)并且與已批準生產商不屬于同一集團。新生產商起始物料質量標準,及變更后的原料藥質量標準保持不變。 |
|
研究工作 |
|
研究工作 |
|
|
筆者說明 |
1. 關于CDE變更指導原則中的起始原料、中間體質量不降低,CDE在開展法規培訓時也強調了“是實際質量不得降低,而不是只要符合原先的質量標準即可”。這主要針對一些較早批準的原料藥,由于當時的法規環境,并沒有對起始原料或中間體的雜質進行控制,固沒有納入質量標準中,針對此類情況,建議申請人根據合成路線,重新評估起始原料或中間體的潛在雜質(有機雜質,元素雜質,殘留溶劑,致突變雜質),并通過實際檢測幾批變更前的起始原料或中間體,了解雜質上限水平,確保變更后的起始原料或中間體的雜質不高于該上限。 2. 關于粒度和晶型是否為原料藥的關鍵理化性質可以參考ICHQ6(A)。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
重大變更 |
1. 變更原料藥合成路線(中等變更(1)除外)。 2. 變更起始原料的合成路線,起始原料的質量發生變化。 3. 變更最后一步反應及之后的生產工藝(如變更結晶溶劑種類等)。 4. 變更可能影響原料藥關鍵質量屬性的工藝參數。 5. 在注冊生產工藝中增加重新加工工藝。 6. 放寬或刪除已批準的起始原料、中間體質量控制和生產過程控制,可能導致原料藥的雜質譜、關鍵理化性質發生變化的。 7. 變更原料藥生產工藝中的設備,可能導致原料藥雜質譜或關鍵理化性質發生變化。 8. 無菌原料藥生產過程變更可能影響無菌保證水平的以下情形: ①變更原料藥的滅菌/無菌工藝,例如從除菌過濾、干熱滅菌、輻射滅菌中的一種工藝變更為另一種工藝。 ②變更無菌生產工藝中使用的除菌過濾器孔徑。 9. 其他可能導致原料藥雜質譜和關鍵理化性質與變更前不一致的變更。
|
MIN |
1. 非無菌原料藥變更起始原料生產商并且與已批準生產商不屬于同一集團。新生產商起始物料質量標準保持不變。 2. 變更起始原料生產商,且生產商使用了不同的生產路線或生產條件,會對起始物料的質量標準產生影響,但不影響最終原料藥質量標準。 3. 對中間體或成品生產工藝的任何其它輕微變更,例如,引入回收步驟、在不是最終精制的合成步驟增加一種在已批準工藝其它步驟中已使用的溶劑 、工藝變更得到新的成品級別如微粉化。成品生產工藝無變更、成品質量標準保持相同。 4. 起始原料/中間體/試劑中致突變性雜質限度依據 ICH M7指南原則進行變更。 |
|
MAJ |
5. 變更起始原料生產商,且生產商使用了不同的生產路線或生產條件,會對最終原料藥的質量標準產生影響。 6. 采用可能會嚴重改變成品雜質譜的生產工藝取代現有工藝,包括引入“一鍋煮工藝”進行多個化學轉變而不將中間體分離出來),或引入新技術(例如“流體化學”或“連續生產工藝技術”)。 (筆者注:在EDQM的培訓資料里還列舉了一個屬于MAJ的變更情形需要值得關注:在倒數第二步或之前引入一個新的二類溶劑,并且該溶劑在最終原料藥中的殘留不超多其限度的10%,若超過10%,則需要按sister file單獨申報) 7. 中間體或成品滅菌步驟生產工藝變更,包括無菌產品批量變更。 8. 增加屬于關鍵參數的中控檢測和限度。 9. 放寬可能會對成品的質量造成顯著影響的生產中控檢測限度或起始原料/中間體/試劑的質量標準項目。 10. 刪除可能會對成品的質量造成顯著影響的生產中控檢測限度。 |
||
|
研究工作 |
性考察,申請時提供不少于3個月的穩定性研究資料,并與變更前產品的穩定性情況進行比較,變更后樣品的穩定性應不低于變更前。 |
研究工作 |
1. 所有已批準的和擬變更起始原料生產商清單對比(包括名稱與完整地址);用已批準的和新生產商的起始原料各生產至少兩批(最小為中試批量)原料藥成品的批分析數據(采用對比表格)。 2. 所有已批準的和擬變更起始原料生產商清單對比(包括名稱與完整地址);用已批準的和新生產商的起始原料各生產至少兩批(最小為中試批量)原料藥成品的批分析數據(采用對比表格)。 (筆者注:資料沒有要求提交新的合成路線,筆者認為這個是需要提交的。) 3. 根據已批準的和擬變更的工藝各生產的至少 2 批(最小為中試批量)成品的批分析數據(采用對比表格);已批準和擬變更的工藝的直接對比。 4. 已批準的和擬變更的中控檢測或起始物料/中間體/試劑限度的對比表格;相關時,新的非藥典分析方法的詳細描述和驗證數據;CEP持有人提供論證或風險評估以證明可根據ICH M7 原則和限度刪除或放寬參數;2 個生產批次成品的完整批分析數據。 5. 不做具體要求,申請人需要對該變更對最終原料藥潛在的質量影響進行充分討論。適用時,提交在“上市許可變更申報中穩定性試驗指南”現行版本中適用的支持性穩定性數據。(EMA/CHMP/CVMP/QWP/441071/2011) 6. 同5 7. 同5 8. 已批準的和新的中控檢測項目/限度的對比表格;相關時,新的非藥典分析方法的詳細描述和驗證數據。 9. 不做具體要求,申請人需要對該變更對最終原料藥潛在的質量影響進行充分討論。 10. 同9 |
|
筆者說明 |
1. 關于重大變更的界定,不是根據企業說自己進行了充分評估,并檢測了連續三批原料藥后發現變更對最終原料藥質量沒有負面影響,所以不屬于重大變更。要注意所有指南里都是寫的根據該變更對產品質量影響的可能性來界定變更分類,如果可能性是重大的,則歸于重大變更。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
微小變更 |
原料藥的生產批量變更在原批準批量的10倍以內(包括10倍)。 |
AN |
1. 非無菌原料藥成品或中間體批量最多增加至原批準批量的10倍。并且原批準批量必須是通過非通知類型的變更批準的。 2. 非無菌原料藥成品或中間體批量減少至不低于1/10 。 以上兩個變更均需保證生產方法變更僅因為批量增加/降低而產生,變更對工藝重復性無負面影響,變更原因不是生產過程中意外事件,或穩定性原因, 成品/中間體質量標準保持相同。 |
|
研究資料 |
|
研究資料 |
1. 擬變更批量的已檢測批次的批號;批準的和擬變更的批量;按擬變更批量進行生產的工藝描述。 |
|
筆者說明 |
關于批量的變更,CDE和EDQM的核心思路是一樣的。CDE在對變更指導原則進行培訓時也強調,如果企業想擴大批量至原來的20倍,不可以通過先通過微小變更(年報)變為4倍,然后繼續通過年報在4倍基礎上擴大5倍。每次批量的變更需要跟CDE第一次批準的批量進行比較。并且要關注因為批量變更觸發的關聯變更,如設備、工藝參數等,進行關聯變更申報。 |
||
生產批量
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
中等變更 |
原料藥的生產批量變更在原批準批量的10倍以上。 |
MIN |
批量增加超過原批準批量的10倍。 |
|
研究資料 |
|
研究資料 |
批準的和擬變更的批量;按擬變更批量進行更新的完整工藝描述;至少各一批變更前批量和變更后批量的批分析數據(以表格對比的格式) |
|
筆者說明 |
對于批量10倍以上的變更,往往伴隨著設備,工藝參數的變更,也可能會影響原料藥雜質譜和物理特性,需要重點關注。 |
||
原料藥質量標準
對于藥典(中國藥典或歐洲藥典)升級觸發的質量標準變更,均不在這兩個指導原則范圍內。
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
微小變更 |
無 |
AN |
刪除成品的不重要質量標準項目(例如刪除過時的參數)。 變更不是因為生產過程中的意外事件引起,例如,新的未知雜質、總雜質限度變化。 |
|
研究資料 |
無 |
研究資料 |
|
|
筆者說明 |
從EDQM的資料要求可見,即使刪除某些質量標準項目,也要充分做好評估并提交評估資料,例如刪除臭味檢測。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
中等變更 |
1. 新增檢驗項目 新增檢驗項目應可以更有效地控制產品質量,新增檢測項目的方法學驗證和擬定的控制限度,均應符合相關指導原則的要求。該變更不包括因安全性或質量可控性原因導致的增加檢驗項目。另外,因生產工藝改變導致藥學方面特性發生變化,而在標準中增加檢驗項目也不屬于此類變更范疇。例如,原料藥改用微粉化處理后,在標準中增加粒度分布檢查。 2. 在原標準規定范圍內收緊限度 這類變更是指在原標準規定范圍內收緊控制限度。例如,原料藥或制劑經過多批次生產驗證,水分、有關物質等指標可以達到更優的控制水平,進而收緊控制限度。由于藥品的生產工藝、處方等方面的重大變更而引起限度范圍縮小不屬于此類變更范疇。例如,原料藥生產工藝中增加微粉化處理而引起粒度變小的變更。 3. 注冊標準中文字描述的變更 此類變更不應涉及檢驗方法、限度等的變更。 |
IN |
1. 增加成品質量標準項目 變更不是因為生產過程中的意外事件引起,例如,新的未知雜質、總雜質限度變化。所有變更與誘變性雜質或元素雜質無關。所有新雜質的控制應與歐洲藥典一致。擬增加的質量標準項目與關鍵參數無關。 2. 收緊成品質量標準限度 變更不是因為生產過程中的意外事件引起,例如,新的未知雜質、總雜質限度變化。檢測方法保持相同,或對檢測方法的變更輕微。 3. 對成品檢驗方法的微小變更。對 CEP 附錄中檢測方法的編輯性變更 根據相關指南進行了適當的驗證研究,研究表明更新后的檢測方法至少與之前的檢測方法對等。總雜質限度無變更,未檢出新的未界定雜質。分析方法保持相同(例如,對色譜柱長度或溫度變更,但沒有改變柱子型號或方法)。 |
|
研究資料 |
若涉及限度修訂,需對一定批次樣品(建議含近效期樣品)批分析結果進行匯總,為限度修訂提供依據,另外,需考察在原定的有效期內,藥品是否符合修訂后質量標準的要求。如涉及增加檢驗項目,需對檢驗方法進行方法學研究(包括方法的選擇 、驗證)提供限度擬定據。需對一定批次樣品(建議含近效期樣品)批分析結果進行匯總,以考察在原定的有效期內 ,藥品是否符合修訂后質量標準的要求。
|
研究資料 |
1. 已批準的和擬變更的質量標準對比表;所有新檢測方法和驗證數據的詳細資料,如相關;兩批成品的全檢批分析數據。 2. 已批準的和擬變更的質量標準對比表。 3. 分析方法描述和修訂后的質量標準;驗證結果的對比,或對分析結果進行對比,論證所批準的方法與擬變更的方法至少等效;按 CEP 附錄的格式更新的方法描述。 |
|
筆者說明 |
可以看出在界定質量標準變更的中等變更/IN時,CDE和EDQM都給了很多前提條件,需要申請人按照要求進行判定。另外,在CDE關于該變更指導原則的培訓中,對于“新增檢測項目”,CDE強調增加的項目只是起到“錦上添花”的作用時,才可以歸屬于中等變更。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
重大變更 |
1. 變更檢驗方法 2. 放寬控制限度 3. 刪除注冊標準中的任何項目 |
MIN |
1. 放寬已批準的成品質量標準限度,以與歐洲藥典各論 /ICH/VICH 指南一致。 2. 根據ICH M7 指南的原則和限度改變成品質量標準中誘變性雜質限度。 3. 在原料藥合成路線保持不變的情況下,引入或修改元素雜質(非編輯性修改)風險管理綜述(RMS)。 4. 增加一個質量標準項目以使CEP證書包括新的級別(例如,微粉物料)。成品合成路線/生產工藝、檢測程序和質量標準 (粒度除外)與已批準相同。 |
|
MAJ |
5. 刪除成品質量標準中可能對成品質量有重大影響的項目。 6. 放寬已批準的成品質量標準限度。 |
||
|
研究資料 |
如涉及檢驗方法改變,需對新方法進行方法學研究驗證并應與變更前方法進行比較,確保方法變更不引起藥品質量控制水平的降低。另外,需對一定批次樣品(建議含近效期樣品) 批分析結果進行匯總,以考察在原定的有效期內,藥品是否符合修訂后質量標準的要求。 如涉及刪除標準中任何內容,需結合藥品生產過程控制、藥品研發過程及藥品性質等綜合分析和證明該項變更不會引起藥品質量控制水平的降低。如涉及放寬控制限度,需進行詳實的研究,必要時需要有關安全性和/或有效性試驗資料或文獻資料的支持。限度變更還需基于一定批次樣品的檢測數據并符合相關的技術指導原則。
|
研究資料 |
1. 已批準的和擬變更的質量標準對比表;兩批成品的全檢批分析數據。 2. 已批準的和擬變更的質量標準對比表;兩批成品的全檢批分析數據;CEP持有人提供論證或風險評估以證明可根據ICH M7原則和限度刪除或放寬參數。 3. 元素雜質風險管理討論和綜述。 4. 已批準的和擬變更的質量標準對比表;所有新檢測方法和驗證數據的詳細資料,如相關;兩批成品的全檢批分析數據;如果涉及新場所,則要在當前申報資料中提交 所有已批準場所和所有本次擬增加的生產場所清單對比(名稱和完整地址)。 5. 不做具體要求,申請人需要對該變更對最終原料藥潛在的質量影響進行充分討論。 6. 同上
|
變更包裝材料和容器
CDE指導原則涉及的包裝材料和容器主要指直接接觸藥品的包裝即內包裝而EDQM指南包括內包裝和外包裝。
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
微小變更 |
1. 變更原料藥裝量,如每袋重量。 2. 指導原則中未規定的原料藥包裝材料和容器的材質和 /或類型的變更。變更后的包裝材料和容器已在具有相同給藥途徑的已上市藥品中使用,并且具有相同或更好適用性能。 3. 本指導原則中未規定的包裝材料和容器的供應商、尺寸和/或形狀的變更。 |
AN |
1. 內包材質量標準和/或限度的變更。 變更不是因為包裝材料的生產過程中的意外事件導致,也不是國為原料藥成品存貯期間的意外導致。檢測方法保持相同,或對檢測方法有輕微變更。 2. 外包材質量標準的變更。原料藥成品的外包裝成份保持不變 |
|
研究資料 |
|
研究資料 |
1. 當前的與擬變更的內包材質量標準的對比表格。 2. 當前的與擬變更的外包材質量標準的對比表格。
|
|
筆者說明 |
在CDE關于該變更指導原則的培訓中,有提到對于原料藥僅裝量的變更,不需要提供新的穩定性研究。建議申請人可以在年報里簡單說明下不需要提供穩定性的原因。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
中等變更 |
1. 無菌和/或液體原料藥的包裝材料和容器的材質和/或類型。
|
IN |
1. 非無菌原料藥內包材成份變更(如果CEP中涉及復驗期時)。 擬變更的包裝材料在相關特性上必須至少與原批準的包裝材料等效。在根據ICH 指南的條件進行相關的穩定性試驗, 對至少兩個中試批次或工業規模批次進行了相關的穩定性試驗項目評估,在變更實施時至少已有三個月良好的穩定性數據。但如果擬變更的包裝比已有包裝阻隔能力更好,則不需要三個月穩定性數據。如果復驗期結束時,穩定性數據超出或可能超出質量標準,則這些研究必須完成,數據(連同所擬措施)必須立即提供給 EDQM 。 2. 非無菌原料藥內包材成份變更(如果CEP中未涉及復驗期時)。 擬變更的包裝材料在相關特性上必須至少與原批準的包裝材料等效。 3. 原料藥外包材成份變更 |
|
研究資料 |
|
研究資料 |
1. 當前的與擬變更的內包材質量標準的對比表格,如適用;新包裝適當的數據,包括材料符合相關藥典要求的確認,或歐盟對接觸食品的塑料材料和物質的要求;CEP 持有人出具的根據 ICH 條件開始進行穩定性試驗的申明(說明相關的批號),以及相關的在實施時對穩定性數據的最低要求,已有數據未能說明的問題。保證研究會完成,如果在批準的復驗期結束時數據超出或可能超出質量標準,會將數據立即提交有關當局( 以及提議的措施 2. 當前的與擬變更的內包材質量標準的對比表格,如適用;新包裝適當的數據,包括原料符合相關藥典要求的確認,或歐盟對接觸食品的塑料材料和物質的要求。 3. 已批準的和擬變更的外包裝的對比表格。 |
|
筆者說明 |
對于EDQM,只有申請人需要在CEP上體現復驗期時,才需要提供穩定性數據,否則不強制要求提供。 |
||
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
重大變更 |
1. 變更為全新材料、全新結構、風險度提高的新用途的包裝材料和容器。 2. 變更納入登記管理的包裝材料和容器(筆者注:主要指內包裝),變更后的包裝材料和容器尚未登記或登記狀態為 I 。 |
MIN |
1. 液體(非無菌)成品中內包裝的成分。 |
|
MAJ |
2. 無菌原料藥內包裝的成分。 |
||
|
研究資料 |
|
研究資料 |
1. 當前的與擬變更的內包材質量標準的對比表格,如適用;新包裝適當的數據,包括原料符合相關藥典要求的確認,或歐盟對接觸食品的塑料材料和物質的要求; 適當時,必須提交證據證明內容物與包材之間不會發生相互反應(例如,所提議材料中沒有成分會轉移至內容物中,產品組分不會流失至包材中),包括確認材質符合相關的藥典要求或歐盟與食品直接接觸的塑料材質和物體法律要求;如果已批準有復驗期,則應提交在ICH 條件下執行的 對至少2個中試批次或工業規模批次相關穩定性參數的穩定性研究結果 ,覆蓋至少三個月,并且要保證將完成這些研究,如結果超標或可在所批準的復驗期即將結束時可能會超標將立即向 EDQM 提交數據(連同所擬措施)。 2. 不做具體要求,申請人需要對該變更對最終原料藥潛在的質量影響進行充分討論。適用時,提交在“上市許可變更申報中穩定性試驗指南”現行版本中適用的支持性穩定性數據。(EMA/CHMP/CVMP/QWP/441071/2011) |
變更有效期和貯藏條件
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
中等變更 |
1. 延長有效期 有效期變更主要依據長期穩定性試驗結果。延長有效期不應超過長期穩定性試驗已完成的時間。 2. 縮短藥品有效期 此類變更不包括因生產或穩定性出現問題而要求縮短有效期。 |
IN |
1. 刪除或縮短已批準的復驗期 該變更原因不是生產過程的意外事件,或穩定性原因。 2. 加嚴存貯條件 該變更原因不是生產過程的意外事件,或穩定性原因。 3. 變更已批準的穩定性試驗方案
|
|
研究資料 |
|
研究資料 |
1. 刪除或縮短復驗期的理由陳述。 2. 加嚴存貯條件的理由陳述。 3. 申請的變更的理由陳述 以及更新后的穩定性方案。 |
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
重大變更 |
1. 變更藥品貯藏條件。 (筆者注:包括加嚴或放寬) 2. 由于藥品的生產工藝、處方、質量標準、直接接觸藥品的包裝材料和容器等方面的變更導致的有效期變更。 |
MIN |
1. 增加成品復驗期和/或對成品存貯條件進行變更。 2. 延長成品復驗期和/或對成品存貯條件進行變更。
|
|
研究資料 |
|
研究資料 |
1. 至少兩個中試批次或工業規模批次長期和加速穩定性試驗結果;包裝材料的適當數據,包括確認包材符合相應的藥典要求或歐盟關于與食品接觸的塑料材料和物品的法規要求。 2. 至少兩個中試批次或工業規模批次穩定性試驗數據的更新。 |
變更生產場地
對于國內注冊,場地變更本身沒有變更分類,生產場地變更需要按照《藥品生產監督管理辦法》、《藥品上市后變更管理辦法(試行)》及所在地省局出臺的生產場地變更管理實施細則等相關規定執行。生產場地變更的研究驗證工作需參考下述內容。而因場地變更觸發的其他變更,如設備變更,工藝變更,若屬于重大變更,需在省局完成生產地址變更以后(更新生產許可證),再向CDE進行補充申請。
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
無 |
生產場地變更,包括生產地址的改變或新增,或同一生產地址內的生產場地的新建、改建、擴建。 變更生產場地,由于新生產場地生產設備、生產環境(溫度和濕度)、技術人員素質等與原生產場地情況很難完全一致,會對原料藥、制劑生產和質量產生一定的影響,一般需要進行比較全面的研究工作。已在同一生產地址工作一段時間,且對生產工藝具備足夠經驗的人員通常可理解為 具有相同的人員素質 。 總體上,新舊場地處方、生產工藝、批量等應保持一致,包括原輔料、溶劑、 包裝材料和容器、 生產的質量過程控制等。如變更場地的同時,其處方、生產工藝、批量等發生變更,則需按照本指導原則相關章節要求進行關聯變更研究。
|
IN |
1. 非無菌原料藥變更中間體生產商,并且擬變更的生產商與目前已批準的生產商歸屬同一集團。 中間體的質量標準和合成路線(包括中控、所有使用原料的分析方法)均與已批準的一致。 2. 非無菌原料藥變更最終原料藥生產商(生產場所/車間)并且擬變更的生產商與當前已批準生產商歸屬同一集團。 質量標準(包括中控、所有物料的分析方法)、制備方法(包括批量)和詳細的合成路線與已批準的一致。 3. 非無菌原料藥增加或替代最終物質的 QC 檢測場所。 從當前場所向新場所的分析方法轉移已成功完成。 4. 非無菌原料藥引入新的(增加的)微粉場所。 CEP 中已批準一個微粉場所。質量標準(包括中控、所有物料的分析方法)、制備方法(包括批量)和詳細的合成路線與已批準的一致。最終物質的粒徑質量標準與相應的分析方法保持不變,并已包括在CEP 中。 |
|
研究資料 |
1、在同一生產地址內變更非無菌原料藥或無菌原料藥的非無菌生產步驟的生產場地,同時變更前后的生產設備、操作規程、環境條件(比如溫度和濕度)、質量控制過程和人員素質等方面一致。
2、同一生產地址內變更無菌原料藥無菌生產步驟的生產場地,或者原料藥的生產地址變更至另一不同生產地址。 研究驗證工作包括:
|
研究資料 |
1. 所有當前已批準的生產商和擬變更生產商對比清單(包括有名稱和完整地址);來自已經批準和擬變更 中間體生產商生產的最終原料藥批分析數據(以對比表格形式)。最終原料藥至少各2批。(最小需要中試規模) 2. 所有當前已批準的生產商和擬變更生產商對比清單(包括有名稱和完整地址);來自已經批準和擬變更生產商 生產的最終原料藥批分析數據(以對比表格形式)。最終原料藥至少各兩批。(最小需要中試規模) 3. 所有當前已批準的QC檢驗場所和擬變更的QC檢驗場所對比清單。(包括有名稱和完整地址) 4. 所有當前已批準的微粉場所和擬變更的微粉場所對比清單(包括有名稱和完整地址);來自已經批準和擬變更微粉場所生產的最終原料藥批分析數據(以對比表格形式)。最終原料藥至少各兩批。(最小需要中試規模)
|
|
變更分類 |
CDE |
變更分類 |
EDQM |
|
無 |
無 |
MIN |
1. 非無菌原料藥變更中間體生產商,并且擬變更的生產商與目前已批準的生產商不屬于同一集團。 中間體的質量標準和合成路線(包括中控、所有使用原料的分析方法)均與已批準的一致。 2. 增加或取代最終物質滅菌場所,且采用歐洲藥典所列滅菌標準方法。 質量標準(包括中控、所有物料的分析方法)、制備方法(包括批量)和詳細的合成路線與已批準的一致。所擬替代的滅菌場所需與已批準最終原料藥生產商為同一集團,并且亦從事最終原料藥的生產(包括滅菌前合成步驟)。如果不符合此條件,不能接受所提議新場所 。 |
|
MAJ |
3. 原料藥變更中間體生產商,且擬變更的中間體生產商使用了顯著不同的合成路線或生產條件,可能會改變最終原料藥的質量標準(雜質譜)(例如,改變合成方法、合成中引入了新的試劑、溶劑、物料)。 此時新的生產商將取代原來的生產商,不允許一個CEP里有兩種不一樣的中間體合成路線,即使最終原料藥的雜質譜保持一致。 |
||
|
研究資料 |
1. 所有當前已批準的生產商和擬變更生產商對比清單(包括有名稱和完整地址);來自已經批準和擬變更中間體生產商生產的最終原料藥批分析數據(以對比表格形式)。最終原料藥至少各兩批。(最小需要中試規模) 2. 所有當前已批準的滅菌場所和擬變更滅菌場所對比清(包括有名稱和完整地址);來自已經批準和擬變更滅菌場所生產的最終原料藥批分析數據(以對比表格形式)。最終原料藥至少各兩批。(最小需要中試規模) 3. 不做具體要求,申請人需要對該變更對最終原料藥潛在的質量影響進行充分討論。適用時,提交在“上市許可變更申報中穩定性試驗指南”現行版本中適用的支持性穩定性數據 (EMA/CHMP/CVMP/QWP/441071/2011)。 |
筆者注:雖然在CDE的變更研究資料里不管微小、中等還是重大變更,都提出了進行變更穩定性研究,但正如指導原則和CDE的培訓里所說的,“在充分評估的基礎上,可能不需要針對變更進行穩定性研究。”例如原料藥的裝量變化等。
以上為化學原料藥在中國和EDQM進行藥學變更的對比。通過對比可以看出,EDQM變更的情形更為具體,在判斷變更大小時,要仔細看好前提條件。并且EDQM有一個變更默認制,即所有未列在變更清單里的情形,默認歸屬為微小變更(MIN)。原料藥發生變更時,若在CDE的指導原則中沒有找到對應的歸屬,可以翻閱下EDQM的指南中是否有合適的歸屬,反之亦然。筆者根據兩個藥監機構對變更事項的劃分,遞交時間及變更的審評要求,大致認為國內的微小變更類似于EDQM的AN,中等變更類似于IN,重大變更對應于EDQM的MAJ。而落單的MIN更接近于重大變更。

來源:注冊圈


