您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-02-11 12:52
導讀:今日,CDE發布了《對我國〈以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則〉中關于多規格豁免BE藥學評價標準“處方比例相似性”相關問題的問答(試行)》,詳情見下。

為規范和指導化學藥物仿制藥的研究和開發,促進多規格豁免BE的藥學研究和評價工作,在國家藥品監督管理局的部署下,藥審中心組織制定了《對我國〈以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則〉中關于多規格豁免BE藥學評價標準“處方比例相似性”相關問題的問答(試行)》(見附件)。
根據《國家藥監局綜合司關于印發藥品技術指導原則發布程序的通知》(藥監綜藥管〔2020〕9號)要求,經國家藥品監督管理局審查同意,現予發布,自發布之日起施行。
特此通告。
附件:對我國《以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則》中關于多規格豁免BE藥學評價標準“處方比例相似性”相關問題的問答(試行)
國家藥監局藥審中心
2022年1月21日
《對我國〈以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則〉中關于多規格豁免BE藥學評價標準“處方比例相似性”相關問題的問答(試行)》
原國家食品藥品監督管理總局于 2016 年 3 月發布了《以藥動學參數為終點評價指標的化學藥物仿制藥人體生物等效性研究技術指導原則》,該指導原則提出:對于多規格口服固體制劑(如,常釋制劑:片劑和膠囊,調釋制劑:腸溶片、緩釋片劑、緩釋膠囊等),可以基于其中某一規格(通常建議為最高規格)的人體生物等效性試驗結果,采用體外藥學評價的方法豁免其他規格人體生物等效性研究。藥學評價方法包括:1)各規格制劑在不同 pH 介質中體外溶出曲線相似;2)各規格制劑的處方比例相似。其中處方比例相似是指以下兩種情況:1)不同規格之間所有活性和非活性組分組成比例相似。2)對于高活性的藥物(原料藥在制劑中所占重量比例低):①不同規格的制劑重量一致(差異不超過10%);②各規格使用相同的非活性組分;③規格的變更系通過改變活性組分的用量以及一個或多個非活性組分的用量來實現。為更好的指導企業進行仿制藥的開發,降低研發成本,提高研發效率,現對該指導原則中的“處方比例相似性”的相關問題進行解讀。
一、“不同規格”、“各規格”的具體所指?
答:“不同規格”、“各規格”是指仿制藥擬豁免規格與仿制藥 BE 規格相比。
二、“組成比例相似”如何理解?
答:對于常釋制劑:“組成比例相似”包括以下情況:①不同規格之間所有非活性和活性組分組成比例完全相同;②不同規格之間所有非活性成分和活性成份比例基本相同,即在處方等比放大或縮小的基礎上,不同規格之間非活性成分的變化幅度在《已上市化學藥品變更研究的技術指導原則(試行)》輔料用量變更中的普通口服固體制劑中等變更允許的范圍內;③不同規格之間非活性成分和活性成分的比例不相似,如申請人申請豁免,應提供可視為處方相似的充分理由, 監管機構在審評期間進行綜合評估。[8]
對于調釋制劑:“組成比例相似”包括以下情況:①不同規格之間所有非活性成分與活性成份的比例完全相同;②不同規格之間非活性成分與活性成分的比例不完全相同,如申請人申請豁免,應證明比例是合理的,且與產品的藥物釋放機制相適應。審評期間基于整體資料進行綜合評估。[8]
三、“高活性藥物”如何判斷?
“高活性藥物”是活性成分的含量在制劑中相對較低的藥物,如,活性成分的含量在片芯和膠囊內容物的占比<5%[1,3]。
四、不同規格之間非活性成分的變化幅度如何計算?
答:非活性組分是除活性成分外的其它成分[1,2],當不同規格活性成分和非活性成分非等比例變化時,先計算不同規格的非活性成分相對于單劑量處方的比例,后計算不同規格間的差值[3,4,5]。當處方中非活性變化種類多于一種時,非活性成分的變化幅度應為各非活性成分變化量的絕對值之和。
五、具體實例
(一)例 1:常釋片劑 1

例1中 20mg 規格為 BE 規格。擬申請豁免的 10mg 規格與 BE 規格的所有活性和非活性組分組成比例完全相同, 屬于常釋制劑“不同規格之間所有活性和非活性組分組成比例完全相同”,結合 BE 規格制劑符合生物等效性要求,且兩個規格仿制藥在不同 pH 介質中體外溶出曲線相似的前提條件,可以豁免 10mg 規格的 BE 試驗。
(二)例 2:常釋片劑 2

例 2 中 10mg 規格為 BE 規格。擬申請豁免 5mg 規格在BE 規格處方等比縮小的基礎上,調整了填充劑 1、填充劑 2 的用量。按問題 4 計算方式,計算 5mg 規格與 BE 規格的填充劑 1 變化幅度 80%-78%=2%,填充劑 2 變化幅度 8%- 6%=2%,填充劑總變化幅度 4%,小于《已上市化學藥品藥學變更研究技術指導原則》(試行)輔料用量變更中的Ⅱ類變更允許的范圍(±10% )內,故 5mg 規格屬于常釋制劑“不同規格之間所有非活性成分和活性成份比例基本相同”的情形。結合 BE 規格制劑符合生物等效性要求,且各規格仿制藥在不同 pH 介質中體外溶出曲線相似的前提條件,可以豁免 BE 試驗。
(三)例 3:緩釋制劑

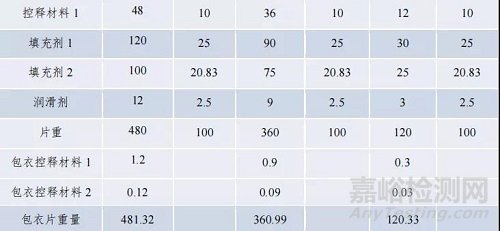
例 3 中 200mg 規格為 BE 規格。擬申請豁免 50mg、150mg 規格與 BE 規格的所有活性和非活性組分組成比例完全相同,屬于調釋制劑“不同規格之間所有活性和非活性組分組成比例完全相同”,結合 BE 規格制劑符合生物等效性要求,兩個規格制劑與 BE 制劑釋藥原理相同,且兩個規格與 BE 規格仿制藥在三種 pH 介質中體外溶出曲線相似的前提條件,可以豁免 50mg、150mg 規格的 BE 試驗。
(四)例 4:普通片劑 3(高活性藥物)

例 4 中 15mg 規格為 BE 規格。擬申請豁免的 10mg 規格與 BE 規格相比,原料藥在制劑中所占重量比例均小于5%,屬于高活性藥物。不同規格的制劑重量一致,各規格使用相同的非活性組分,規格的變更系通過改變活性組分的用量以及填充劑用量實現的。結合 BE 規格制劑符合生物等效性要求,且各規格仿制藥在不同 pH 介質中體外溶出曲線相似的前提條件,可以豁免 10mg 規格的 BE 試驗。

來源:藥通社


