您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-12-27 16:23
PART.01背景
口服固體制劑通常可分為常釋制劑(Immediate Release, IR)和調釋制劑(Modified Release, MR)。常釋(IR)制劑的設計目的是使藥物在胃腸道中自由溶解,而不是有意延緩或延長給藥后藥物的溶出和吸收。常釋制劑可能是快速溶出(rapid dissolution)和非常快速溶出(very rapid dissolution)的,也可能是緩慢溶出的。對于快速溶解的IR制劑,ICHQ6A定義為在pH1.2、4.8、6.8的介質中,15min內溶出量均不低于標示量的80%(FDA GUIDANCE中的定義略有偏差,見附錄)。調釋制劑則包含更大范圍的口服藥物制劑,如腸溶衣片、緩釋制劑、控釋制劑等。
固體制劑要發揮藥效必須先在胃腸道溶出,然后藥物分子經胃腸粘膜吸收入血,經循環系統到達靶點位置發揮作用,如圖1所示。藥物的溶出度可能會影響生物利用度,進而影響藥效。因此,溶出試驗對于口服固體制劑的開發至關重要,其貫穿藥品開發的整個過程。目前,只有少數口服固體制劑可能以崩解時限來檢測產品的體外表現更為合適,其余產品均需要進行溶出試驗。

圖1:固體口服制劑吸收步驟示意圖
PART.02溶出試驗的目的
溶出試驗是用來比較口服固體制劑體外表現的工具。進行溶出試驗的目的之一是輔助設計和篩選處方。在制劑研發的前期,當片劑或膠囊的溶出試驗始終達不到標準,可能指示著需要調整處方和工藝,或者溶出方法。影響溶出的因素很多,如粉末的組成、原輔料的物理性質(原輔料顆粒的粒徑分布、顆粒的密度、聚合物的粘度等級、輔料的來源等)、制造工藝(濕法制粒/干法制粒/直壓、制粒參數、潤滑時間、壓片壓力、包衣參數等)、溶出方法的選擇、溶出試驗時的外界環境等。
我們應通過溶出實驗理解藥物釋放機制和辨識制劑行為,除了對溶出結果進行含量分析以外,要注意實驗現象的觀察,如制劑或粉末漂浮、崩解的改變和錐形的堆積等。這些簡單的現象可能具有深遠的意義。
進行溶出試驗的另一個目的是可以進行不同批次產品之間的質量控制(Quality Control)。當獲得足夠數量的具有不同溶出曲線的不同批次產品的藥動學(PK)數據時,便有可能通過合理的溶出度試驗建立起體內體外相關性(IVIVC)。在建立好IVIVC之后,體外溶出的結果可以作為產品體內表現的替代(surrogate)。在清晰的IVIVC基礎上,溶出結果可以為某些BCSⅠ類和Ⅲ類快速溶出產品的注冊申報以及放大生產和批準后的重大變更提供生物等效性(BE)試驗豁免的依據。
這樣的溶出試驗不僅能減少監管部門的審評時間,還能減少廠商在BE試驗上消耗的時間和金錢。但是,需要注意的是IVIVC的建立是非常困難的,建立IVIVC需要系統地了解藥物分子的理化性質、生物藥劑學性質和制劑處方設計及其與胃腸道的相互作用,盡管有一些成功的案例,但是由于體內溶出和吸收的復雜性,仍然有許多的產品不能建立體內體外相關性。
在沒有建立準確的IVIVC的情況下,用溶出測試來作為質控手段需考慮以下幾點:
1、溶出數據是方法依賴性的,對于同一個產品,不同的溶出方法可能得到具有顯著差異的溶出數據。因此溶出方法的開發非常重要。
2、一般來說,通常會基于BE/BA批次設定溶出標準(specifications)。垂直比較同一產品上市后不同批次的溶出數據與之前設定的溶出標準之間的差異來進行質量控制是有意義的。通常不會去橫向比較不同產品的溶出(仿制藥生物等效性豁免biowaiver除外)。
3、溶出方法應具有合適的區分力,應能夠檢測到可能引起生物不等效的重大變化,同時應容忍常規生產的正常變化,防止不必要的產品報廢。
PART.03溶出方法的開發
固體口服制劑最常用的方法是籃法(Apparatus Ⅰ)和槳法(Apparatus Ⅱ),如圖2所示。籃法常用轉速為100rpm,槳法常用轉速為50-75rpm。對于會漂浮的固體制劑,如膠囊劑,使用籃法可能更為合適,若要使用槳法,應使用沉降裝置抑制漂浮。對于片劑,槳法(Apparatus Ⅱ)可能使用得更多。需要注意的是,對于槳法來說,溶出杯中流體動力學性質是高度異質(heterogeneous)的,藥物在杯底的位置可能改變溶出速率。如果片子偏離溶出杯中心可能導致流體動力學性質的改變,主要影響崩解過程的藥物釋放。
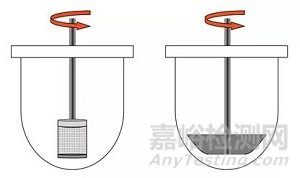
圖2:籃法和槳法裝置示意圖
在選擇合適的溶出介質之前,需要測定藥物活性成分的物理和化學穩定性。決定溶出介質的組分之前,需要充分評估緩沖液、pH的影響。如需加入表面活性劑,也需研究不同表面活性劑對藥物溶解度和穩定性的影響。
溶出介質的選擇需滿足漏槽條件,以保證溶出時有足夠大的濃度梯度,更準確地反映制劑本身的性質。在此之前,需測定藥物在不同pH介質中的飽和溶解度,溶解度是藥物最重要的理化性質之一,藥物溶解度的測定及改善,是制劑研發過程中必須做的一項工作。大家通常認為溶解度測定是一項微不足道的工作,但是要準確測定卻是非常具有挑戰性的,很多因素均會影響溶解度的測定,導致結果出現偏差。
測量平衡溶解度介質包括pH范圍為1.2-7.4的緩沖液、模擬胃液和腸液以及純化水。在測定飽和溶解度的過程中,需監測上清液在試驗過程中的pH變化,如有需要需回調pH。如有需要,還要研究不同表面活性劑(種類和濃度)對藥物溶解度的影響、評估離子效應對溶解度的影響、研究藥物在其他溫度下,如25℃時的溶解度。
溶解度測定的注意事項:
溶質是否降解;
溶質的固體形態(晶型);
檢測和矯正溶液的pH(pH-溶解度);
選擇的電解質最好不含有溶質中存在的離子,以避免同離子效應;
緩沖液與電解質本身可能與電離的藥物形成溶解度較低的鹽,試驗結束后確定剩余固體是否含有緩沖液與電解質的成分,評估鹽型是否改變。
進行溶解度實驗時,要注意觀察實驗現象,尤其是存在溶解又析出的情況時,轉晶或轉鹽的風險則較大,需特別關注。
PART.04溶出方法開發報告
為了支持所選的溶出方法,需要在注冊申報的資料中提供溶出方法開發報告,開發報告需提供以下內容:
1、生理pH范圍內,API的溶解度數據。因為溶解度數據是選擇合適的溶出介質以及決定是否需要表面活性劑的基礎。
2、設備和方法的選擇、溶出介質、介質pH、介質體積、攪拌速度、含量測定、漏槽條件、沉降裝置的選擇(如有需要)、酶的選擇(如果需要),等等。如果加入了表面活性劑,需要提供所選擇的表活種類和量的數據支持。
3、取樣時間點:一般來說,對于速釋制劑,選擇10、15、20、30、45、60、90min;對于緩釋制劑,選擇1、2、4、8、12、24h。
4、證明所選溶出方法的區分能力:可以通過有意地調整生產變量(如對關鍵物料屬性(CMAs)和關鍵工藝參數(CPPs)上下調整10-20%)來生產不同質量的產品,再去比較其溶出來證明溶出方法的區分力。下圖顯示了調整片劑硬度和粘合劑粘度對溶出度的影響。
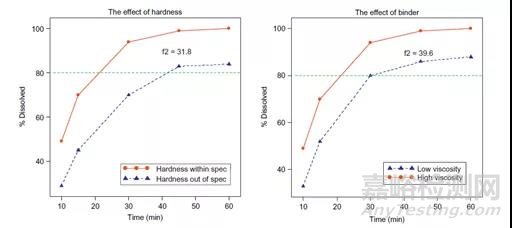
圖3:片劑硬度及粘合劑粘度對于溶出度的影響
有時也會出現溶出方法過度區分的情況,如圖4所示,雖然工藝變化后生產的樣品與參比樣品的體外溶出度存在顯著差異,但其體內生物利用度卻基本一致。
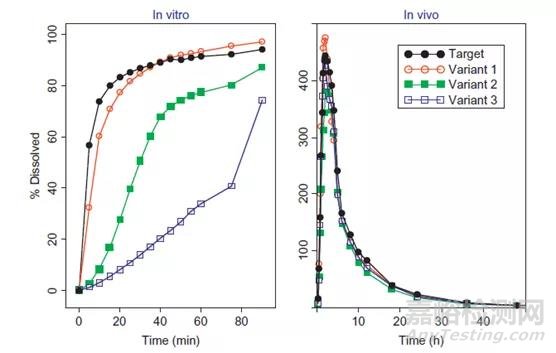
圖4:過度區分的溶出方法
當然,在實際的產品開發過程中,可能會遇到速釋制劑溶出過快,始終無法找到有區分力的溶出方法的情況。此時可根據ICH Q6A決策樹#7執行,只要溶出度并不明顯影響生物利用度,且處方和工藝的變更不影響溶出度,即可不必過多考慮溶出方法的區分力。不過此時需要收集產品在多個溶出介質中的溶出數據(如pH1.2, pH4.5, pH6.8),防止在申報過程中出現問題。
5、提供溶出方法的其他驗證數據,如系統適用性、方法耐用性、介質是否需脫氣、介質pH耐用性、儀器溫度耐用性、濾膜吸附試驗、溶液穩定性研究、重復性試驗、中間精密度研究、自動和手動取樣驗證以及含量分析方法的驗證(專屬性、線性和范圍、回收率等)。
PART.05溶出方法質控時間點和可接受標準的選擇
當設定溶出質控標準時,產品的臨床表現是首先也是最重要的考慮因素。因此,應結合關鍵臨床批的體內數據和體外溶出數據來制定溶出標準(時間點和溶出限度)。
兩個常釋(IR)制劑的例子:
案例1:如圖5所示,與另外兩批相比,臨床批的溶出度最高,臨床批與測試批次2的溶出曲線相似(f2因子=56.3),臨床批與測試批次1的溶出曲線則不相似(f2因子=44.7)。而臨床BE試驗表明,與臨床批相比,測試批次1的BE剛好符合BE接受標準。因此,在制定溶出標準時,可以考慮將批次1的溶出作為下限。需要注意的是,f2因子的參考最好建立在體內數據的基礎上,因為兩批生物不等效的產品其體外數據會有多相似,兩批生物等效的產品其體外數據又會有多不相似,我們不得而知。

圖5:三批生物利用度相同的產品的溶出曲線
案例2:如圖6所示,已知批次A屬于關鍵臨床批次,已被證實安全有效,批次B與批次A生物不等效。那么在制定溶出標準時,以80%為溶出限度,便不能選取30min作為質控點,這樣會導致兩批產品同時被接受,而選擇15min作為質控點就能拒絕批次B。

圖6:生物不等效的兩個批次產品的溶出
同時ICH Q6A指出,如果與崩解測試相比溶出不能作為產品質量控制的敏感指示標志,可能就需要將崩解作為質控標準。
綜上所述,溶解度測定和溶出方法的開發是非常細致的工作,溶解度測定為溶出方法的選擇奠定基礎,而溶出實驗貫穿產品開發的始終,實驗必須在法規的指導下進行,才能得到準確的實驗數據。
附錄:
快速溶出(rapidly dissolving):用USP裝置Ⅰ或Ⅱ的方法,在<900ml的水性介質中,30min內應有超過85%的藥物溶解;而非常快速溶出(very rapidly dissolving)則是15min內有超過85%的藥物溶解。
參考文獻:
1.《普通口服固體制劑溶出度試驗指導原則》
2. Yihong Qiu et al. Developing Solid Oral Dosage Forms_ PharmaceuticalTheory and Practice
3. Pharmaceutical Research, Vol. 19, No. 7, July 2002
4.Waiver-of-In-Vivo-Bioavailability-and-Bioequivalence-Studies-for-Immediate-Release-Solid-Oral-Dosage-Forms-Based-on-a-Biopharmaceutics-Classification-System.-Guidance-for-Industry
5. Q6A:質量標準:新原料藥和新藥制劑的檢測方法和可接受標準:化學藥物

來源:藥渡


