您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-12-16 12:37
13年參加工作,開始從事藥學質量基礎研究工作。18年因為工作晉升需要,專門去學習了項目管理,并取得了項目管理專業人士資格認證(PMP)。起初將相關理論應用在多個仿制藥和創新藥的項目管理上,主要包括協調整合部門有限資源,控制研發成本,快速推進各項目申報進度等。后來,將“凡事皆項目”擴展到了平時的基礎研究工作中,發現項目管理的核心理論“戴明環PDCA”可以有效提高工作效率,是個非常好用的工具。
基于此,本文先簡要介紹一下項目管理相關的基本理論知識,再以實例的方式介紹項目管理理論在藥物穩定性研究過程中的應用。
了解之后,可以舉一反三,應用于工作中任何一項任務。
1、基本概念
1.1、項目
項目是為創造獨特的產品、服務或成果而進行的臨時性工作。
項目具有臨時性和獨特性兩個特點。
臨時性是指由明確的起點和終點,并不意味著持續時間短,很多項目的結果或影響具有持久性。
獨特性是指項目創造獨特的可交付成果,因此也導致了不確定性和風險,這就需要比常規例行工作做更多的精心規劃。
項目有三重制約因素包括范圍、時間和成本(簡稱范時成)。
1.2 項目管理
項目管理是指在項目活動中運用專門的知識、技能、工具和方法,使項目能夠在有限資源限定條件下,實現或超過設定的需求和期望的過程。
項目管理通過合理運用和整合47個項目管理過程得以實現。
這47個項目管理過程歸類于五大過程組:

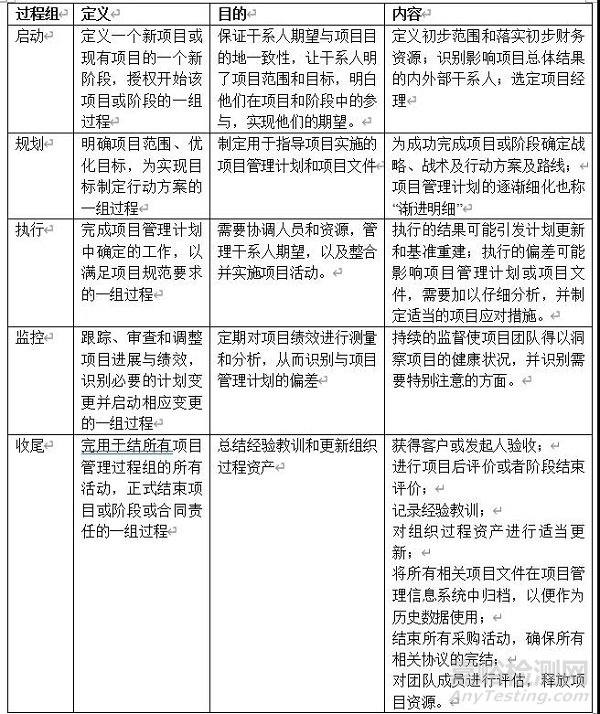
P-Plan計劃;這五個過程組的核心管理理論就是戴明環PDCA:
D-Do執行;
C-Check檢查;
A-Act處理
將上述五個過程應用于項目中的10個不同知識領域,這就是形成了項目管理的核心知識體系(見下表):
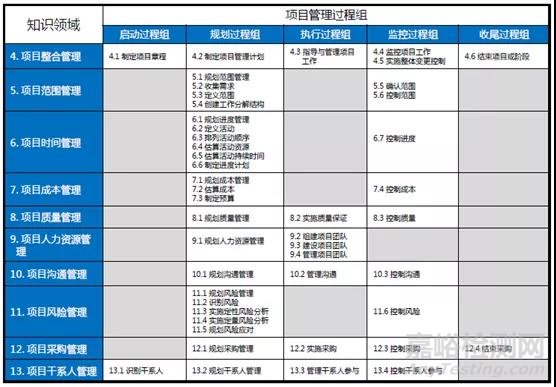
(上表是PMP認證考試必背內容)
1.3藥物穩定性研究
藥物穩定性研究是考察原料藥或制劑的性質在溫度、濕度、光線等條件的影響下隨時間變化的規律,為藥品的生產、包裝、貯存、運輸條件和有效期的確定提供科學依據,以保障臨床用藥安全有效。
《中國藥典》2020版四部通則9001原料藥物與制劑穩定性試驗指導原則,分別對原料藥物和藥物制劑的穩定性試驗提出了具體要求,包括試驗類型、樣品批次選擇、放置條件、考察時間點、考察關鍵項目指標、檢驗方法專屬性與準確性等。
2、項目管理在藥物穩定性研究的應用
2.1、穩定性試驗的啟動
原料藥物與制劑穩定性試驗的啟動時間根據項目申報階段和研究進度而定,以計劃申報臨床試驗的項目為例,原料和制劑均可以在小試驗證結束后啟動影響試驗,在中試放大之后啟動加速試驗(中間條件試驗)和長期試驗。
2.2、穩定性試驗的規劃(很重要)
(1) 規劃范圍(做什么)
規劃范圍的前提是充分了解事業環境因素,也就是要解讀相關法規和指導原則,科學合理的設計研究方案。
影響因素、加速和長期試驗。
影響因素:1批/規格;裸置;溫度(40℃/60℃)、濕度(RH75%/RH92.5%)和光照;5天、10天和30天;考察指標(比如某片劑,外觀、增失重、溶出度、有關物質和含量等);
加速試驗:3批/規格;市售包裝;根據樣品性質選擇加速考察條件(比如溫度40℃±2℃,相對濕度RH75%±5%);1、2、3和6月;考察指標(比如某膠囊,外觀、增失重、溶出度、水分、有關物質和含量等);
長期試驗:3批/規格;市售包裝;根據樣品性質選擇長期考察條件(比如溫度30℃±2℃,相對濕度RH65%±5%);3、6、9、12、18、24和36月;考察指標(比如某顆粒劑,外觀、增失重、溶出度、粒度、有關物質和含量等)。
(2) 規劃時間
規劃時間主要基于穩定性研究考察條件的設計、考察時間點的設計、關鍵考察指標的設計、考察樣品批次、實驗室檢驗人員儀器等資源情況,以及檢驗時效性要求等。
比如,影響因素考察一批原料藥;設計高溫40℃/60℃,高濕RH75%/RH92.5%和光照(5000LUX)五個條件;考察時間點設計為5天、10天和30天,每個時間點待測樣品5個;每個時間點考察外觀、增失重、熔點、晶型、有關物質、潛在致突變雜質和含量等;檢驗人員(是否熟悉項目,是否經過相關培訓);對照品或試劑資源是否具備;儀器(PH計、天平、HPLC等)狀態;各分析方法也進行了初步的驗證研究;檢驗記錄模板有效等。
(3) 規劃成本
規劃成本一般會基于穩定性試驗方案,以每個點樣品批次、考察條件、考察項目、檢驗人員和儀器試劑等資源需求,再乘以相應點數即可。
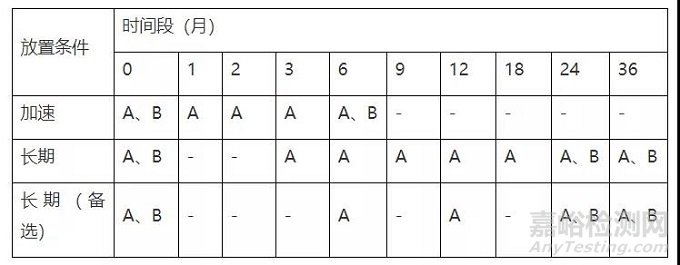
(4) 某制劑穩定性試驗方案
考察條件

穩定性試驗點時間表產品擬國內上市,我國總體屬于亞熱帶(Ⅱ),部分地區屬于濕熱帶(Ⅳ A),長期試驗采用30℃/65%RH,25℃/60%RH作為長期備選研究(或與之前穩定性研究數據的對比研究)。

注:“長期(備選)”試驗點放樣,若“長期”數據無異常可不進行檢測;
異常情況包括:長期數據檢查項超出標準或出現OOT(與之前穩定性研究批次數據)。
穩定性試驗考察項目
注:A考察項目:外觀,有關物質、潛在致突變雜質、溶出度、含量、粒度;
B考察項目:微生物限度、晶型。
本品存在規格等設計因子,因臨床使用方案的不確定性,暫不采用括號設計法或矩陣設計法進行簡化設計。
穩定性試驗全面設計測試點

注:1T為測試點;
2X為長期(備選)試驗點放樣,若“長期”數據無異常可不進行檢測,異常情況包括:長期數據檢查項超出標準或出現OOT(與之前穩定性研究批次數據)。
2.3、穩定性試驗的執行
按照穩定性試驗方案進行項目執行。
到取樣時間點,按要求取樣并在有效時間內進行檢驗,撰寫記錄,整理圖譜,繪制趨勢線等,對應執行過程中的所有登記信息,要按照實驗室SOP或法規要求進行填寫。
2.4、穩定性試驗的監控
對每個時間點的檢驗數據進行橫向分析(與預實驗比較,或與其他批次數據進行比較等),判斷數據的有效性和準確性,如為異常數據(OOT或OOS),及時進行偏差調查。對監控過程中發現的問題,及時采取補救,比如,穩定性期間發現的有關物質分析方法專屬性不能滿足試驗要求的,新的降解雜質不能被有效分離的,或發現溶出度標準介質選擇不合理,不具有區分力的,應及時優化分析方法。
另需要及時監控藥物穩定性箱的運行狀態,對溫度和濕度偏離超出可接受范圍的儀器進行及時修理,并對考察樣品評估其影響程度。
2.5、穩定性試驗的收尾
影響因素試驗一般考察5天、10天和30天,可以在全部試驗結束后,匯總所有的實驗數據、圖譜和報告,形成該穩定性試驗的總結報告。了解原料藥或制劑對光照、溫度和濕度的敏感程度,選擇合適的包裝材料。
加速(中間)試驗一般考察1月、2月、3月和6月,可以在全部試驗結束后,匯總整理各個時間點的數據、圖譜和報告,形成該穩定性試驗的階段總結報告(一般會同時整理長期條件6個月)。
長期試驗周期較長,根據原料藥或制劑的性質,會持續24個月、36個月,甚至更長時間,所以,對于長期試驗的收尾會采用階段性收尾和全部收尾兩種方式。例如,某原料藥長期試驗考察時間點設計為3、6、9、12、18、24、36和48個月,會連同加速試驗在6月階段收尾一次,其后會在12、24、36月階段收尾各1次,待48月時間點結束,進行該項目的全部收尾工作。
對于某項目某個申報階段下的穩定性試驗正式收尾,一般會將該項目的所有穩定性試驗相關的數據、圖譜和報告全部整理匯總,分析后評價該原料藥或制劑在溫度、濕度和光線等條件的影響下隨時間變化的規律,為藥品的生產、包裝、貯存、運輸條件和有效期(復驗期)的確定提供科學依據,以保障臨床用藥安全有效。
當然,藥物研發過程中,特別是創新藥研究,具有漸進性、階段性和不確定性特點,在穩定性考察期間可能會涉及到考察方案的變更,甚至終止,總之,在標識項目收尾的時間節點后,總結必要的經驗教訓,形成必要的組織過程資產(如模板類文件等),不能成為“爛尾房”。
以上,項目管理五個過程組在藥物穩定性研究中的應用,強調重視規劃過程和收尾階段。

來源:藥事縱橫


