您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-09-25 22:47
一、血糖儀的結構與工作原理
1.血糖儀的結構
血糖儀按其工作原理分為電化學式和光化學式兩類產品,一般由檢測模塊、信號放大模塊、AD采集模塊、數據處理模塊、顯示模塊、嵌入式軟件、信號輸出部分(如適用)、電源電路以及按鍵控制電路等組成。
2.血糖儀的工作原理
血糖儀主要分為電化學法和光化學法兩大類。
電化學法采用檢測酶反應過程中產生的電流信號的原理來反應血糖值,酶與葡萄糖反應產生的電子通過電流記數設施,讀取電子的數量,再轉化成葡萄糖濃度讀數。根據電化學法血糖測試條中所采用的酶不同又分為葡萄糖氧化酶(GOD)法和葡萄糖脫氫酶(GDH)法兩種類型。葡萄糖脫氫酶(GDH)在反應中還需聯用不同輔酶,分別為吡咯喹啉醌葡萄糖脫氫酶(PQQ-GDH)、黃素腺嘌呤二核苷酸葡萄糖脫氫酶(FAD-GDH)及煙酰胺腺嘌呤二核苷酸葡萄糖脫氫酶(NAD-GDH)三種。
葡萄糖氧化酶(GOD)法血糖測試反應原理示例如圖1所示,葡萄糖脫氫酶(GDH)法血糖測試反應原理示例如圖2所示。
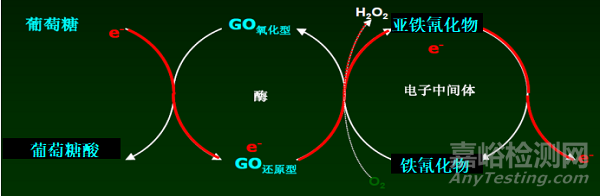
圖1 葡萄糖氧化酶(GOD)血糖測試反應原理圖
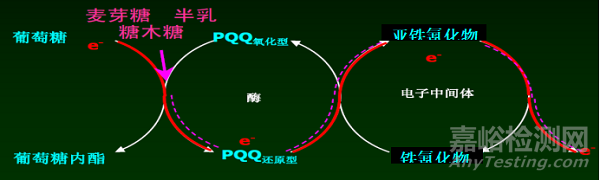
圖2 葡萄糖脫氫酶(GDH)血糖測試反應原理圖
光化學法是檢測反應過程中試條的顏色變化來反應血糖值,血糖測試條中所采用的酶一般為葡萄糖氧化酶(GOD),通過酶與葡萄糖的反應產生的中間物(帶顏色物質),反應后試紙顏色發生改變,運用檢測器檢測試紙反射面的吸光度,根據朗伯-比爾定律即可求出血糖濃度,測試示意圖(見圖3)。

圖3 光化學法血糖儀的測試原理圖
二、血糖儀的研發實驗要求
1.產品性能研究
1.1 在開展產品性能研究時,應對產品技術要求中所涉及的功能性、安全性及質量控制指標研究。研究資料應從產品設計角度出發詳細說明指標確定的依據,如:注冊申請人設定血糖儀測試時間5s,則應給出酶反應時間和準確度之間的研究及驗證資料。
1.2 可用于檢測靜脈、動脈和新生兒血樣的產品至少應參照GB/T 19634—2005《體外診斷檢驗系統自測用血糖監測系統通用技術條件》中的要求,按照不同血樣驗證產品的準確度和重復性。可對動脈和新生兒血樣進行測試的產品還應出具參考值及紅細胞壓積規定范圍的確定依據和驗證資料。葡萄糖氧化酶法血糖測試產品至少還應對產品適用的海拔高度進行研究,并出具理論依據及相關驗證資料,附錄B中給出了海拔高度和空氣中氧含量的關系;葡萄糖脫氫酶法血糖測試產品至少還應對其他糖類干擾(詳見附錄A)進行要求,并出具產品特異性驗證資料。
對于紅細胞壓積和干擾物質的影響,ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中從紅細胞壓積和干擾物限制方面做出了相應規定,見表1 “ ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中紅細胞壓積及干擾物質限值”。建議注冊申請人在設計研發時參照ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》的相關要求,開展研究及驗證工作。鑒于不同人群紅細胞壓積值不一致的問題(通常男性紅細胞壓積正常范圍高于女性正常范圍,新生兒紅細胞壓積范圍高于普通人正常范圍),本指導原則中規定:用于新生兒血糖測試的產品,注冊申請人應對紅細胞壓積開展研究;同時鼓勵注冊申請人對成人用產品開展研究,但不做強制要求;用于血漿/血清檢測的產品應給出對血清/血漿(包含紅細胞壓積0%的樣本)檢測準確性和重復性的研究資料。
表1 ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中紅細胞壓積及干擾物質限值
|
指標 |
葡萄糖濃度 |
應符合要求 |
|
紅細胞壓積 |
<5.55mmol/L |
每個紅細胞壓積水平與中等紅細胞壓積水平平均測得值差值不超過0.55mmol/L。 |
|
≥5.55mmol/L |
每個紅細胞壓積水平與中等紅細胞壓積水平平均測得值差值不超過10%。 |
|
|
干擾物質 |
<5.55mmol/L |
測試樣品與對照樣品的平均差值不超過0.55mmol/L。 |
|
≥5.55mmol/L |
測試樣品與對照樣品的平均差值不超過10%。 |
1.3 共識誤差網絡(Consensus Error Grid)
共識誤差網絡(CEG)以網格圖的形式直觀的反映出血糖監測系統中誤差造成檢驗結果偏差。ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》標準中對CEG做出了詳細描述,并對數據結果提出了相應的限定(詳見圖4和表2)。ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中基于調查參與者共識,將CEG分為A-E等5個區域,其中A和B區的葡萄糖結果無效應或對臨床結局略有效應,C-E區的結果會導致風險增加。標準要求1型糖尿病99%的結果應位于A和B區,從而降低準確度誤差95%以外的值,對測試結果的影響。建議注冊申請人參照ISO15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中的相關規定,進行研究。
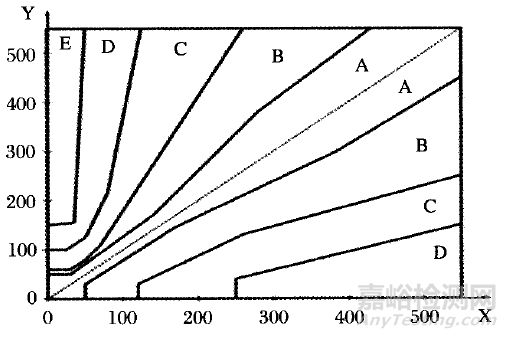
X:血糖監測參考方法或者可溯源至參考方法的方法
Y:待評價血糖監測系統方法
圖4 共識誤差網絡網格圖
表2 誤差網格區定義
|
風險水平(CEG區) |
糖尿病患者的風險 |
|
A |
對臨床操作無效應。 |
|
B |
臨床操作改變-對臨床結局略有效應或無效應。 |
|
C |
臨床操作改變-可能影響臨床結局。 |
|
D |
臨床操作改變-可能有明顯的臨床風險。 |
|
E |
臨床操作改變-可能有危險效果。 |
1.4 安全性指標的驗證包括電氣安全指標和電磁兼容指標兩大類。電氣安全指標應當包括GB 4793.1—2007《測量、控制和實驗室用電氣設備的安全要求 第1部分:通用要求》及其他適用的國家標準和行業標準中的所有指標,電磁兼容指標應當包括GB/T 18268.1—2010《測量、控制和實驗室用的電氣設備 電磁兼容性要求 第一部分:通用要求》及其他適用的國家標準和行業標準中的所有指標。
具備能力的注冊申請人可對上述項目自行研究,并給出詳細的驗證資料,不具備能力的注冊申請人可通過注冊檢驗對上述項目進行驗證,以注冊檢驗報告作為該部分的驗證資料。
1.5 研究資料中應詳細寫明通過研究驗證確定的血糖儀產品的結構組成及主要元器件信息。
2.軟件研究
參見《醫療器械軟件注冊申報資料指導原則》的相關要求。
血糖儀產品的軟件屬于產品中的一個組成部分,屬于嵌入軟件,具備顯示、數據處理等功能,本指導原則中所述軟件不包含安裝在計算機、移動電子設備中的上位機軟件(如:APP軟件等)。在出具軟件研究資料時應包含基本信息、實現過程和基本算法三個部分。
2.1 基本信息中至少應包含如下內容:
產品標識:應給出血糖儀軟件的內部標識。
安全性級別:血糖儀軟件按其損害嚴重程度分級,一般屬于對健康可能有不嚴重的傷害的等級(B級)
結構功能:注冊申請人應依據軟件設計規格(SDS)給出體系結構圖,圖示血糖儀軟件組成模塊之間、組成模塊與外部接口之間的關系。依據體系結構圖描述組成模塊的功能、模塊關系、模塊與外部接口關系以及用戶界面。注:本指導原則中對于外部接口的考慮僅指用于輸出血糖儀中數據的接口。
硬件關系:依據軟件設計規格(SDS)給出物理拓撲圖,圖示血糖儀軟件、通用計算機(含移動設備)、硬件相互之間的物理連接關系。依據物理拓撲圖描述血糖儀的軟件(或組成模塊)與通用計算機(含移動設備)、硬件的物理連接關系。注:本指導原則中僅考慮了將血糖儀中的數據輸出到通用計算機(含移動設備)的傳輸問題,未考慮數據傳輸到通用計算機(含移動設備)后的顯示、儲存、分析等問題。
2.2 實現過程至少應包含如下內容:
開發綜述:注冊申請人應描述軟件開發過程所用的語言、工具、方法,其中工具應描述支持軟件(含開源軟件)和應用軟件(第三方軟件)的名稱、版本號和制造商。同時應說明開發人員數量、開發時間、工作量(人月數)、代碼行總數和控制文檔總數。
風險管理:血糖儀產品的嵌入式軟件屬于軟件組件的一種,注冊申請人可將其風險分析資料并入整機風險管理報告中。
需求規格:血糖儀中軟件的需求規格可與血糖儀的需求規格合并,需求規格中至少應包含硬件、功能、性能、輸入輸出、接口界面、警示信息、文檔和法規的要求等內容。
驗證與確認:應給出系統測試、用戶測試的測試計劃和報告摘要,描述測試的條件、工具、方法、通過準則和結果、概要介紹開發各階段的驗證活動,描述相應的工具、方法、內容和結果,其中單元測試應描述覆蓋率要求,集成測試應描述集成策略。
缺陷管理:注冊申請人應描述軟件的缺陷管理的工具、流程和要求,列明開發階段所發現的缺陷總數和剩余缺陷數,剩余缺陷的嚴重度、處理措施和處理時間。
修訂歷史:注冊申請人應描述軟件版本號的命名規則。
2.3 核心算法
血糖儀產品的核心算法一般采用人工智能算法。根據血糖儀軟件的安全性級別和類型,應描述核心算法的原理和用途,給出換算公式,電化學法應說明微電流與葡萄糖氧化酶或葡萄糖脫氫酶及各種原材料選擇之間的關系,光化學法應說明光電信號與葡萄糖氧化酶及各種原材料選擇之間的關系,并出具安全性與有效性的驗證資料(驗證資料可與血糖儀成品驗證合并),出于保密原則的考慮注冊申請人可僅對原理進行說明,無需給出具體設計參數及配比。
3.產品使用期限和包裝研究
產品使用期限研究:注冊申請人應根據自身產品臨床應用和產品設計情況,確定出產品的關鍵部件和可更換部件。注冊申請人應明確在預期使用條件下關鍵部件的使用期限,及可更換部件的定期保養維護時間和更換頻次,且應給出確定使用壽命和更換頻次的理論依據。若關鍵部件也可更換時,也應說明其定期保養維護時間和更換頻次。電化學法血糖儀產品的關鍵部件至少包括主芯片和內部存儲器(如適用);光化學法血糖儀的關鍵部件至少應包括光學讀頭、主芯片和內部存儲器(如適用)。
包裝研究:注冊申請人應明確產品包裝材料;給出在宣稱的運輸條件下,符合GB/T 14710—2009《醫用電器環境要求及試驗方法》中運輸試驗要求的驗證資料;并給出在宣稱貯存條件下,保持包裝完整性的依據。
4.主要性能指標
4.1.性能指標
4.1.1 外觀
血糖儀外觀應整潔,文字和標示清晰;
4.1.2 血糖儀和配套血糖試條系統測量重復性
血糖儀和配套血糖試條系統重復測量結果的精密度應符合表3的要求。
表3 血糖儀和血糖試條測量重復性
|
測試范圍 |
精密度 |
|
<5.5mmol/L (<100mg/dL) |
SD<0.42 mmol/L (<7.7mg/dL) |
|
≥5.5mmol/L (≥100mg/dL) |
CV<7.5% |
4.1.3 血糖儀和配套血糖試條系統的準確度
血糖儀和配套血糖試條的系統準確度應符合下列要求之一:
(1) 血糖儀和配套血糖試條測量結果偏差的95%應符合表5的要求;
(2) 血糖儀和配套血糖試條對葡萄糖的回收率為80%~120%。
表4 準確度要求
|
測試范圍 |
允許偏差 |
|
≤4.2mmol/L (≤75mg/dL) |
不超過±0.83mmol/L (±15mg/dL) |
|
>4.2mmol/L (>75mg/dL) |
不超過±20% |
(3) ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中對血糖儀準確度要求進行了調整,鼓勵注冊申請人參照執行,但不做強制性要求(詳見表5)。若能夠出具符合ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中準確度要求的第三方檢測報告(CNAS認證)則可在說明書中明確準確度符合ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中的規定。
表5 ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中的準確度要求
|
測試范圍 |
允許偏差 |
|
≤5.55mmol/L (≤100mg/dL) |
不超過±0.83mmol/L (±15mg/dL) |
|
>5.55mmol/L (>100mg/dL) |
不超過±15% |
(4) 數據傳輸可靠性要求(如適用)
(5) 血糖儀測量時間
(6) 血糖儀的校正和顯示功能
2.血糖儀安全要求
血糖儀的安全要求建議參照ISO 15197:2013《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》中的規定,執行GB 4793.1—2007《測量、控制和實驗室用電氣設備的安全要求 第1部分:通用要求》、GB 4793.9—2013《測量、控制和實驗室用電氣設備的安全要求 第9部分:實驗室用分析和其他目的自動和半自動設備的特殊要求》和YY 0648—2008《測量、控制和實驗室用電氣設備的安全要求 第2-101部分:體外診斷(IVD)醫用設備的專用要求》中的相關要求。
3.電磁兼容性
設備應滿足GB/T 18268.1—2010《測量、控制和實驗室用的電氣設備 電磁兼容性要求 第一部分:通用要求》和GB/T 18268.26—2010《測量、控制和實驗室用的電設備 電磁兼容性要求 第26部分:特殊要求 體外診斷(IVD)醫療設備》中規定的要求。
4.血糖儀環境試驗
應符合GB/T 14710—2009《醫用電器環境要求及試驗方法》中適用條款的要求。
注:在進行重復性和準確性試驗時,應根據血糖儀實際使用情況,選擇血樣(毛細血管全血、靜脈全血、動脈全血等)。采用靜脈和毛細血管血樣時,應按照GB/T 19634—2005《體外診斷檢驗系統自測用血糖監測系統通用技術條件》中的要求制備血樣;采用動脈血樣時,注冊申請人應參考GB/T 19634—2005《體外診斷檢驗系統自測用血糖監測系統通用技術條件》中的試驗方法,制定測試血樣制備方法(制備方法的確定依據應在研究資料中予以說明)。
三、相關標準
表6 相關產品標準
|
GB/T 191—2008 |
《包裝儲運圖示標志》 |
|
GB 4793.1—2007 |
《測量、控制和實驗室用電氣設備的安全要求 第1部分:通用要求》 |
|
GB 4793.9—2013 |
《測量、控制和實驗室用電氣設備的安全要求 第9部分:實驗室用分析和其他目的自動和半自動設備的特殊要求》 |
|
GB/T 14710—2009 |
《醫用電器環境要求及試驗方法》 |
|
GB/T 19634—2005 |
《體外診斷檢驗系統自測用血糖監測系統通用技術條件》 |
|
GB/T 8268.1—2010 |
《測量、控制和實驗室用的電氣設備 電磁兼容性要求 第一部分:通用要求》 |
|
GB/T 18268.26—2010 |
《測量、控制和實驗室用的電設備 電磁兼容性要求 第26部分:特殊要求 體外診斷(IVD)醫療設備》 |
|
YY/T 0316—2008 |
《醫療器械 風險管理對醫療器械的應用》 |
|
YY/T 0466.1—2009 |
《醫療器械 用于醫療器械標簽、標記和提供信息的符號 第1部分:通用要求》 |
|
YY 0648—2008 |
《測量、控制和實驗室用電氣設備的安全要求 第2-101部分:體外診斷(IVD)醫用設備的專用要求》 |
|
ISO 15197:2013 |
《體外診斷檢測系統-用于糖尿病管理的自測用血糖監測系統通用技術要求》 |
四、主要風險
血糖儀產品的風險管理報告應符合YY/T 0316—2008《醫療器械 風險管理對醫療器械的應用》的有關要求。
表7 初始事件和環境示例
|
|
通用類別 |
初始事件和環境示例 |
|
|
不完整的要求 |
性能不符合要求; 測量重復性、系統準確性等不符合要求; 說明書未對設備及附件維護保養的方式、方法、頻次進行說明; 未對校準間期進行說明。 |
|
|
制造過程 |
控制程序(包括軟件)修改未經驗證,導致產品的測量誤差不符合要求; 生產過程關鍵工序控制點未進行監測,導致各部件配合不符合要求等; 外購、外協件供方選擇不當,外購、外協件未進行有效進貨檢驗,導致不合格外購、外協件投入生產等。 |
|
|
運輸和貯藏 |
產品防護不當導致設備運輸過程中損壞等; 在超出設備規定的貯藏環境(溫度、濕度、壓力)貯藏設備,導致設備不能正常工作等。 |
|
|
環境因素 |
溫度、濕度、海拔如超出給定范圍后可能造成測量結果不準確; 過熱、過冷的環境可能導致設備不能正常工作等; 強酸強堿導致損害等; 抗電磁干擾能力差,特定環境設備工作不正常等; 設備的供電電壓不穩定,導致設備不能正常工作或損壞等。 |
|
|
清潔、消毒和滅菌 |
使用說明書中推薦的清洗、消毒方法未經確認; 使用者未按要求進行防護、清洗、消毒(如:使用錯誤的消毒劑)。 |
|
|
處置和廢棄 |
未在使用說明書中對血糖儀或其他部件的處置(特別是使用后的處置)和廢棄方法進行說明,或信息不充分;未對設備廢棄的處置進行提示性說明等。 |
|
|
人為因素 |
設計缺陷引發的使用錯誤; 易混淆的或缺少使用說明書: —圖示符號說明不規范 —操作使用方法不清楚 —技術說明不清楚 —重要的警告性說明或注意事項不明確 —不適當的操作說明等 不正確的測量和計量。 |
|
失效模式 |
由于老化、磨損和重復使用而導致功能退化/疲勞失效(特別是醫院等公共場所中使用時)。 |
|
表8 危害、可預見的事件序列、危害處境和可發生的損害之間的關系
|
危害 |
可預見的事件序列 |
危害處境 |
損害 |
|
電磁能量 |
在強電磁輻射源邊使用血糖儀測量。 |
電磁干擾程序運行。 |
測量錯誤、測量結果誤差過大。 |
|
靜電放電。 |
干擾程序運行。 |
導致測量結果誤差過大、或數據擦除。 |
|
|
機械能 |
產品意外墜落。 |
機械部件松動,液晶板接觸不良。 |
無法測量或測量誤差過大,數據無法讀取,嚴重時延誤治療。 |
|
化學 |
長時間不使用的電池未經取出,造成電池漏液。 |
電路腐蝕。 |
設備故障,無法工作。 |
|
操作錯誤 |
血糖儀的測試條插入口有異物。 |
獲得不準確的結果。 |
根據測量結果采用不準確的治療方法。 |
|
使用者的操作有誤(使用者插入已使用過的血糖試紙條、在滴血標記出現以前進行測試、測試環境溫度過低或過高、血樣不足、電池電量不足)。 |
得不到結果或者獲得不準確的結果。 |
根據測量結果采用不準確的治療方法。 |
|
|
不完整的說明書 |
未對錯誤操作進行說明。 |
錯誤操作、不正確的測量。 |
測量值誤差過大,測量失敗,嚴重時延誤治療。 |
|
不正確的消毒方法。 |
使用有腐蝕性的清潔劑、消毒劑。 |
產品部件腐蝕、防護性能降低。 |
|
|
不正確的產品貯存條件。 |
器件老化、部件壽命降低。 |
產品壽命降低、導致測量值誤差過大。 |
|
|
未規定校驗周期。 |
未對設備進行校準。 |
測量值誤差過大,測量失敗,嚴重時延誤治療。 |

來源:嘉峪檢測網


