您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-05-31 13:30
纖維內窺鏡是供人體內腔檢查和手術時用的醫用光學器械。它利用人體自然腔道或切口導入人體,對預期區域或部位進行照明并于體外成像以供觀察和診查,結合手術器械可進行組織取樣(活檢等)。
第二類診斷用軟性纖維內窺鏡產品,即纖維上消化道鏡、纖維結腸鏡、纖維大腸鏡、纖維支氣管鏡、纖維鼻咽喉鏡、纖維膽道鏡、纖維膀胱鏡。其他第二類纖維內窺鏡研發實驗要求、相關標準與主要風險也可參考本文的內容。
診斷用軟性纖維內窺鏡產品的結構和組成
(1)不含導光束的纖維內窺鏡
不含導光束的纖維內窺鏡由頭端部、插入部、操作部、目鏡部或接物鏡、吸引閥(僅帶工作通道內窺鏡適用)等組成。
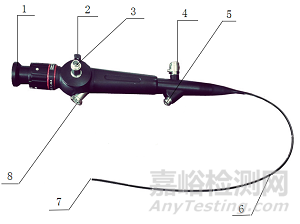
圖1不含導光束的纖維內窺鏡
1.目鏡部或接物鏡2.轉動鈕3.導光接頭4.測漏閥
5.插鉗口(無工作通道內鏡不含插鉗口) 6.插入部7. 頭端部8. 吸引閥
(2)含有導光束的纖維內窺鏡
含有導光束的纖維內窺鏡有頭端部、插入部、操作部、目鏡部或接物鏡、導光插頭、吸引閥(僅帶工作通道內窺鏡適用)等組成。

圖2含有導光束的纖維內窺鏡
1.目鏡部或接物鏡2.轉動鈕3.導光接頭4.測漏閥
5.插鉗口(無工作通道的內窺鏡不含插鉗口)6.插入部7.頭端部
8.吸引閥9.操作部 10.導光束
診斷用軟性纖維內窺鏡的研究要求
1.性能研究
開發者應當對產品性能進行研究,確認產品技術的要求,包括功能性、安全性指標。并對質量控制相關的其他指標進行確認,對所采用的標準或方法、采用的原因及理論基礎進行驗證。
2.生物相容性評價研究
開發者應對產品中與患者和使用者直接或間接接觸的材料的生物相容性進行測試評估。具體參照《關于印發醫療器械生物學評價和審查指南的通知》(國食藥監械〔2007〕345號)。
3.生物安全性研究
由于內窺鏡產品不含有同種異體材料、動物源性材料或生物活性物質,本條不適用。
4.滅菌/消毒工藝研究
開發者應當對產品的消毒或滅菌工藝進行研究以確定符合標準的方法。如選用的滅菌方法容易出現殘留,應當對殘留物信息及采取的處理方法進行研究確認。
5.產品有效期和包裝研究
開發者應對產品的有效期或使用次數進行研究。保證產品符合GB/T 14710-2009 《醫用電氣設備環境要求及試驗方法》標準要求。
6.臨床前動物試驗:不適用。
7.軟件研究:內窺鏡為不含有軟件的產品,本條不適用。
8.開發者可開展其他能夠證明產品安全性、有效性的研究。
軟性纖維內窺鏡主要性能指標
本文給出需要考慮的產品基本技術性能指標,但并未給出定量要求,可參考相應的國家標準、行業標準,根據自身產品的技術特點制定相應的要求。涉及材料內容的應說明選用材料滿足的國家標準或行業標準。以下是通常的性能指標:
1.安全性能
(1)外觀(濁度、色澤):無色透明,憑目視看不出異物。
(2)酸堿度(pH):與標準試驗液的pH之差為2.0以下。
(3)重金屬總含量:重金屬總含量<5.0μg/ml。
(4)高錳酸鉀還原性物質:與標準試驗液的消耗量之差為2.0mL以下。
(5)蒸發殘渣:蒸發殘渣<2.0mg。
2.表面安全性
(1)各連接件的粘接的連接牢固、可靠,焊接件應焊接平整、無虛焊、脫焊或堆焊。
(2)頭端部及插入軟管部外表面應平整、光滑、無明顯的突起或者劃痕、毛刺等缺陷。
3.光學系統性能
(1)光學系統基本要求
光學系統應能保證觀察清晰,不得有脫膠、脫模、和粘接劑的裂紋現象,光學零件不應有影響觀察的麻點、劃痕、氣泡、油污、霉點和灰塵等附著物。
(2)照明有效性: 邊緣均勻性---在有效景深范圍內檢查,照明光斑應充滿視場的有效尺度,且在最大視場角的90%視場處的照度應均勻,在該視場帶上選擇四個正交方位測試,其均勻度應滿足表1的規定。
表1 邊緣均勻度要求
|
標稱視向角范圍 |
不均勻性 |
|
θ≤30° |
≤25% |
|
30°<θ≤50° |
≤35% |
|
50°<θ |
≤45% |
(3)有效光度率: 內窺鏡有效光度率的名義值為××(注冊申請人自行定義),實測值應不大于名義值。
(4)分辨率: 在工作距離等于××mm時(注冊申請人自行定義),分辨率不得低于××lp/mm。
(5)視度調節: 目鏡的視度調節范圍應不小于±3屈光度,調節操作應平穩舒適。
(6)纖維傳像束的斷絲數:在視場直徑范圍的50%內斷絲數不得多于3根,且斷絲數不得相鄰;在視場直徑范圍的50%外斷絲數不得多于10根,且不得有3根及以上的斷絲數相鄰,相鄰斷絲數不得多于2處。
(7)視場角: 視場角為××(注冊申請人自行定義),其極限偏差為±10%。
(8)觀察景深: 觀察景深范圍不小于XXmm—XXmm(注冊申請人自行定義)。
4.吸引、鉗道系統(如適用)
(1)吸引:吸引應通暢,鉗子插入口處應有對人體內腔液體的防噴裝置。吸液操作時,在防噴裝置和吸引按鈕處不應出現液體倒噴現象。
(2)吸引量:吸引量不得少于××mL/min(注冊申請人自行定義)。
(3)吸引按鈕:吸引按鈕應掀動自如,無卡住現象。
5.彎角操縱系統
(1)彎角手輪:彎角手輪在操作時,輕便靈活,無時松時緊或卡住現象。
(2) 彎曲狀態時手術器械的可操作性:當纖維彎角部彎曲成最大角度時,活檢鉗、圈套器等手術器械能順利進出頭端部的鉗道口。
(3)彎曲角度:由注冊申請人自行定義,如向上××°,向下××°,向左××°,向右××°,允差:-10%(上限不計)。
6.密封性能
(1)密封性:將內窺鏡整體放入水中,其內腔能承受22kPa壓強3min而不漏氣。
(2)霧層:內窺鏡在10℃—40℃溫度范圍內使用。光學零件表面不應出現受溫度變化而產生影響觀察的霧層。
7.與附件的配合
(1)與附件接口配合連接:纖維內窺鏡與相應附件接口等連接時,應配合良好,裝卸自如,無過松過緊現象;
(2)與相應附件配合使用:在工作距離處,配用的活檢鉗、圈套器等應能正常工作。
8.標記
(1)主軟管標記:主軟管上應刻有長度標記,標記的線條清晰;
(2)視場光欄標記:視場光欄必須有方向標記,從目鏡看去,箭頭指示方向應在上方。
(3)彎曲操作部的操作方向標記:纖維內窺鏡的彎曲操作部的位置,相對彎角操作部的彎曲方向,彎角方向必須符合YY 1028-2008中4.8.3 a)、4.8.3 b)項的要求。
9.尺寸
內窺鏡型號表和基本參數
|
產品型號 |
工作距離 |
工作長度 |
頭端硬性部外徑 |
主軟管外徑 |
最大插入部外徑 |
最小工作孔道內徑 |
|
XX |
XXmm |
XXmm, 允差±10% |
φXXmm, 允差+5%,下限不計 |
φXXmm, 允差+10%,下限不計 |
≤φXXmm |
≥φXXmm |
10.電氣安全性能
纖維內窺鏡電氣安全應符合GB 9706.1-2007、GB 9706.19-2000的要求。
11.環境試驗
纖維上消化道內窺鏡應符合YY 1028-2008氣候環境試驗II組,機械環境試驗II組和GB11244中4.10的要求。纖維大腸鏡應符合YY /T 0283-2007中氣候環境試驗II組,機械環境試驗II組和GB11244中4.10的要求。
其他纖維內窺鏡的環境要求應符合GB/T14710-2009、GB 11244-2005中4.10氣候環境試驗I組,機械環境試驗I組的要求。
診斷用軟性纖維內窺鏡的主要風險
1.產品自體性能可能引起的危害
(1)不符合現有標準光學性能要求:視場角、視向角(若適用)、分辨率(規定工作距時)、景深范圍、成像清晰和視場質量、放大率(若適用)、斷絲數、照度和視度調節(若適用)不符合現有標準(可參照GB 11244-2005、YY 1028-2008等)的要求,會產生危害。
(2)畸變:診查和/或手術中易導致方位混淆、丟失感覺、視心理改變、判斷失誤等風險。
(3)傳像束斷絲分布和密集度:若斷絲分布于診查和/或手術主要區域--視場中心,除影響成像質量外,造成診斷和/或手術的判定錯誤或病變不能查覺(漏診誤診),甚至無法工作。
(4)顏色分辨能力和色還原性不良:人體腔內顏色接近、變化細微的組織不能區分,病灶不能識別或判斷錯誤,誤診或手術錯誤的風險就極大,甚至有可能發生如動脈破損大出血的立即死亡危險。
(5)照明的光斑分布和邊緣均勻性不良:成像不良,臨床灰階識別困難易診斷或手術失誤;受輻射區域組織局部過熱,可能存在組織烘干或灼傷的潛在危險。
(6)像面邊緣光強與中心光強的分布不良:操作者眼疲勞、不適而帶來人為風險。腔內邊緣組織無法識別診查,腔內手術時,手術器械和內治療設備將失去把握帶來危險;或視場中心光能過大產生眩光/中心光亮飽導致關健區域失效的臨床風險,同時提高光強會造成腔內中心區域多熱而烘干或熾傷組織。
(7)過量輻射:直接與內窺鏡出光口接觸的組織過熱和受照組織過熱烘干或熾傷危險。
2.機械性能不良
(1)不符合現有標準機械性能要求:尺寸、表面安全性能、送水/氣系統、吸引/手術通道系統、彎曲操縱系統、密封質量、附件配合性能不符合現有標準(可參照YY1028-2008)的要求,會產生危害。
(2)最大強度限:發生在診察或手術中,彎曲操縱系統破壞,導致插入人體部分失控、或某形狀下僵住、或手術孔道內器件鎖死,甚至可能破壞外層膠皮而帶來電擊、感染、生物毒性、或直接機械損壞組織風險。
(3)金屬軟管耐久性:發生在診察或手術中,插入人體部分失控、或某形狀下僵住、或手術孔道內器件鎖死,甚至可能破壞外層膠皮而帶來電擊、或感染、或生物毒性、或直接機械損壞組織風險。
(4)彎曲操控機構的耐久性:發生在診察或手術中,插入人體部分失控或僵住或彈回損壞異形腔道,甚至可能破壞外層膠皮而帶來或電擊、感染、生物毒性或直接機械損壞組織風險。
(5)外膠皮的耐久性:發生在診察或手術中,插入人體部分失控或僵住或彈回損壞異形腔道,甚至可能破壞外層膠皮而帶來電擊、感染或直接機械損壞組織風險。甚至有可能材質變性而具生物毒性。
(6)插入頭部膠接的耐久性:發生在診察或手術中,插入人體部分失密封而帶來或電擊、感染或生物毒性等危險。
3.抗腐蝕性
(1)抗腐蝕性能不良:插入人體部分失密封而帶來或電擊、或感染、或生物毒性等危險,或外露部分化學變化而致生物毒性。
4.生物相容性
不符合現有標準(可參照YY 1028-2008、GB/T 16886.1-2011、GB/T 16886.5-2005、GB/T 16886.10-2003系列標準)生物相容性要求:
對可用于接觸患者和使用者材料的生物相容性評價,依據GB/T 16886.1-2011的評價原則。
對符合生物相容性高分子材料的生產批控制,可用材料溶出物試驗證明,試驗內容有:外觀、pH值、重金屬(Pb)、高錳酸鉀還原性物質、蒸發殘留物。
診斷用軟性纖維內窺鏡產品適用的相關標準
1.產品應適用的國家標準、行業標準
GB 9706.1-2007 醫用電氣設備第一部分: 安全通用要求
GB 9706.19-2000 醫用電氣設備第2部分: 內窺鏡設備安全專用要求
GB 11244-2005 醫用內窺鏡及附件通用要求
YY/T 0283-2007 纖維大腸鏡
YY 1028-2008 纖維上消化道內窺鏡
2.可引用或參照的國際標準
ISO 8600-1-2013內窺鏡醫用內窺鏡和內窺鏡附件第1部分: 一般要求
ISO 8600-3-1997光學和光學儀器醫用內窺鏡及內治療設備第3部分: 視場角和視向角的測定
ISO 8600-4-2014內窺鏡醫用內窺鏡及內鏡治療裝置第4部分:插入部分最大寬度的測定
3.可引用或參照的其他相關標準:
GB/T 191-2008 包裝儲運圖示標志
GB/T 14710-2009 醫用電氣設備環境要求及試驗方法
GB/T 16886.1-2011 醫療器械生物學評價第1部分: 風險管理過程中的評價與試驗
GB/T 16886.5-2003 醫療器械生物學評價第5部分: 體外細胞毒性試驗
GB/T 16886.10-2005 醫療器械生物學評價第10部分: 刺激與致敏反應試驗
YY 0076-1992 金屬制件的鍍層分類技術條件
YY/T 0466-2003醫療器械用于醫療器械標簽、標記和提供信息的符號
YY/T 0466.1-2009醫療器械用于醫療器械標簽、標記和提供信息的符號第1部分: 通用要求

來源:嘉峪檢測網


