您當(dāng)前的位置:檢測(cè)資訊 > 法規(guī)標(biāo)準(zhǔn)
嘉峪檢測(cè)網(wǎng) 2021-05-08 10:16
今日,國(guó)家藥監(jiān)局公布浙江巴泰醫(yī)療科技有限公司的創(chuàng)新醫(yī)療器械紫杉醇洗脫 PTCA 球囊擴(kuò)張導(dǎo)管的審評(píng)報(bào)告,我們一起來(lái)了解一下紫杉醇洗脫 PTCA 球囊擴(kuò)張導(dǎo)管在研發(fā)階段做了哪些實(shí)驗(yàn)。
紫杉醇洗脫 PTCA 球囊擴(kuò)張導(dǎo)管審評(píng)報(bào)告
產(chǎn)品中文名稱:紫杉醇洗脫 PTCA 球囊擴(kuò)張導(dǎo)管
產(chǎn)品管理類別:第三類
申請(qǐng)人名 稱:浙江巴泰醫(yī)療科技有限公司
基本信息
技術(shù)審評(píng)概述
一、產(chǎn)品概述
(一)產(chǎn)品結(jié)構(gòu)及組成
該產(chǎn)品由尖端管、球囊及紫杉醇涂層、標(biāo)記環(huán)、遠(yuǎn)端內(nèi)管、 遠(yuǎn)端外管、近端管、導(dǎo)管加強(qiáng)件、導(dǎo)管座、通管針、球囊保護(hù) 套組成。球囊表面涂有藥物涂層,涂層中所含藥物為紫杉醇, 藥物劑量為 3.0μg/mm2。產(chǎn)品環(huán)氧乙烷滅菌,一次性使用。
(二)產(chǎn)品適用范圍
該產(chǎn)品適用于對(duì)患有冠狀動(dòng)脈支架內(nèi)再狹窄的患者進(jìn)行經(jīng)皮腔內(nèi)血管成形術(shù)。
(三)型號(hào)/規(guī)格
產(chǎn)品的型號(hào)規(guī)格見(jiàn)表 1。

(四)工作原理
將產(chǎn)品輸送到血管病變位置,通過(guò)球囊充壓擴(kuò)張、機(jī)械性擴(kuò)張血管的狹窄部位。同時(shí)紫杉醇藥物可涂覆于局部病變組織,預(yù)期產(chǎn)生抑制血管內(nèi)膜增生的作用。
二、臨床前研究概述
(一)產(chǎn)品性能研究
1.產(chǎn)品技術(shù)要求研究
技術(shù)要求研究項(xiàng)目如表 2 所示:
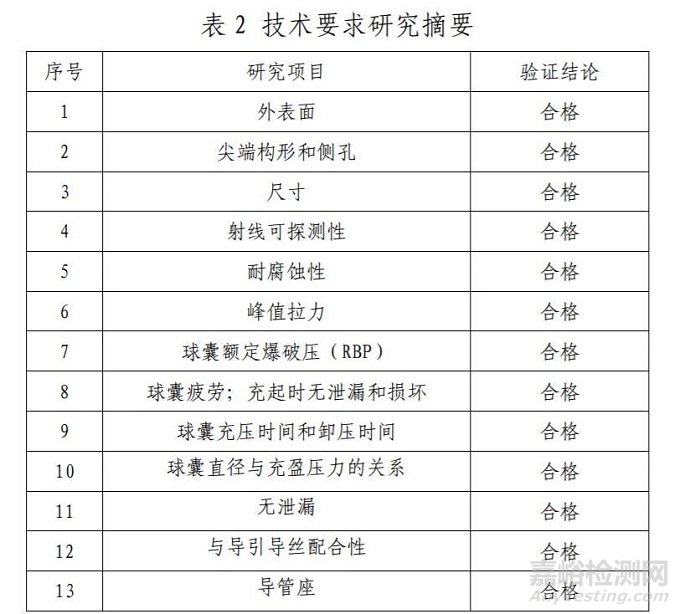
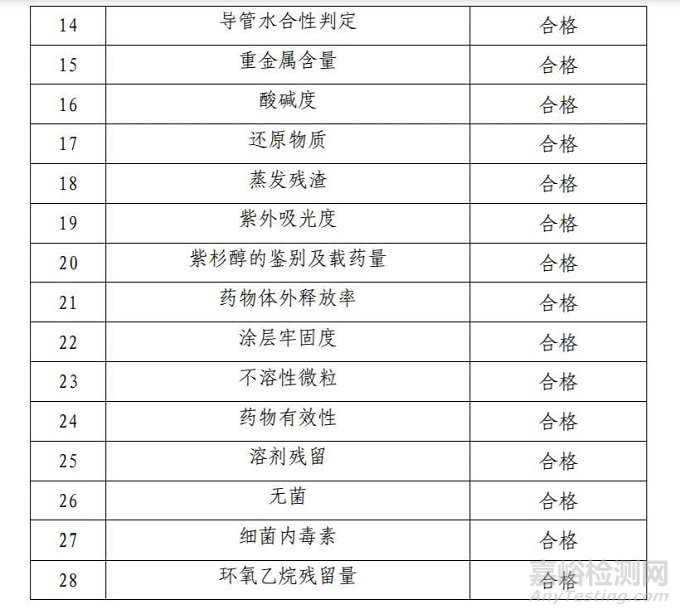
2.產(chǎn)品性能評(píng)價(jià)
產(chǎn)品性能評(píng)價(jià)包括藥物劑量選擇、藥物涂層釋放性能、藥物涂層均勻性、模擬使用、球囊折疊外徑、球囊回抱、球囊擴(kuò)張時(shí)間等性能驗(yàn)證。
(二)生物相容性
依據(jù) GB/T 16886 系列標(biāo)準(zhǔn),開(kāi)展了生物相容性評(píng)價(jià)。進(jìn)行了急性全身毒性、細(xì)胞毒性、皮膚致敏試驗(yàn)、皮內(nèi)反應(yīng)、溶血、 凝血(PTT)、體內(nèi)血栓形成、熱原等項(xiàng)目的生物相容性測(cè)試。針對(duì)紫杉醇藥物在體內(nèi)長(zhǎng)期存留的風(fēng)險(xiǎn),提交了藥物紫杉醇的毒理學(xué)數(shù)據(jù)和藥代動(dòng)力學(xué)評(píng)價(jià)資料。產(chǎn)品生物相容性風(fēng)險(xiǎn)基本可接受。
(三)滅菌
提交了產(chǎn)品的滅菌確認(rèn)報(bào)告,產(chǎn)品采用環(huán)氧乙烷滅菌,無(wú)菌保證水平為10-6,提供了滅菌微生物和物理性能鑒定報(bào)告。提交了環(huán)氧乙烷殘留量和2-氯乙醇?xì)埩袅繙y(cè)試報(bào)告。
(四)產(chǎn)品有效期和包裝
該產(chǎn)品有效期為兩年。申請(qǐng)人提供了貨架有效期驗(yàn)證報(bào)告。驗(yàn)證實(shí)驗(yàn)包括加速老化實(shí)驗(yàn)和實(shí)時(shí)老化實(shí)驗(yàn),包括產(chǎn)品穩(wěn)定性、 包裝完整性和模擬運(yùn)輸驗(yàn)證。
(五)動(dòng)物研究
申請(qǐng)人采用豬模型分別開(kāi)展了安全性、體內(nèi)藥代動(dòng)力學(xué)及組織分布的動(dòng)物實(shí)驗(yàn)研究。
三、臨床評(píng)價(jià)概述
該臨床試驗(yàn)設(shè)計(jì)為隨機(jī)、開(kāi)放、陽(yáng)性平行對(duì)照、多中心試驗(yàn),納入 211 例受試者驗(yàn)證該產(chǎn)品的安全性及有效性。
臨床試驗(yàn)主要評(píng)價(jià)指標(biāo)為術(shù)后 9 個(gè)月時(shí)靶病變節(jié)段內(nèi)晚期 管腔丟失(LLL)。
次要評(píng)價(jià)指標(biāo)為
(1)介入治療成功率;
(2)術(shù)后 9 個(gè)月靶病變節(jié)段內(nèi)再狹窄發(fā)生率;
(3)術(shù)后 30 天、6 個(gè) 月、9 個(gè)月和 12 個(gè)月時(shí)器械相關(guān)的心血管臨床復(fù)合終點(diǎn);
(4)術(shù)后 30 天、6 個(gè)月、9 個(gè)月和 12 個(gè)月時(shí)患者相關(guān)的心血管臨床復(fù)合終點(diǎn);
(5)ARC 定義的血栓事件發(fā)生率。
共在 13 家臨床機(jī)構(gòu)開(kāi)展臨床試驗(yàn),全分析集(FAS)共有 211 例,其中試驗(yàn)組 105 例,對(duì)照組 106 例。符合方案集(PPS) 共有 168 例,其中試驗(yàn)組有 81 例,對(duì)照組有 87 例;安全集(SS) 共有 211 例,其中試驗(yàn)組 105 例,對(duì)照組 106 例。
主要評(píng)價(jià)指標(biāo):術(shù)后 9 個(gè)月,靶病變節(jié)段內(nèi)晚期管腔丟失試驗(yàn)組和對(duì)照組分別為 0.35±0.42mm vs 0.38±0.45mm(FAS),0.34±0.46mm vs 0.36±0.45mm(PPS),非劣效結(jié)論成立。
次要評(píng)價(jià)指標(biāo):無(wú)統(tǒng)計(jì)學(xué)差異。
安全性評(píng)價(jià):試驗(yàn)組與對(duì)照組不良事件發(fā)生情況為試驗(yàn)組 164 例次,對(duì)照組 135 例次,與研究器械有關(guān)不良事件試驗(yàn)組 27 例次,對(duì)照組 27 例次。
經(jīng)技術(shù)審評(píng),可得出申報(bào)產(chǎn)品非劣效于對(duì)照產(chǎn)品的結(jié)論。
四、產(chǎn)品受益風(fēng)險(xiǎn)判定
(一)風(fēng)險(xiǎn)分析
參照《YY/T 0316-2016 醫(yī)療器械風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的應(yīng)用》,對(duì)該產(chǎn)品進(jìn)行風(fēng)險(xiǎn)分析。對(duì)目前已知及可預(yù)測(cè)風(fēng)險(xiǎn)采取了風(fēng)險(xiǎn)控制措施,經(jīng)綜合評(píng)價(jià),在目前認(rèn)知水平上,認(rèn)為該產(chǎn)品獲益/受益大于風(fēng)險(xiǎn)。
(二)警示及注意事項(xiàng)
為保證用械安全,需在說(shuō)明書中提示以下信息
1. 警告
•本產(chǎn)品只能由具有血管造影術(shù)、經(jīng)皮冠狀動(dòng)脈成形術(shù)(PTCA)及冠狀動(dòng)脈血管內(nèi)支架植入術(shù)經(jīng)驗(yàn)的醫(yī)生操作。操作期間心臟手術(shù)組應(yīng)處于待命狀態(tài);
•使用前請(qǐng)勿打開(kāi)無(wú)菌屏障包裝;
•如果包裝或產(chǎn)品明顯受損,請(qǐng)勿使用;
•請(qǐng)勿使用超過(guò)「有效期限」的產(chǎn)品;
•球囊導(dǎo)管僅供單個(gè)患者使用。請(qǐng)勿重復(fù)滅菌和重復(fù)使用。重復(fù)滅菌、重復(fù)使用帶來(lái)的風(fēng)險(xiǎn)包括:
a. 損壞產(chǎn)品的完整性和/或產(chǎn)品失效,有可能導(dǎo)致患者受傷、患病或死亡;
b. 產(chǎn)生產(chǎn)品污染和/或?qū)е禄颊吒腥净蚪徊娓腥镜娘L(fēng)險(xiǎn),包括但不限于將具有感染性的疾病從一個(gè)患者傳染到另一個(gè)患者。產(chǎn)品的污染可能導(dǎo)致患者受傷、患病或死亡。
•本產(chǎn)品包含紫杉醇,是一種已知的基因毒素。請(qǐng)勿用于哺乳期的婦女、孕婦或計(jì)劃生育的女性/男性;
•導(dǎo)管接觸到血管系統(tǒng)時(shí),必須在高品質(zhì)血管造影機(jī)監(jiān)測(cè)下操作。除非球囊已完全排空,否則請(qǐng)勿推進(jìn)或收回球囊導(dǎo)管。如果操作時(shí)受阻,先判斷受阻原因再繼續(xù)。對(duì)導(dǎo)管過(guò)度施力可能導(dǎo)致尖端破損或球囊破裂;
•請(qǐng)勿超出額定爆破壓使用。如果超過(guò)額定爆破壓,球囊可能爆破。為避免壓力過(guò)大,建議使用壓力監(jiān)測(cè)裝置;
•建議球囊充盈介質(zhì)(50% 造影劑/50% 無(wú)菌生理鹽水),請(qǐng)勿使用空氣或任何氣體介質(zhì)將球囊充盈;
•如果您在導(dǎo)管插入期間明顯感覺(jué)到任何阻力,不得再用力推動(dòng)導(dǎo)管。此阻力能損害球囊導(dǎo)管。如果通過(guò)導(dǎo)引導(dǎo)絲向前推動(dòng)球囊導(dǎo)管時(shí)還存在阻力,請(qǐng)撤回整套傳輸系統(tǒng);
•絕對(duì)禁止直接觸摸球囊、擦拭球囊表面,以避免球囊藥物涂層脫落。
2. 注意事項(xiàng)
心臟手術(shù)組在 PTCA 實(shí)施期間應(yīng)保持警戒狀態(tài)。球囊的充壓直徑應(yīng)與冠狀動(dòng)脈血管直徑相一致。請(qǐng)勿使用直徑超過(guò)冠狀動(dòng)脈腔的球囊。使用前請(qǐng)勿搖動(dòng)導(dǎo)管來(lái)除去球囊內(nèi)的氣泡。未確定阻力位置及采取補(bǔ)救措施前請(qǐng)勿向前推動(dòng)球囊導(dǎo)管內(nèi)的導(dǎo)絲。此球囊導(dǎo)管在壓力小于或等于球囊額定爆破壓(RBP)使用時(shí),能確保 99.9%的概率不會(huì)發(fā)生破裂(置信度 95%)。不建議使用超出額定爆破壓的壓力進(jìn)行擴(kuò)張,因?yàn)榇藟毫赡軐?dǎo)致球 囊破裂或使球囊的各結(jié)合點(diǎn)失效。如果發(fā)生此種情況,給球囊泄壓并取出下球囊。
•應(yīng)在插入球囊導(dǎo)管前按照 PCI 的標(biāo)準(zhǔn)治療方案對(duì)患者進(jìn)行適當(dāng)?shù)乃幬镏委煟鼓獎(jiǎng)⒀軘U(kuò)張劑等);
•輕拿輕放以避免對(duì)導(dǎo)管造成損壞。避免劇烈彎曲或扭結(jié)導(dǎo)管管身。不要使用已經(jīng)損壞的導(dǎo)管;
•手術(shù)前請(qǐng)勿彎曲或擠壓球囊藥物涂層;
•如果無(wú)菌包裝破損或開(kāi)封,請(qǐng)勿使用此球囊導(dǎo)管。請(qǐng)勿重新滅菌球囊導(dǎo)管。使用前必需檢查產(chǎn)品,確保運(yùn)輸期間未損壞;
•器械僅一次性使用,禁止二次使用。球囊壓力不得超出制造商建議的額定爆破壓。導(dǎo)管系統(tǒng)只能由受過(guò) PTCA 操作培訓(xùn)的醫(yī)生使用。球囊只能使用液態(tài)介質(zhì)充盈。未使用適當(dāng)?shù)囊航?質(zhì)(如造影劑濃度過(guò)高)可能導(dǎo)致泄壓時(shí)間延長(zhǎng)和泄壓次數(shù)增加。禁止使用空氣或氣體介質(zhì)。
(三)禁忌癥
球囊導(dǎo)管禁用于以下情形:
•孕婦和哺乳期婦女;
•治療血管完全閉塞;
•心源性休克患者;
•出血體質(zhì)或其他如胃腸道潰瘍或腦循環(huán)功能障礙等限制使用抗血小板聚集藥和抗凝治療的病癥;
•出現(xiàn)血栓或冠狀動(dòng)脈血流不良癥狀的心肌梗死后立即進(jìn)行的手術(shù);
•不能用PTCA或其他介入技術(shù)治療的病變;
•射血分?jǐn)?shù)低于30%的患者;
•左干(左冠狀動(dòng)脈第一節(jié)段)治療;
•心臟搭橋手術(shù)指癥;
•需伴隨用藥的禁忌癥;
•無(wú)顯著狹窄的管狀動(dòng)脈痙攣;
•避免與藥物洗脫支架同時(shí)使用,因?yàn)檫@可能造成用藥過(guò)量。
綜合評(píng)價(jià)意見(jiàn)
該申報(bào)產(chǎn)品屬于創(chuàng)新醫(yī)療器械特別審批項(xiàng)目, 編號(hào) 201600188。申請(qǐng)人的注冊(cè)申報(bào)資料符合現(xiàn)行要求,依據(jù)《醫(yī)療 器械監(jiān)督管理?xiàng)l例》(國(guó)務(wù)院令第 680 號(hào))、《醫(yī)療器械注冊(cè)管理 辦法》(國(guó)家食品藥品管理總局令 2014 年第 4 號(hào))等相關(guān)醫(yī)療 器械法規(guī)與配套規(guī)章,經(jīng)系統(tǒng)評(píng)價(jià)后,建議準(zhǔn)予注冊(cè)。
2021 年 4 月 26 日

來(lái)源:CMDE


