您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-03-02 23:55
1977年9月16日,世界上第一例冠脈介入由Gru?ntzig醫生于瑞士蘇黎世完成,僅使用球囊將38歲男煙民的LAD近端病變進行了擴張,取得了良好的效果。但并非每個患者都如此幸運,早期單純球囊擴張的再狹窄率高的驚人,促使1986年冠脈支架的誕生。心內科醫生會冠脈介入的不少,但真正了解支架的人卻不多。

圖1 7種支架的micro-CT圖像
這是7種支架在micro-CT下的圖像。與臨床中用到的CT相同,科研用的micro-CT同樣使用X線掃描來重建圖像,只不過成像精度更高,可以達到μm級。與那些“圖片僅供參考,請以實物為準”的商品不同,冠脈支架在設計圖上和在micro-CT下差別并不大,但不要忘了它們的實際大小往往連一個指節都不到,因此可以說是頂尖制造水平的體現。
讓我們隨著冠脈支架制作的步驟,來看看一塊原材料在經歷了怎樣的考驗后才能成為冠脈醫生手中開通血管的利器。
步驟1、 選擇支架材料
支架材料決定了設計、加工、使用中的方方面面,因此選擇合適的材料非常重要。
早期冠脈支架主要由316L不銹鋼制成,其中約70%為鐵元素,加入了少量鎳、鉻、鉬。316L不銹鋼有幾個缺點,首先是密度較低,X光下可見性較差,需要加入其它高密度金屬來改善可見性,但可能造成額外的血管壁炎癥。其次316L鋼耐腐蝕性差,釋放出的鎳離子對血管壁有害,需要特殊工藝進行彌補。最重要的是316L鋼的機械強度不高,往往需要更厚的支架梁來保證結構穩定。
鈷鉻合金(CoCr)、鉑鉻合金(PtCr)的機械強度較316L鋼高,因此可以將支架梁制作的更薄,對血流的影響更小,也更容易內皮化。由于密度較高,X光下顯影效果好。在核磁下,CoCr相比不銹鋼偽影較小,對核磁觀察更加友好。新一代的金屬支架絕大多數由CoCr或PtCr制成。
鎳鈦合金(NiTi)主要用于制作自膨脹支架。NiTi彈性好,且具有形狀記憶的特性,在遞送過程中是折疊的,一旦到達病變后因為溫度升高可以自動膨脹回支架形狀。不過鎳離子對血管壁存在毒性,需要特殊處理以減少影響;另外NiTi在X光下可見性較差,也需要添加不透X光的物質。
可降解支架大多數仍在研發過程中,目前披露的資料中聚合乳酸使用最廣泛(逐漸降解為H2O與CO2),但機械強度較差,支架梁往往偏厚,對內皮化及局部血流不利,且降解過程中存在支架斷裂散架的問題。鎂、鐵等新材料可以反應為可溶鹽而降解,但能否克服聚合乳酸的弱點尚需進一步研究。
步驟2 、進行支架設計
支架類似于一圈圈的金屬環(ring)疊在一起,由連接體(connector)將金屬環連在一起,最終形成圓柱型結構。相鄰2個金屬環與相鄰2個連接體圍成的區域稱為1個單元(cell)。支架對血管壁的徑向支撐力主要由金屬環提供,而支架適應血管走行的彎曲能力則由連接體提供。
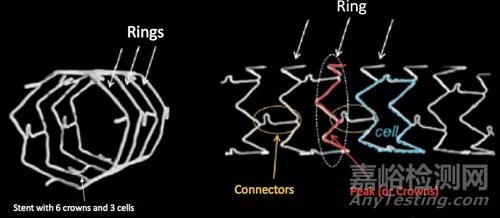
圖2 金屬環、連接體與支架單元
連接體少一些,支架適應血管走行的彎曲性更好,更方便在鈣化迂曲的冠脈中穿行至病變,但變形的風險更高;連接體多一些,結構確實更穩定,但也更難彎曲。
如果在每個環上的拐點都有連接體,被稱為閉合單元(closed cell);如果隔幾個拐點才有連接體,被稱為開放單元(open cell)。閉合單元的好處在于對血管壁支撐更完全,對斑塊的覆蓋更好,但容易堵塞側壁的分支血管;開放單元雖然對分支血管更加友好,也對內皮覆蓋有好處,但更容易變形,更容易讓斑塊凸入管腔形成內膜脫垂。

圖3 閉合單元與開放單元
連接體與金屬環的連接方式,目前主要有4種(如下圖),①峰-連接體-谷,②峰-連接體-峰,③峰-連接體-峰(金屬圈未對齊),④支架梁中央-連接體-支架梁中央。

圖4 支架連接體與金屬環的不同連接方式
正如上面所說,設計上的差異會帶來不同的優點與缺點,因此沒有什么設計是完美的,都需要進行權衡。
步驟3 、支架精密加工
有了理想的材料與周密的設計,接下來是將材料變成支架。
最常見的支架加工技術是激光切割。將金屬加工為非常光滑的金屬管后,根據設計圖紙使用高能量的激光照射金屬管,照射之處金屬熔化甚至直接汽化,再通過高壓氣流將這些廢料吹走。由于激光導致的加熱效應并不完全局限于切割部位,會對表面光滑度等造成影響,需要很復雜的后期處理來使之成為合格支架。

圖5 激光切割支架
除激光切割外,還有一些技術被應用于支架制作。比如廣泛應用于芯片制作的光蝕刻技術,利用電極放電能量的電蝕刻技術,利用電鍍技術一層一層鑄出支架的電鑄技術,或通過模具將金屬鑄造為支架、將金屬絲編織焊接為支架等。但因為各種原因,這些技術不如激光切割使用廣泛。更多的新技術正在嘗試使用中,比如大熱的3D打印技術,盡管在制造支架時存在困難,但未來仍存在廣闊的應用前景。
步驟4、 選擇抗增殖藥物
支架放置在血管中,逐漸被內皮細胞覆蓋是好事,可以大大減少支架作為異物促進血栓形成的風險。但如果新生內膜長得太厚,就會導致支架內再狹窄。保持支架內血栓與支架內再狹窄的平衡很難。
裸金屬冠脈支架剛被發明時,新生內膜爬的很快,支架內再狹窄非常常見。為了應對再狹窄,支架梁上開始使用抗增殖藥物,但太強的抗增殖效果又影響內皮化,因此頻繁出現支架內血栓。當前使用的支架全都是新一代藥物洗脫支架(DES),平衡了支架內再狹窄與支架內血栓的風險,使得總體風險最低。
應用在冠脈支架的抗增殖藥物主要有2大類, mTOR抑制劑與紫杉醇。
最早發現的mTOR抑制劑是雷帕霉素(rapamycin,又稱為sirolimus),因發現于復活節島(Rapa Nui)而得名,而mTOR(mammalian target of rapamycin)的名字又來自于雷帕霉素。mTOR抑制劑的作用機制比較復雜,主要靠抑制從G1期進入S期而抑制增殖。早期雷帕霉素支架的代表產品是Cypher,相比裸金屬支架大大降低了支架內再狹窄風險,但因支架內血栓風險高已被淘汰。現在仍有很多支架在使用雷帕霉素,但聚合物涂層技術已與Cypher大大不同,在下一節中會提到。
基于雷帕霉素的幾種新型mTOR抑制劑均以-limus結尾:依維莫司(everolimus)、佐他莫司(zotarolimus)與百奧莫司(biolimus A9)。這幾種新藥脂溶性更好、轉移效率更高,對內皮化的影響更小,同時也沒有丟掉優秀的抑制新生內膜增殖的特性。依維莫司永久涂層支架是新一代DES中研究最多的,再狹窄與支架內血栓風險均較低,可以稱為“金標準”。近年很多支架被證明效果不劣于依維莫司永久涂層支架,今后會不會有更理想的支架、依維莫司永久涂層支架是否能繼續作為“金標準”仍未可知。
紫杉醇(paclitaxel)因分離自太平洋紫衫(Taxus brevifolia)而得名。紫杉醇的主要作用機制是在細胞增殖的M期阻止微管蛋白的降解,導致細胞無法分裂。最早的紫杉醇支架直接以紫衫樹命名(Taxus),與Cypher同樣的原因已經見不到了。現在紫杉醇主要用在藥物球囊上,因為紫杉醇相比雷帕霉素脂溶性好、轉移效率高、噴涂工藝簡單,絕大多數藥物球囊(DCB)使用紫杉醇,但近年也有DCB嘗試雷帕霉素。
步驟5 、覆蓋聚合物涂層
聚合物是抗增殖藥物儲存的溶劑,絕大多數支架都需要覆蓋聚合物涂層來儲存抗增殖藥物。除儲存外,聚合物涂層也決定了抗增殖藥物的釋放速度。目前涂層主要分為3類,永久涂層、可降解涂層與無涂層。涂層所用材料的中文名稱非常復雜,下文中僅用英文簡寫。
早期永久涂層支架的血栓風險除了抗增殖藥物以外,涂層生物相容性差也是重要原因。Cypher與Taxus兩款DES的鼻祖分別使用了SIBS與PEVA+ PBMA作為涂層,均為永久聚合物涂層,然而兩者的涂層均會緩慢引起炎癥并增加血栓風險。在藥物釋放上,Cypher的涂層可以保證雷帕霉素在前30天釋放80%,Taxus的復雜涂層則保證紫杉醇在前10天僅釋放<10%,剩余的藥物終身緩慢釋放。
新一代永久聚合物涂層采用的BioLinx、PVDF-HFP等生物相容性較好,可以大大改善內皮愈合并減輕炎癥。金屬表面容易形成血栓,永久聚合物涂層還可以起到隔絕金屬與血液的作用。盡管聚合物永久存在,但抗增殖藥物很快就會耗竭,比如PVDF-HFP涂層在置入第1天就會釋放25%的依維莫司,1個月內釋放75%,4個月時基本完全釋放;而BioLinx涂層在60天內釋放85%的佐他莫司,180天基本完全釋放。
可降解涂層使用聚合乳酸與PLGA等可在體內降解的聚合物,最快的可以在2個月內降解,慢的可能需要9-15個月,早在聚合物降解前抗增殖藥物就已經釋放完畢(1-4個月)。永久涂層的藥物完全釋放并不是真正意義上的“完全”,因為聚合物仍會持續微劑量釋放藥物,可能促進新生動脈粥樣硬化與內皮愈合不良。可降解涂層在一些病理研究中優于新一代永久涂層,但在現有的臨床研究中效果與永久涂層效果類似,可能需要更長時間的隨訪來觀察涂層降解是否有額外獲益。
近年出現的無涂層支架不使用聚合物,需要特殊設計以攜帶藥物,對支架所用的材料及加工技術要求非常高。現有的技術可以在支架梁靠近血管壁的一側打上大孔或微孔來放置藥物,還有些支架的特殊技術允許直接在金屬表面涂抹藥物。除難以攜帶藥物外,無涂層還存在藥物迅速流失的問題,需要使用特殊手段以減緩藥物釋放。幾種無涂層支架在臨床研究中的效果與新一代永久涂層支架類似,與可降解涂層一樣,無涂層設計是否具有額外獲益一樣未知。

圖6 無涂層支架表面攜帶藥物的大孔與微孔
結語
從原材料到一枚支架誕生,需要精心的設計與高超的加工手段。除了本文中說到的制造過程外,后期進行大規模臨床研究必不可少,只有臨床研究中證明安全有效后獲得CFDA的批準,冠脈醫生才能使用到它。
不斷進化的支架技術固然重要,但做好冠心病的預防、避免支架更加重要,正所謂“不治已病而治未病”,我們也期待有更為先進的技術取代“支架”,讓患者得到更加完美的“介入治療”。
參考文獻:
[1] Torii S, Jinnouchi H, Sakamoto A, et al. Drug-eluting coronary stents: insights from preclinical and pathology studies[J]. Nature Reviews Cardiology, 2019: 1.
[2] Byrne R A, Stone G W, Ormiston J, et al. Coronary balloon angioplasty, stents, and scaffolds[J]. The Lancet, 2017, 390(10096): 781-792.
[3] Chichareon P, Katagiri Y, Asano T, et al. Mechanical properties and performances of contemporary drug-eluting stent: focus on the metallic backbone[J]. Expert review of medical devices, 2019, 16(3): 211-228.
[4] Watson T, Webster M W I, Ormiston J A, et al. Long and short of optimal stent design[J]. Open heart, 2017, 4(2): e000680.
[5] Schmidt T, Abbott J. Coronary stents: history, design, and construction[J]. Journal of clinical medicine, 2018, 7(6): 126.
[6] Guerra A J, Ciurana J. Stent’s Manufacturing Field: Past, Present, and Future Prospects[M]//The Perfect Stent-Dreams and Realities of Coronary Interventions. IntechOpen, 2018.
[7] Habib A, Finn A V. Antiproliferative drugs for restenosis prevention[J]. Interventional cardiology clinics, 2016, 5(3): 321-329.
[8] Rizas K D, Mehilli J. Stent polymers: do they make a difference?[J]. Circulation: Cardiovascular Interventions, 2016, 9(6): e002943.
[9] O’Brien B, Zafar H, Ibrahim A, et al. Coronary stent materials and coatings: a technology and performance update[J]. Annals of biomedical engineering, 2016, 44(2): 523-535.
[10] Kommineni, N., Saka, R., Khan, W. et al. Non-polymer drug-eluting coronary stents[J]. Drug Deliv. and Transl. Res. (2018) 8: 903.

來源:醫脈通心內頻道


