您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2020-02-27 17:31
作者:王琰,張培培 1, 姚尚辰 1, 尹利輝 1, 林蘭 , 張彥民 2, 胡昌勤 1
1. 中國食品藥品檢定研究院, 北京 102629;
2. 西安交通大學藥學院, 西安 710061
摘要:
目的: 藥品中外源性殘留蛋白不僅影響藥品質量,且嚴重威脅人用藥安全。青霉素G酰基轉移酶(簡稱PGA)是酶法工藝生產β-內酰胺抗生素過程中所用關鍵催化酶,有必要對其進行研究并嚴格控制終產品中的蛋白殘留量。已有方法采用凝膠過濾法(GFC)對殘留蛋白進行前處理,但該法存在富集效率低等諸多問題。本文探討并嘗試建立一種不同方式和原理的蛋白分離、富集方法,采用超濾前處理結合考馬斯亮藍(Bradford)法測定酶法工藝產品阿莫西林中殘留蛋白的含量。方法: 采用Amicon®Ultra-15型超濾管(15 mL,截留分子量為3 kDa)對阿莫西林供試液進行前處理,離心力為5000 g(7000rpm),對溶液進行凈化并對蛋白進行濃縮富集,再采用Bradford法對濃縮液進行蛋白定量測定,檢測波長為595 nm。結果: 該法具有較好的專屬性;蛋白濃度在1.0~100.0 μg·mL-1(r=0.9921)內校正曲線(lg A~lg C)的線性關系良好;回收率>72%(n=3×3);Bradford法最低檢出限為0.1 μg·mL-1,相當于0.0001%;Bradford法的精密度≤ 5.0%。結論: 該方法準確、可靠,相比于已有方法,蛋白富集量更大、操作簡便、設備要求低,可用于酶法工藝阿莫西林中殘留蛋白的測定,對酶法工藝半合成抗生素中殘留蛋白的質控及酶法工藝穩定性監測提供了一定技術指導。
關鍵詞:超濾 Bradford法 酶法工藝 阿莫西林 殘留蛋白 含量測定
阿莫西林(AMO)是一種β-內酰胺類半合成抗生素(圖 1), 具有高效廣譜抗菌作用, 通過抑制細菌細胞壁黏肽合成酶的活性而使細菌喪失活性[1]。臨床中主要用于治療革蘭氏陽性桿菌和陰性桿菌所致各種感染, 如胃炎、慢性支氣管炎及尿路感染等[2]。阿莫西林的生產一直采用經典化學法, 但該法反應步驟多、有機試劑用量大、會產生大量的工業"三廢", 造成嚴重環境污染。酶法工藝是一種較新發展起來的綠色生物催化技術, 具有反應步驟少、反應選擇性高和工業"三廢"產生少等優點, 2000年后國際上開始大規模應用于β-內酰胺抗生素的商業化生產[3-4]。青霉素G酰基轉移酶(簡稱PGA)是該工藝中用到的關鍵催化酶, 在這種催化酶的催化作用下, 起始原料6-氨基青霉烷酸(6- APA)可與D-對羥基苯甘氨酸甲酯(D-HPGM)通過催化反應直接合成阿莫西林。

圖 1 阿莫西林結構式
帝斯曼制藥公司(英文名稱DSM)最早開始研究酶法工藝技術并用于阿莫西林的工業化大生產。目前, 國內已有多個企業逐漸采用酶法工藝生產阿莫西林原料。由于該工藝中用到的PGA是一種生物大分子, 已有文獻研究結果表明[5-6], 大分子外源性蛋白可引起諸多不良反應, 與藥品安全性密切相關。另一方面, 我國企業的該類產品在經CDE審評或出口歐盟時, 質控機構要求提供殘留蛋白檢測數據, 以證明酶法工藝的可靠性[7-9]。因此, 從藥品質控角度和法規要求兩方面考慮, 均有必要嚴格監控終產品中PGA殘留量。
目前, 相關法規僅要求注冊申報時應提供相關檢測數據, 但未對相關檢測方法提出明確要求。對于酶法工藝合成阿莫西林, 終產品中殘留蛋白除來自PGA外, 還可能來自于起始原料6-APA合成上游發酵工藝中的宿主蛋白及發酵液等。當較難獲得PGA及相關標準品的情況下, 可采用測定總蛋白方法對終產品中的殘留蛋白的總量進行控制。目前, 有多種蛋白定量檢測方法, 如考馬斯亮藍(Bradford)法、福林酚(Lowry)法、凝膠過濾(GFC)法、質譜法等[10-11]。相比于其它方法, Bradford法線性范圍較寬, 靈敏度更高, 適用于低濃度蛋白的測定, 是一種通用、快速簡便的檢測方法[12-13]。但是, 由于阿莫西林結構中含有多個氨基結構, 實驗考察結果表明氨基會對Bradford法產生干擾, 表現為溶液顏色變藍, 不能直接測定, 因此, 需要對阿莫西林與殘留蛋白進行分離前處理。目前對抗生素中殘留蛋白進行前處理的方法如GFC法[14], 雖能對殘留蛋白進行有效分離與富集, 但對儀器設備要求高、分離效果受凝膠色譜柱填料影響大、需多次進樣收集, 實驗周期長, 大大影響了實驗效率。超濾技術是介于微濾和納濾之間的一種膜分離技術, 具有分離、濃縮和凈化等作用, 其截留機理主要包括膜篩分和靜電作用[15]。不同于GFC法, 超濾法根據不同截留分子量(MWCO)濾膜對殘留蛋白進行富集, 具有操作更簡便、儀器要求更低等優點[16-18]。本研究依據阿莫西林(分子量為365.4)和蛋白分子(如PGA是由一個異質二聚體構成, 總分子量約8萬[19])之間分子量的較大差異, 嘗試采用超濾法對抗生素樣品進行前處理, 目的是將供試品溶液中阿莫西林干擾去除、凈化溶液(降低溶液鹽濃度)和對樣品中的微量蛋白進行濃縮富集。實驗通過考察不同超濾步驟及準確性確定最優超濾條件, 對阿莫西林原料中殘留總蛋白進行有效分離和富集, 然后采用Bradford法對蛋白進行準確定量。
1 儀器與試藥
Amicon? Ultra-15型超濾管(15 mL, MWCO為3 kDa, 德國Merk Millipore公司), AllegraTM 64R型高速低溫離心機(美國Beckman Coulter公司), Thermo酶標儀(美國Thermo公司), CP225D型電子分析天平(德國Satorious公司)和Milli-Q Reference型高純水發生儀(德國Merk Millipore公司); 96孔板(美國Corning公司); 20、100、200和1000 μL移液器(德國Eppendorf公司)。
牛血清白蛋白(BSA)標準品(批號TK269567, 2 mg·mL-1, 美國Thermo公司); 阿莫西林(6批, 市售); 蛋白染料Bradford試劑(批號033K9279, 美國Sigma公司); 碳酸鈉為分析純; 水為Milli-Q超純水。
2 方法與結果
2.1 溶液配制
2.1.1 標準品貯備液(Ⅰ)
精密量取BSA標準品適量, 加水溶解并稀釋成濃度為100 µg·mL-1的溶液。
2.1.2 標準品貯備液(Ⅱ)
精密量取BSA標準品適量, 加0.04%碳酸鈉(Na2CO3)溶液溶解并稀釋成濃度為100 µg·mL-1的溶液。
2.1.3 標準溶液
精密量取標準品貯備液(Ⅰ)適量, 分別加水溶解并稀釋成濃度為0.4、2.0和20.0 µg·mL-1的溶液, 作為標準溶液(Ⅰ)、(Ⅱ)和(Ⅲ)。
2.1.4 供試品溶液
精密稱取阿莫西林1.0 g, 加4% Na2CO3溶解并稀釋成濃度為100 mg·mL-1的溶液, 待用。
2.1.5 4% Na2CO3溶液
精密稱取4 g Na2CO3, 加水100 mL溶解并稀釋, 即得。
2.1.6 0.04% Na2CO3溶液
精密量取4% Na2CO3溶液適量, 按1:100比例加水稀釋, 即得。
2.2 樣品前處理
精密量取待用溶液5 mL置超濾管, 按圖 2中路線1或路線2方法進行前處理, 采用5000 g(7000 rpm)離心力超濾, 最終濃縮得上層溶液約1 mL, 待測。
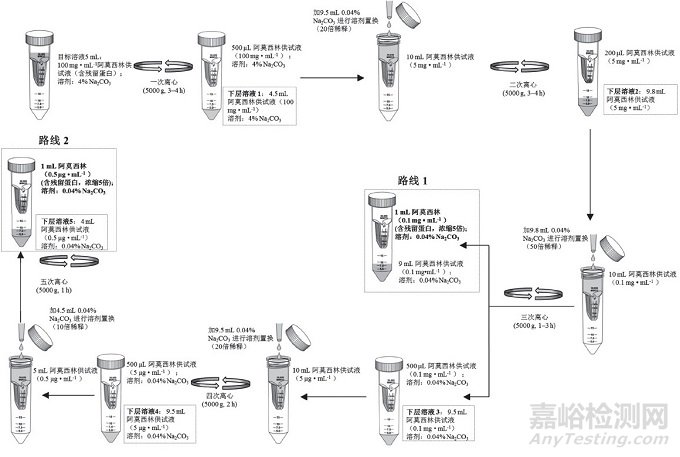
圖 2 樣品前處理流程圖(路線1和路線2)
2.3 測定法
精密量取待測溶液500 μL, 加入500 μL的Bradford試劑, 混勻, 在室溫下放置5 min, 吸取該溶液150 μL置96孔板中, 于595 nm的波長下測定其吸光度值。
2.4 專屬性
Bradford蛋白定量法原理為考馬斯亮藍G-250染料與蛋白質的芳香族氨基酸和/或堿性氨基酸結合, 溶液由紅色變成藍色, 于595 nm下測定其吸光度, 進而通過吸光度與已知蛋白質濃度關系測定未知蛋白質的含量[10-11]。由于阿莫西林結構中6位側鏈含有兩個堿性氨基(伯氨和仲氨), 會對Bradford法測定產生干擾, 實驗發現, 阿莫西林可使考馬斯亮藍染料明顯變藍, 因此, 采用超濾法對樣品進行前處理以除去阿莫西林。實驗采用Amicon? Ultra-15型超濾管, MWCO為3 kDa, 即超濾時分子量大于3 kDa的大分子均被截留至上層液, 而分子量小于3 kDa的小分子均透過超濾膜被離心至下層液。阿莫西林分子量約為365 Da, 如果考慮其溶液狀態下可能形成二聚體甚至三聚體, 其分子量不會超過3 kDa。因此, 樣品溶液超濾前處理時, 阿莫西林及其聚合物會被較好地去除, 上層液中僅保留分子量在3 kDa以上的大分子蛋白, 用于進行后續蛋白專屬測定。
2.5 線性與范圍
精密量取標準品貯備液(Ⅱ)適量置1.5 mL小管, 分別加0.04% Na2CO3溶液稀釋至500 μL, 制成蛋白濃度分別為1.0、5.0、10.0、25.0、50.0和100.0 µg·mL-1的溶液。按"2.3"節下方法測定吸光度值, 以lg A(吸光度值的對數)為縱坐標, lg C (濃度的對數)為橫坐標, 繪制標準曲線并得回歸方程。結果顯示, 回歸方程為lg A=0.6940 lg C- 1.6259, 回歸系數r為0.9921。表明該方法的蛋白濃度在1.0~100.0 µg·mL-1, 線性關系良好。
2.6 精密度
精密量取"2.5"節下濃度分別為1.0、5.0、10.0、25.0、50.0和100.0 µg·mL-1蛋白系列溶液各3份置96孔板, 按"2.3"節下方法測定吸光度值, 計算相對標準偏差(RSD)。結果顯示RSD≤2.3% (n=6×3), 表明該方法重復性良好。取上述蛋白系列溶液同法連續3天進行測定, 結果顯示RSD≤5.0%(n=6×3×3), 表明該方法重現性良好。
2.7 檢測限
以0.04% Na 2CO3溶液作空白, 取樣3份, 按"2.3"節下方法連續測定吸光度值, 得均值(ā)和標準差(SD), 分別以ā+3SD和ā+10SD為考察指標, 計算該法的LOD和LOQ。該法的LOD為0.1 µg·mL-1, 代入公式1計算即為0.0001%(相當于1 ppm); LOQ為0.6 µg·mL-1, 即0.0003%(相當于3 ppm)。表明該法的靈敏度良好。
公式1:

2.8 準確度
精密量取標準品貯備液(Ⅰ)適量置1.5 mL小管, 分別采用水和4% Na2CO3溶液做溶劑, 稀釋制成蛋白濃度水平分別為0.2、1.0和10.0 µg·mL-1的溶液, 待用; 再分別精密量取供試品溶液各2.5 mL, 分別加標準溶液(Ⅰ)、(Ⅱ)和(Ⅲ)各2.5 mL, 混勻, 制成蛋白濃度水平分別為0.2、1.0和10.0 µg·mL-1的加樣回收溶液, 待用。分別精密量取上述制備得到的待用溶液各5 mL, 按"2.2"節下方法中路線1進行前處理(圖 2中路線1), 再采用"2.3"節下方法進行測定, 得到吸光度值, 由"2.5"節下蛋白標準曲線得到相應濃度并計算回收率。結果顯示, BSA在3種溶液中的回收率均大于72%(見表 1), 表明回收率良好。

表 1 BSA在3種不同溶液中回收率考察結果
2.9 樣品測定
精密量取供試液5 mL, 分別按"2.2"節下方法中路線1和路線2進行前處理, 再精密量取200 μL上層溶液, 加0.04% Na2CO3溶液300 μL混勻, 按"2.3"節下方法進行測定, 得吸光度值(A), 由"2.5"節下蛋白標準曲線得到相應蛋白濃度(C), 將該值代入公式1計算樣品中殘留蛋白的量, 結果見表 2。
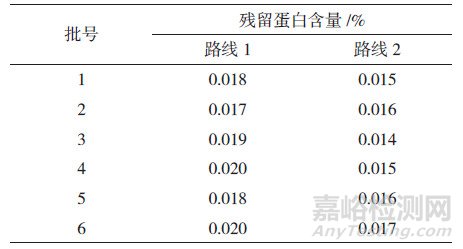
表 2 采用2種樣品前處理方式測定得到的阿莫西林中殘留蛋白含量
3 討論
3.1 樣品超濾前處理條件摸索與考察
由于樣品中殘留蛋白含量低, 為增加檢出效率, 實驗盡可能配制高濃度供試品溶液。由于阿莫西林原料為阿莫西林酸的形式, 無法溶于水, 根據生產工藝并結合實驗考察, 采用4% Na2CO3溶液作為溶劑可較好地溶解阿莫西林酸制備高濃度供試液。但高濃度阿莫西林(100 µg·mL-1)和4% Na2CO3均會明顯使Bradford試劑變藍, 干擾測定。因此, 實驗采用超濾法對樣品中殘留蛋白進行濃縮富集并對溶液進行脫鹽置換。
實驗考察了不同濃度的阿莫西林供試液和不同濃度的Na2CO3溶液對Bradford試劑的影響。分別對100 mg·mL-1阿莫西林供試液和4% Na2CO3溶液按10倍比的稀釋因子(1:10、1:102、1:103、1:104和1:105)逐級進行稀釋, 然后按"2.3"節下方法測定各溶液吸光度, 同時以水作為空白進行對比。結果顯示, 起始溶液100 mg·mL-1阿莫西林供試液和4% Na2CO3溶液會導致Bradford試劑明顯變藍(A>0.5), 隨著2種溶液不斷稀釋, 溶液濃度不斷降低, 其對Bradford試劑的影響均逐漸下降。當4% Na2CO3溶液稀釋10倍(0.4%, 圖 3A虛線所示)、阿莫西林供試液稀釋103倍(此時溶液中阿莫西林濃度為0.1 mg·mL-1, Na2CO3濃度為0.004%, 圖 3B虛線所示)時, 兩者的吸光度值幾乎與水相當, 認為已無干擾。上述實驗結果可以看出, 阿莫西林對Bradford試劑的影響要明顯大于Na2CO3溶液對Bradford試劑的影響, 是超濾前處理步驟設計中應考慮的主要影響因素。

圖 3 4% Na2CO3溶液和阿莫西林供試液不同稀釋因子吸光度曲線圖
以此實驗結果為依據, 設計超濾前處理步驟, 離心力采用5000 g(超濾管推薦最大離心力), 稀釋劑選擇0.04% Na2CO3溶液(超濾管推薦Na2CO3溶液濃度應≤20%), 取阿莫西林供試液5 mL置超濾管, 依次進行離心和溶液稀釋置換處理, 具體見圖 2中路線1。當進行3次離心超濾后, 供試液中阿莫西林濃度降至0.1 mg·mL-1, 同時溶劑基本置換為0.04% Na2CO3, 兩者均對后續Bradford法測定不產生干擾, 而此時溶液中殘留蛋白的含量濃縮了5倍(相當于富集500 mg阿莫西林中殘留蛋白的量)。因此, 實驗采用路線1作為供試液超濾前處理方法。
3.2 超濾前處理法的準確性與應用探討
實驗通過對不同BSA溶液的回收率考察超濾膜的截留效率。結果顯示, 對BSA水溶液進行單次離心超濾, 回收率>96%;當進行3次離心超濾, 回收率>90%, 表明超濾膜對BSA水溶液的截留效率較高。考慮堿液和抗生素可能對超濾膜材質產生影響, 進而降低截留效率, 實驗進一步考察發現, 當采用4% Na2CO3溶液作為溶劑配制BSA溶液時, BSA回收率降低至80%~90%;而BSA在阿莫西林供試液中的加樣回收實驗結果顯示, 回收率進一步降低為70%~80%, 提示Na2CO3和阿莫西林會對超濾膜材質產生影響, 在一定范圍內降低其對大分子物質的截留效率, 離心步驟(次數)越多, 會導致回收率偏低, 影響超濾提取的準確性。
為進一步考察上述實際影響, 實驗在采用路線1對樣品進行前處理的基礎上, 增加了超濾前處理步驟, 還采用圖 2中路線2同時平行對6批樣品的供試液進行超濾前處理, 然后分別收集5次離心步驟所得的下層溶液(圖 2中下層溶液1~5), 按"2.3"節下方法測定各溶液吸光度值, 結果顯示, 隨著超濾不斷進行, 下層溶液的吸光度曲線不斷降低, 當經過第三次離心超濾前處理后(圖 4A虛線所示), 下層溶液3的吸光度值基本與空白稀釋劑(0.04% Na2CO3)的吸光度值一致; 隨著超濾進一步進行, 后續步驟下層溶液4和5的吸光度曲線與空白稀釋劑吸光度曲線基本平行(圖 4), 提示當超濾完成3次離心處理后, 已能達到溶液凈化、蛋白濃縮的目的。對2種路線樣品超濾前處理后最終所得上層待測液進行測定, 結果顯示, 路線1測得樣品中殘留蛋白的含量略高于路線2, 表明超濾步驟過多會使樣品中蛋白富集產生一定損失, 影響超濾前處理的準確性。因此, 實驗最終采用路線1 (圖 2)作為超濾前處理條件, 既保證了測定準確性, 又提高了實驗效率。
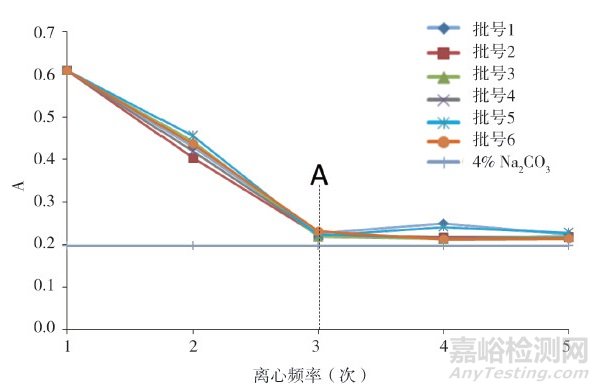
圖 4 6批阿莫西林供試液離心下層液吸光度曲線圖
相比較于其它前處理方法(如GFC法), 超濾法具有對儀器要求低、操作簡便、濃縮富集量大等優點。對于GFC法, 當對200 mg樣品中的殘留蛋白進行富集時, 需要進樣4次(60 min·次-1·批-1, 上樣量500 µL), 而超濾法一次處理即可同時實現對6批供試品中相當于500 mg樣品中的殘留蛋白量進行富集, 大大提高了實驗效率。此外, 超濾法得到的濃縮液可直接用于測定, 無需經凍干、復溶等步驟處理, 且殘留蛋白不經過液態-固態-液態的形式轉變, 不對蛋白自身結構產生影響。但值得注意的是, 目前市售商品化超濾管基本為水溶性濾膜, 對含有機溶劑(或有機相比例較高)的溶液不耐受, 因此, 超濾法僅適用于水溶性樣品中殘留蛋白的富集。
參考文獻
[1] 陳立平. 淺析西藥阿莫西林的藥理作用機制以及臨床應用[J]. 中國衛生標準管理, 2016, 7(18): 83-84.
[2] 再曼, 王虎. 西藥阿莫西林的藥理作用機制以及臨床應用[J]. 世界最新醫學信息文摘, 2015, 15(81): 112-113. DOI:10.3969/j.issn.1671-3141.2015.81.084
[3] Bruggink A, Roos E C, De Vroom E. Penicillin Acylase in the Industrial Production of β-lactam Antibiotics[J]. Org Process Res Dev, 1998, 2(2): 128-133. DOI:10.1021/op9700643
[4] Moellering R C. Past, Present and Future of Antimicrobial Agents[J]. Am J Med, 1995, 99(6): 11-18. DOI:10.1016/S0002-9343(99)80279-4
[5] Schnyder B, Brockow K. Pathogenesis of Drug AllergyCurrent Concepts and Recent Insights[J]. Clin Exp Allergy, 2015, 45(9): 1376-1383. DOI:10.1111/cea.12591
[6] 胡昌勤. 抗菌藥中高分子雜質的特性及抗菌藥過敏反應(上)[J]. 中國藥師, 2006, 9(3): 238-240. DOI:10.3969/j.issn.1008-049X.2006.03.020
[7] European Medicines Agency (EMA). Guideline on Setting Specifications for Related Impurities in Antibiotics[EB/OL]. London: EMA, 2012[2019-08-11]. http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/general/general_content_000736.jsp&mid=WC0b01ac0580028e8c. http://en.cnki.com.cn/CJFD_en_New/Detail.ashx?t=e&url=/Article_en/CJFDTOTAL-YWPJ201102030.htm
[8] European Medicines Agency (EMA). Guideline on Summary of Requirements for Active Substances in the Quality Part of the Dossier[EB/OL]. London: EMA, 2005[2019-08-11]. https://www.ema.europa.eu/documents/scientific-guideline/guideline-summary-requirements-active-substancesquality-part-dossier-revision-1_en.pdf.
[9] Products of Fermentation[S]//European Pharmacopoeia: 9th Edition, 2017: 830-831.
[10] 周躍男, 王湛, 趙小川, 等. 淺談蛋白質的定量檢測方法[J]. 食品研究與開發, 2014, 4(35): 127-130.
[11] Total Protein[S]//European Pharmacopoeia: 9th Edition, 2017: 172-175.
[12] Bradford M M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-dye Binding[J]. Anal Biochem, 1976, 72(1-2): 248-254. DOI:10.1016/0003-2697(76)90527-3
[13] Chutipongtanate S, Watcharatanyatip K, Homvises T, et al. Systematic Comparisons of Various Spectrophotometric and Colorimetric Methods to Measure Concentrations of Protein, Peptide and Amino Acid:Detectable Limits, Linear Dynamic Ranges, Interferences, Practicality and Unit Costs[J]. Talanta, 2012, 98: 123-129. DOI:10.1016/j.talanta.2012.06.058
[14] Xu M Z, Ma S H, Hu C Q. Gel Filtration Chromatography Combined with Bradford Method for Determination of Total Residual Protein in Ferment Antibiotics[J]. J Chin Pharm Sci, 2004, 13(4): 262-266.
[15] 詹麗娜, 陳沁, 古淑青, 等. 超高效液相色譜-四極桿/靜電場軌道阱高分辨質譜檢測食品中的牛奶過敏原酪蛋白[J]. 色譜, 2017, 35(4): 405-412.
[16] 徐陳鳳, 惠文凱, 孫莉莉, 等. 基于超濾離心前處理的液相色譜-串聯質譜法手性拆分人血漿中的亞葉酸和5-甲基四氫葉酸非對映異構體及其藥代動力學應用[J]. 色譜, 2019, 6(37): 581-588.
[17] 鞠玲燕, 宋曉華, 谷婕, 等. 超濾管凈化/高效液相色譜-串聯質譜法測定動物源食品中喹諾酮類藥物殘留[J]. 分析測試學報, 2016, 35(1): 42-47. DOI:10.3969/j.issn.1004-4957.2016.01.007
[18] 許麗珠, 李秀英, 黃金鳳, 等. 超濾離心凈化-高效液相色譜法同時測定配方乳粉中的單糖、雙糖和低聚果糖[J]. 食品安全質量檢測學報, 2015, 6(2): 633-638.
[19] Duggleby H J, Tolley S P, Hill C P, et al. Penicillin Acylase Ihas a Single-amino-acid Catalytic Centre[J]. Nature, 1995, 373(6511): 264-268. DOI:10.1038/373264a0

來源:xml-data


