您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2019-12-04 14:40
1997年1月1日批準雌二醇貼劑以來,一共批準628個批準文號,涉及114個活性成分(包括中藥),總體來看,貼劑上市的數量不多,屬于較為偏門的劑型。近年來隨著一致性評價政策和藥品集中采購等政策實施,國家越來越重視藥物的差異化,關注藥物的合理運用,促進了國內企業對貼劑的研發熱度,如何快速立項貼劑,進入該領域是值得思考的問題。
貼劑的仿制藥立項
目前國內上市的化藥貼劑的有效批文有72個,涉及36個活性成分,可供仿制的品種不多。自從實施“帶量采購”的相關政策后,取消了藥物中間商的差價,藥品的銷量直接由采購量決定,故企業在立項時更多的關注藥品的競爭程度,同時原研品是否進入國內市場,在很大程度上市也影響著仿制藥的開發難易程度,根據上述情況,分為如下兩類情況進行分析。
1 國內未上市的仿制藥,包括原研品
這類產品競爭程度最小,一旦仿制上市幾乎獨占市場,但在仿制方面也有一定的難度:
信息方面,由于原研品未在國內上市,一般的企業難以獲得全面的信息,有一定的開發難度,列如用于治療凝血異常的纖維蛋白貼劑,由EthiconBioSurgery公司開發,由于纖維蛋白的信息較少,具有一定仿制難度;
臨床方面,由于人種(針對白人和黑人)的差異,臨床結果存在有許多不確定因素;
市場方面,隨著原研公司越來越重視國內市場,在國外銷售較好的產品均會考慮在國內上市銷售,剩余的未在國內上市的產品的市場潛力值得商榷;
用藥習慣方面,國外貼劑上市時間長治療領域廣,很多領域在國內還沒有貼劑的產品,在國內不一定能夠接受,例如用于治療偏頭痛的琥珀酸舒馬普坦貼劑以及用于治療精神分類的的阿塞那平貼劑,在國內均沒有廠家申報,競爭較小,但是這兩個治療領域在國內還沒貼劑產品,其用藥習慣是否得到認可還需進一步討論。
當然,根據企業自身的實力以及產品的具體特點進行分析,這類產品一旦成功立項,帶來的收益也是非同小可的。
2 原研在國內上市,但是還沒有本土企業上市的產品
原研品在國內已經上市,從某種程度上來說,原研公司已經確認產品在國內的市場價值,在市場容量和臨床方面均有一定的優勢,同時其信息較為全面和透明,開發難度不大。這對于中小型企業來說,是較為理想的產品。在已經上市的36個活性成分中,有9個品種符合當前的條件,具體如下:
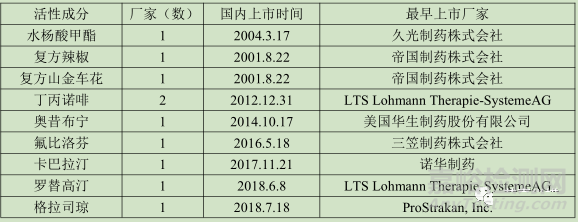
這9個活性成分在國內均有貼劑上市,其中奧昔布寧、卡巴拉汀、羅替高汀、格拉司瓊、氟比洛芬等均是近年來上市產品,目前還沒有本土企業上市,具有較大的仿制空間。
奧昔布寧由Watson Laboratories, Inc.公司于2014年進口國內上市,其適應癥為膀胱過度活躍、尿頻、尿急、神經源性尿失禁、自發性逼尿肌不穩定和夜遺尿,生物利用度只有6%,半衰期為2-3小時。相對于國內上市的片劑、膠囊、口服液而言,貼劑通過皮膚給藥能夠延長藥物的治療時間;通過皮膚直接進入血液,能夠避免首過效應,提高藥物的生物利用度;最后對于兒童而言,貼劑在順應性方面要優于口服制劑,故奧昔布寧貼劑更加的符合當前的藥物使用,能夠順應國家目前的相關政策,具有較大的開發價值。
卡巴拉汀貼劑(利斯的明透皮貼)是由諾華制藥開發,用于治療輕中度阿爾茨海默病,該病主要集中在老年人,尤其是患有阿爾茨海默病的老年人在吞服方面具有較大困難,開發成貼劑在用藥方面具有顯著的提高,同理羅替高汀也具有同樣的優勢。
丁丙諾啡為為阿片受體部分激動劑。鎮痛作用強于哌替啶,起效慢,持續時間長。國內的貼劑大部分集中在鎮痛抗炎方面,類似的芬太尼透皮貼已在國內上市多年,得到社會的認可,故丁丙諾啡的貼劑上市也能帶來一定的市場。
氟比洛芬為國內優秀的非甾體抗炎藥,其療效和安全性已經得到社會認可,其在國內有注射劑、片劑、緩釋片等劑型上市,貼劑在很大程度上帶來使用的便利性,尤其是在治療類風濕性關節炎方面,采用貼劑能起到更好的靶向效果,該品種與2017年銷售額達到6億,具有非常大的市場空間。
格拉司瓊最初是由英國 Beecham公司開發于80年代中期。用于放于放射治療、細胞毒素類藥物引起的惡心和嘔吐。化療、放療引起的惡心嘔吐一直是令醫生和患者煩惱的嚴重副作用之一,目前司瓊類的藥物已經占據了止吐藥的大部分市場。格拉司瓊目前上市的有膠囊、口崩片、注射劑三種劑型,通過皮膚給藥不僅給患者使用帶來方便,在毒副作用方面還具有顯著效果,具有較大的市場空間。
貼劑的改良型新藥立項分析
貼劑通過經皮吸收,藥物必須具有非常好的透皮效果,而且對劑量、適應癥、用法用量等具有較嚴的要求,再加上近年來對于新藥的臨床優勢看得越來越重,沒有明顯的臨床效果,單純的改變劑型也不一定能夠得到藥審中心的認可,故貼劑的新藥開發難度較大。自2016年重新劃分化學藥品注冊分類以來,一共有四個貼劑新藥品種,均為改良型新藥,具體如下:
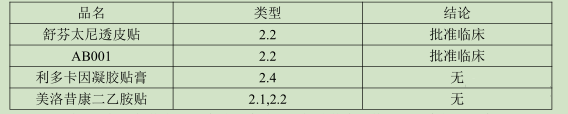
從上述結果分析,舒芬太尼透皮貼透皮貼已經批準臨床,其改進程度得到國家局認可。舒芬太尼鎮痛作用強,但是持續時間短,其有一定成癮性,開發成貼劑能夠延長其鎮痛時間,還能減少一定的副作用。這也反映出,開發出貼劑的新藥,除了劑型本身優勢外,如果在療效、毒副作用等方面有一定的改善那么得到認可機會比較大。
AB001目前沒有獲得其活性成分,利多卡因凝膠貼膏主要是增加新的適應癥,其審評尺度大多借助于新的適應癥方面,劑型改變所做的貢獻比例較小。
美洛昔康二乙胺是在美洛昔康基礎上進一步成鹽,形成新的化合物,但是沒有改變原來活性成分的療效,成鹽后能夠增加原活性成分的水溶性。在藥效、毒理方面是否有進一步作用未查到相關資料。根據其審評進度來看,于2019年9月18日完成相補充資料審評,是否批準臨床暫時未知。
綜上所述,從上述已經申報的4個改良型新藥分析,僅僅改變給藥途徑不一定會得到國家局的認可,但是在療效和毒理方面有進一步改善,那又另當別論。當然上述結論只是根據已經申報的四個改良型新藥分析得到,數據相對較少,且均沒有實現最終生產,目前下的結論可能會有所偏差,企業在立項時還需要進一步分析。
結 語
近年來貼劑越來越受到重視,國內很多企業將研發方向定在這一方面。然而在技術工藝、制備設備以及輔料組成方面與國外具有較大的差異,在立項貼劑過程中,也需要考慮這方面問題;對于貼劑新藥的開發,不僅需要考慮劑型的合理性,還需要考慮在臨床方面的優勢。最后,隨著國內的相關政策不斷實施以及患者用藥觀念的轉變,相信貼劑使用越來越廣,故立足于貼劑開發有利于企業發展。

來源:藥事縱橫xinyang


