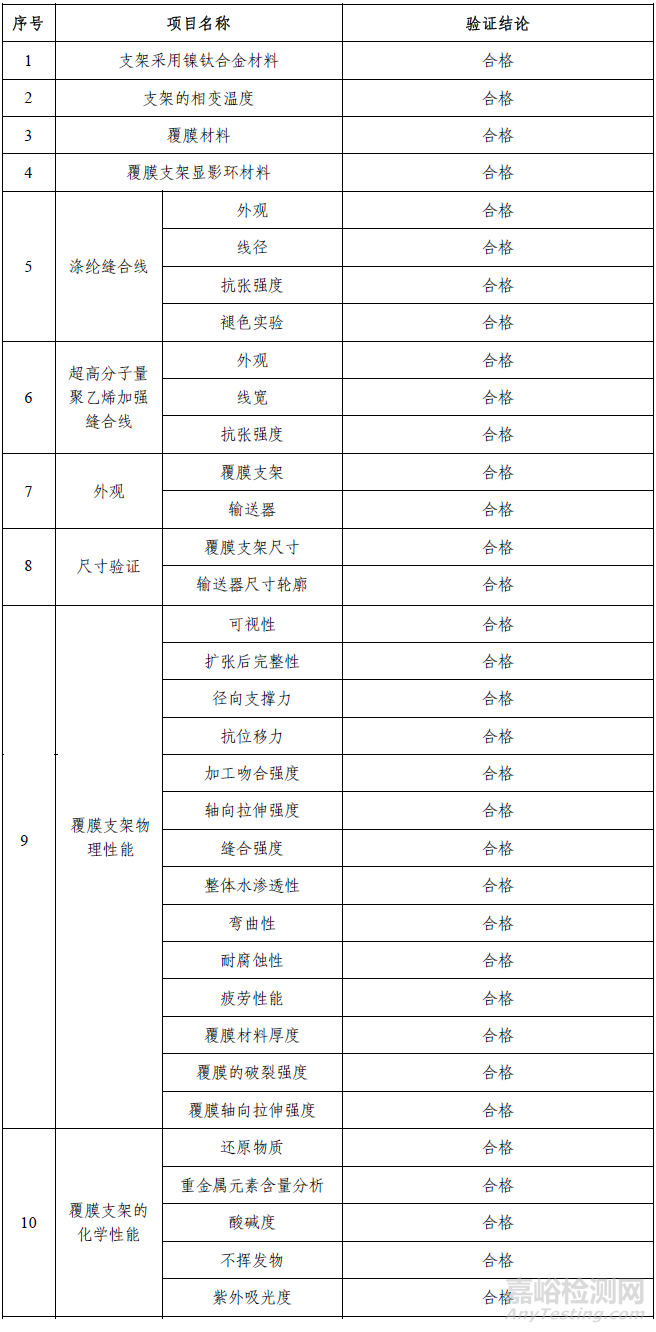
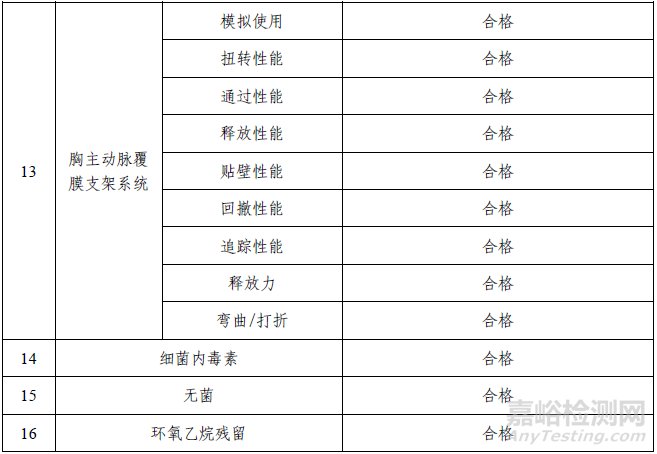
2. 產(chǎn)品性能評(píng)價(jià)
產(chǎn)品性能評(píng)價(jià)包括有限元分析、核磁兼容性(MRI)、釋放后止血性、釋放后精準(zhǔn)性、近端密封性、2-氯乙醇?xì)埩袅康妊芯浚Y(jié)果表明產(chǎn)品符合設(shè)計(jì)輸入要求。
(二)生物相容性
該產(chǎn)品包括覆膜支架和輸送器兩個(gè)部分,其中覆膜支架為植入器械,與人體循環(huán)血液長(zhǎng)期接觸;輸送器為外部接入器械, 與循環(huán)血液短期接觸。申請(qǐng)人按照 GB/T 16886 系列標(biāo)準(zhǔn)進(jìn)行了生物相容性評(píng)價(jià),覆膜支架部件的生物學(xué)評(píng)價(jià)資料主要涉及細(xì)胞毒性、遲發(fā)型超敏反應(yīng)、皮內(nèi)反應(yīng)、急性和亞慢性全身毒性、植入、溶血、凝血、血栓形成、遺傳毒性試驗(yàn)等的生物學(xué)試驗(yàn)報(bào)告;輸送器部分的生物學(xué)評(píng)價(jià)資料涉及細(xì)胞毒性、遲發(fā)型超敏反應(yīng)、皮內(nèi)反應(yīng)、急性全身毒性、溶血、凝血、血栓形成的生物學(xué)試驗(yàn)報(bào)告。產(chǎn)品的生物相容性風(fēng)險(xiǎn)可接受。
(三)滅菌
該產(chǎn)品采用環(huán)氧乙烷滅菌,無(wú)菌狀態(tài)提供。申請(qǐng)人提供滅菌確認(rèn)報(bào)告,證明無(wú)菌保證水平為 10-6,環(huán)氧乙烷殘留量 不大于 10μg/g 。
(四)產(chǎn)品有效期和包裝
該產(chǎn)品貨架有效期為三年。申請(qǐng)人提供了貨架有效期驗(yàn)證報(bào)告。驗(yàn)證實(shí)驗(yàn)為加速老化和實(shí)時(shí)老化,包括產(chǎn)品穩(wěn)定性和包裝完整性。
(五)動(dòng)物研究
申請(qǐng)人開(kāi)展了羊模型的動(dòng)物實(shí)驗(yàn)研究以評(píng)價(jià)產(chǎn)品的使用性能和安全有效性。該實(shí)驗(yàn)分為兩組,分別為28天和180天存活實(shí)驗(yàn),每組實(shí)驗(yàn)使用動(dòng)物數(shù)量為6只,在植入即刻和實(shí)驗(yàn)終點(diǎn)分別進(jìn)行觀察,評(píng)估手術(shù)過(guò)程和治療效果等。評(píng)價(jià)指標(biāo)包括:
? 輸送器可操作性: 評(píng)價(jià)輸送器到達(dá)目標(biāo)位置的能力;評(píng)價(jià)輸送器的操作性和可視性以及植入支架的可視性;評(píng)價(jià)輸送器釋放的準(zhǔn)確性和有效性;評(píng)價(jià)輸送器的回撤能力;評(píng)價(jià)輸送器的止血性;
? 覆膜支架安全性:評(píng)價(jià)覆膜支架植入后和取出時(shí)(28天,180天)的定位性、結(jié)構(gòu)和材料的完整性以及功能性;評(píng)價(jià)取出的覆膜支架(植入物)和相關(guān)組織/器官的組織學(xué)和病理學(xué);
? 覆膜支架有效性:觀察血管閉塞率和支架所覆蓋部分的通暢率。
動(dòng)物實(shí)驗(yàn)結(jié)論為實(shí)驗(yàn)動(dòng)物術(shù)后恢復(fù)正常,手術(shù)切口完整,無(wú)發(fā)炎及感染現(xiàn)象發(fā)生,傷口愈合良好,生存健康。胸主動(dòng)脈覆膜支架系統(tǒng)在手術(shù)過(guò)程中定位準(zhǔn)確,材料可視性好,植入后釋放穩(wěn)定性好。植入的支架與血管結(jié)合緊密,支架內(nèi)壁組織光滑,和支架結(jié)合部分的內(nèi)皮組織無(wú)病變,無(wú)明顯有腫脹及有腫脹引起的相關(guān)損傷或炎癥,沒(méi)有巨細(xì)胞或肉芽腫跡象。動(dòng)物實(shí)驗(yàn)評(píng)價(jià)表明產(chǎn)品達(dá)到預(yù)期設(shè)計(jì)要求。
三、臨床評(píng)價(jià)摘要
該產(chǎn)品以臨床試驗(yàn)方式進(jìn)行臨床評(píng)價(jià),為多中心、同期平行對(duì)照、非劣效設(shè)計(jì)。對(duì)照產(chǎn)品為胸主覆膜支架及輸送系統(tǒng)(國(guó)械注進(jìn)20143465591)。
本項(xiàng)臨床試驗(yàn)的主要臨床有效終點(diǎn)定義為成功治療動(dòng)脈夾層的受試者占所有隨訪受試者的百分比,試驗(yàn)組的治療成功率與對(duì)照組的治療成功率做出統(tǒng)計(jì)學(xué)比較。
成功治療動(dòng)脈夾層是一個(gè)復(fù)合臨床指標(biāo),該指標(biāo)包含:
? 手術(shù)成功部分:輸送系統(tǒng)導(dǎo)入順利,覆膜支架準(zhǔn)確定位和釋放,輸送系統(tǒng)安全回撤。覆膜支架形態(tài)正常,無(wú)扭曲、打折、狹窄及閉塞,術(shù)后即刻血管造影顯示覆膜支架通暢,無(wú)覆膜破裂,無(wú)導(dǎo)入血管破裂,無(wú)夾層破裂。
? 治療成功部分:術(shù)后12個(gè)月時(shí)假腔血栓化;12個(gè)月時(shí)無(wú) I 型和 III 型內(nèi)漏;12個(gè)月時(shí)無(wú)因覆膜支架引起的新發(fā)夾層破口;12個(gè)月時(shí)無(wú)因覆膜支架覆蓋處異常所致的轉(zhuǎn)為開(kāi)放手術(shù);和12個(gè)月時(shí)覆膜支架無(wú)移位 (位移≤10mm)。
在主要臨床終點(diǎn)的基礎(chǔ)上,作為次要臨床終點(diǎn)評(píng)價(jià):覆膜支架在植入30天內(nèi)和6個(gè)月及12個(gè)月時(shí)的內(nèi)漏情況;術(shù)后12個(gè)月時(shí)覆膜支架移位情況;12個(gè)月時(shí)覆膜支架通暢性; 12個(gè)月時(shí)疾病相關(guān)二次治療的情況;12個(gè)月時(shí)疾病相關(guān)死亡;12個(gè)月時(shí)的全因死亡和12個(gè)月時(shí)的主要不良事件。
臨床安全性指標(biāo)為植入覆膜支架后在圍手術(shù)期內(nèi)(0-30天)臨床主要不良事件(Major Adverse Events,MAEs),包括全因死亡、消化道出血、心肌梗塞、截癱、手術(shù)中失血≥1000 cc、腎衰竭、呼吸衰竭、腦卒中(中風(fēng))和移植物感染等。
該臨床試驗(yàn)在10家臨床機(jī)構(gòu)開(kāi)展,中國(guó)人民解放軍總醫(yī)院為組長(zhǎng)單位。臨床試驗(yàn)實(shí)際入組患者166例,其中試驗(yàn)組81例,對(duì)照組85例。全分析集(FAS)人群為164例,其中試驗(yàn)組80例,對(duì)照組84例;符合方案分析集(PPS) 人群為156例,其中試驗(yàn)組76例,對(duì)照組80例;安全集(SS) 為166例,其中試驗(yàn)組81例,對(duì)照組85例。
FAS集對(duì)于未能觀察到全部療效評(píng)價(jià)的受試者,按最差原則即治療失敗原則進(jìn)行數(shù)據(jù)結(jié)轉(zhuǎn),治療成功率差值及 95%CI 為 8.04%[-1.1%,17.2%]; PPS 集治療成功率差值及 95%CI 為8.68%[-1.6%,15.7%],下限大于預(yù)先設(shè)定的非劣效值-10%,試驗(yàn)組非劣效于對(duì)照組(表3)。
表3 臨床試驗(yàn)主要有效性評(píng)價(jià)指標(biāo)結(jié)果
有效性評(píng)價(jià)指標(biāo)詳見(jiàn)表 4。
臨床安全性評(píng)價(jià)指標(biāo)詳見(jiàn)表5。死亡、心肌梗死、截癱、術(shù)中出血、腦卒中等不良事件組間無(wú)統(tǒng)計(jì)學(xué)差異。
表5 臨床試驗(yàn)安全性評(píng)價(jià)指標(biāo)
不良事件發(fā)生情況如表6所示,試驗(yàn)組和對(duì)照組間無(wú)統(tǒng)計(jì)學(xué)差異,與器械相關(guān)性分析結(jié)果為試驗(yàn)組和對(duì)照組間無(wú)統(tǒng)計(jì)學(xué)差異。
表6 不良事件總體情況
四、風(fēng)險(xiǎn)分析及說(shuō)明書(shū)提示
參照《YY/T 0316-2016 醫(yī)療器械風(fēng)險(xiǎn)管理對(duì)醫(yī)療器械的 應(yīng)用》,對(duì)該產(chǎn)品進(jìn)行風(fēng)險(xiǎn)分析。對(duì)目前已知及可預(yù)測(cè)風(fēng)險(xiǎn) 采取了風(fēng)險(xiǎn)控制措施,經(jīng)綜合評(píng)價(jià),在目前認(rèn)知水平上,認(rèn)為該產(chǎn)品上市帶來(lái)的獲益/受益大于風(fēng)險(xiǎn)。為保證用械安全,需在說(shuō)明書(shū)中提示以下信息:
(一)明確的產(chǎn)品適用范圍
(二)警示及注意事項(xiàng)
1.在使用之前,請(qǐng)仔細(xì)檢查產(chǎn)品包裝是否有損壞或缺陷,如有則不得使用。
2.使用前,如觀察到產(chǎn)品有損壞的跡象,請(qǐng)勿使用。
3.使用前查看產(chǎn)品有效期,過(guò)期請(qǐng)勿使用。
4.本產(chǎn)品出廠前已經(jīng)進(jìn)行了環(huán)氧乙烷滅菌,出廠時(shí)以無(wú)菌狀態(tài)提供,僅供一次性使用。使用之后,輸送器部分請(qǐng)根據(jù)醫(yī)院、管理部門和/或政府的相關(guān)政策進(jìn)行處理,不要重新消毒。
5.胸主動(dòng)脈覆膜支架系統(tǒng)不適用于對(duì)不銹鋼、有硫酸鋇填充劑的聚醚嵌段酰胺(PEBAX)、聚碳酸酯(PC)、丙烯晴-丁二烯-苯乙烯(ABS)、鎳鈦合金、鉑金或黃金有過(guò)敏史的患者。
6.該系統(tǒng)僅由受過(guò)血管介入治療培訓(xùn)的醫(yī)生及其治療小組使用。
7.醫(yī)院要設(shè)有血管外科手術(shù)組在需要轉(zhuǎn)為開(kāi)放手術(shù)時(shí)能進(jìn)行血管修復(fù)。
8.在操作器械及進(jìn)行輸送的過(guò)程應(yīng)小心,防止血管破裂。
9.根據(jù)血管內(nèi)徑和形態(tài)選擇合適的血管通路以及覆膜支架的規(guī)格;如果血管嚴(yán)重鈣化,狹窄,曲折或血栓,會(huì)增加血管損傷和栓塞可能。
10.動(dòng)脈的固定部位如有環(huán)形的血栓和/或鈣化、不規(guī)則的鈣化和/或斑塊,可能會(huì)影響覆膜支架的貼壁和封閉。錨定區(qū)如果有以上這些情況,可能導(dǎo)致覆膜支架的移位。
11.過(guò)長(zhǎng)的覆膜支架植入后由于覆蓋了部分脊柱動(dòng)脈或腰動(dòng)脈的供血,患者截癱的危險(xiǎn)可能會(huì)增加。
12.使用胸主動(dòng)脈覆膜支架系統(tǒng)需要熒光X射線透視影像輔助,體重過(guò)重妨礙到透視影像準(zhǔn)確性的患者不建議使用。
13.使用胸主動(dòng)脈覆膜支架系統(tǒng)需要使用放射顯影劑。有腎功能不全的患者術(shù)后發(fā)生腎功能衰竭的風(fēng)險(xiǎn)可能會(huì)增加。
14.患者必須定期進(jìn)行影像檢查,以評(píng)估胸主動(dòng)脈覆膜支架和血管的情況。若出現(xiàn)血液持續(xù)流入假腔等癥狀,應(yīng)考慮進(jìn)行其他治療,包括血管內(nèi)治療或轉(zhuǎn)外科開(kāi)放手術(shù)。
15.在打開(kāi)器械包裝前,應(yīng)對(duì)手術(shù)通路和器械的放置做好術(shù)前計(jì)劃。
16.在植入前,不要彎曲或扭結(jié)胸主動(dòng)脈覆膜支架系統(tǒng),因?yàn)檫@可能會(huì)造成覆膜支架釋放困難。
17.為防止出現(xiàn)血栓,在使用本器械前,應(yīng)進(jìn)行額外的抗凝劑注射。
18.要始終通過(guò)透視影像來(lái)推進(jìn)胸主動(dòng)脈覆膜支架系統(tǒng)。在推進(jìn)或撤出胸主動(dòng)脈覆膜支架系統(tǒng)的過(guò)程中遇到阻力時(shí),不要過(guò)度用力。
19.不要在導(dǎo)向頭沒(méi)有反應(yīng)的情況下持續(xù)轉(zhuǎn)動(dòng)輸送器。
20.在狹窄、血管內(nèi)血栓形成區(qū)域或鈣化迂曲的血管內(nèi)進(jìn)行操作時(shí)要特別小心。
21.始終在X射線透視下監(jiān)控植入操作,如果在插入過(guò)程中胸主動(dòng)脈覆膜支架系統(tǒng)發(fā)生打折,不要試圖釋放覆膜支架,應(yīng)撤出此系統(tǒng),重新更換新的產(chǎn)品。
22.覆膜支架部分展開(kāi)后不能嘗試回收覆膜支架。
23.如果胸主動(dòng)脈覆膜支架系統(tǒng)外管意外縮回,覆膜支架將提前展開(kāi),這可能導(dǎo)致釋放位置錯(cuò)誤。
24.錯(cuò)誤的放置會(huì)造成內(nèi)漏或閉塞,會(huì)增加手術(shù)摘除覆膜支架的可能性。
25.當(dāng)使用手柄快速釋放覆膜支架時(shí),一定要穩(wěn)定住輸送器。在此步驟中不要旋轉(zhuǎn)輸送器外殼和手柄。
26.由于覆膜支架的彈性和設(shè)計(jì)本身的特性,覆膜支架釋放過(guò)程或扭曲的解剖結(jié)構(gòu)所引發(fā)的器械壓縮可能會(huì)使每個(gè)覆膜支架的總長(zhǎng)度比預(yù)期長(zhǎng)度略短。
27.當(dāng)覆膜支架的尺寸較血管直徑的超出量過(guò)大時(shí),血管會(huì)過(guò)度膨脹并造成損傷。
28.當(dāng)覆膜支架的尺寸較血管直徑的超出量過(guò)小時(shí),則會(huì)增加內(nèi)漏的危險(xiǎn)。
(三)禁忌癥
對(duì)胸主動(dòng)脈覆膜支架系統(tǒng)使用的材料過(guò)敏和有全身感染的患者不能使用本產(chǎn)品。
綜合評(píng)價(jià)意見(jiàn)
本申報(bào)產(chǎn)品屬優(yōu)先審批項(xiàng)目,編號(hào)20170008。申請(qǐng)人的注冊(cè)申報(bào)資料符合現(xiàn)行要求,依據(jù)《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國(guó)務(wù)院令第680號(hào))、《醫(yī)療器械注冊(cè)管理辦法》(國(guó)家食品藥品管理總局令2014年第4號(hào))等相關(guān)醫(yī)療器械法規(guī)與配套規(guī)章,經(jīng)系統(tǒng)評(píng)價(jià)后,建議準(zhǔn)予注冊(cè)。