您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2018-07-11 10:37
介紹
在2009年,據Tamilvanan學者的統計,有接近50%的新型藥物在水中溶解度較低,導致藥物生物利用度差和控制釋放難題。為了解決這些困難,研發人員將脂質分散體系作為載體系統使用,如脂質乳劑、脂質體。在2008年的一篇研究中,學者Porter將流感活疫苗親脂性藥物分散在乳劑中,發現乳液藥物產生了更高的生物利用度,吸引了大量學者的特別關注。
亞微乳劑是一種特別有趣的藥物輸送系統,由于其生物相容性,生物降解性、易于大規模制備,大的表面積,和經證實的穩定能力,能夠在一定時間內避免上浮和沉淀現象(Tamilvanan,2004)。
傳統上,磷脂被用作亞微乳劑的表面活性劑,用于藥物運輸。然而,口服的磷脂基穩定的乳液會很快的被十二指腸中的膽汁鹽所替代(Torcello-Gómez et al., 2011),造成破乳。另外,如果這些乳劑由靜脈注射進入體內,根據膠體異物特性的不同,乳液將很快被單核吞噬細胞系統(MPS)消除。在這兩種情況下,使用磷脂作為唯一的表面活性劑我們無法控制藥物的代謝和降解過程。所以,空間的聚合物非離子表面活性劑(PEO和PEG)被用于解決乳劑在口服和注射應用的問題。然而,對于這些表面活性劑是如何影響脂質載體系統的代謝過程的,依然缺乏了解。
靜態多重光散射技術(S-MLS)不僅可以測定乳劑的不穩定現象,也可以測試藥物制劑的降解過程。在本文中,使用Turbiscan多重光散射儀研究了乳液在模擬體內條件下的穩定性。
方法
材料
四種聚合物非離子表面活性劑
Sigma–Aldrich試劑公司的葵花籽油
葵花籽油濃度25%,表面活性劑加量1%
兩種測試條件
胃條件
十二指腸條件
測試方法
將配置好的乳液分別與胃液體和十二指腸液體混合,模擬體內條件。
將配置好的樣品裝入Turbiscan多重光散射儀進行測試。
結果與討論
在胃條件下
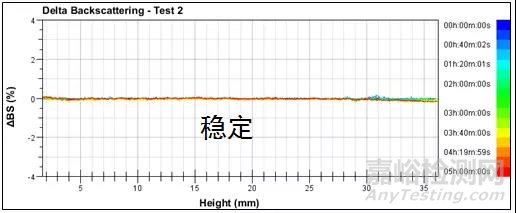
圖1 乳液在胃條件下的背散射光圖譜
Turbiscan多重光散射儀數據顯示,乳液在胃條件下,2h之內背散射光強度基本沒有變化(ΔBS<0.3%),說明乳液在胃條件下可以保持穩定,沒有絮凝和聚并現象,四種表面活性劑配制的乳液穩定性類似。這一結果與DLS測試的結果相對應,說明2h之內液滴粒徑沒有變化。因此,可以確定油滴可以保護這些藥物在嚴酷的胃條件下不被溶解,從而直達十二指腸被有效地吸收。
在十二指腸條件下
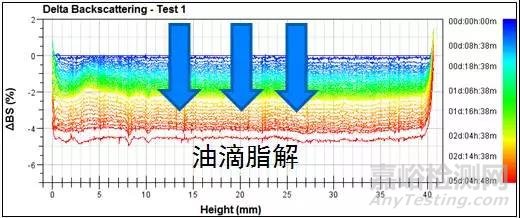
圖2 乳液在十二指腸條件下的背散射光圖譜
不同于胃條件,十二指腸中含有的脂肪酶可以將脂肪分解,在此條件下,乳液液滴會被逐漸分解。從圖中可見,隨著時間增加背散射光曲線出現整體的下降,說明乳液在十二指腸條件下乳液液滴開始出現脂解,藥物開始從液滴中被釋放出來。
脂解過程研究
為了對比4種不同表面活性劑形成乳劑的脂解速度和過程,繪制樣品的散射光強度隨時間的變化曲線:
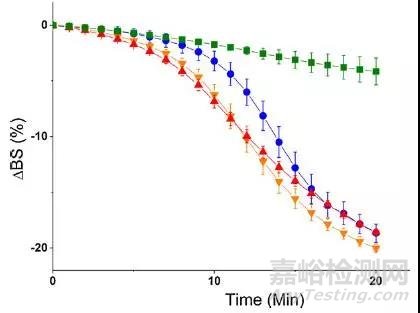
圖3 不同表面活性劑乳液在十二指腸條件下的背散射光變化曲線
四種表面活性劑由于分子結構中PEO鏈段長度的不同,脂解得速度也不盡相同。F127含有100個PEO鏈段,分解速度最為緩慢。M52僅具有40個PEO鏈段,分解速度最快,而F68具有75個PEO鏈段,分解速度居中。但是M52表面活性劑的結果就比較復雜了,M52同樣具有100個PEO鏈段,但是分解速度卻依然很快。這個現象不禁讓我們想到:聚合物非離子表面活性劑的分解機理,不僅僅只受到鏈段長短的影響,同樣與表面活性劑在界面上構筑的方式有關。
據前人研究,一個M52分子在界面上形成的覆蓋面積在0.4 至 1.2 nm2/molecule之間,而F68在3 and 3.4 nm2/molecule之間,而F127的覆蓋面積在 6.5–7.21nm2/molecule之間,暫無人報道M59在界面上的覆蓋面積。
為了研究活性劑的主導作用,將不同比例的F68和F127復配,發現僅僅1/4的F127與F68復配就可以達到與全部F127一樣的脂解速度。這說明長鏈的F127在脂解過程中對界面的分解起著重要的主導作用。
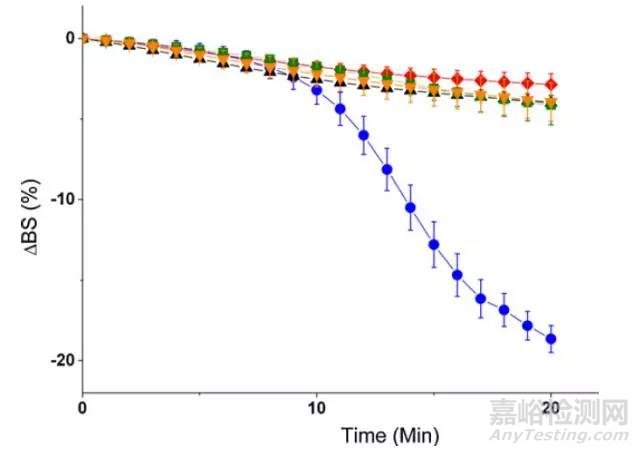
圖4 表面活性劑復配乳液在十二指腸條件下的背散射光變化曲線
結論
在本文中,我們研究了聚合物非離子表面活性劑對體內脂解過程的作用。通過模擬胃環境和十二指腸環境的測試,得知只要乳液穩定,藥物運輸過程就不會出現大的問題。
通過Turbiscan多重光散射儀研究藥物制劑的脂解過程,我們得知乳液液滴脂解的速度不僅與活性劑鏈段長度有關,也與活性劑的構筑方式相關。由此我們可以控制藥物在十二指腸中的釋放過程,例如,添加長分子鏈段的表面活性劑。另外,我們發現復配表面活性劑比例可以改變乳液在體內環境的脂解速度。這些研究結果給我們對于亞微米乳液的控制-釋放的合理設計具有重要意義。

來源: 朗迪森科技


