您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-08-16 20:47
摘要
生物藥物(biologics)近年來在全球范圍內迅速發展, 其分析技術涵蓋分子結構表征、純度與雜質分析、功能及穩定性評價等多個方面, 是確保生物藥物質量的關鍵。質量源于設計(quality by design, QbD)作為一種系統化方法, 在制藥行業中被廣泛應用于生產工藝的優化和確保最終產品的質量可靠性, 而基于QbD框架衍生發展的分析質量源于設計(analytical quality by design, AQbD)則為所開發的產品“分析方法”的質量賦予信心和提供保障。AQbD是以定義分析目標概況(analytical target profile, ATP)為起點, 通過風險評估識別和分析關鍵方法屬性(critical method attributes, CMAs)及關鍵方法參數(critical method parameters, CMPs), 并利用實驗設計(design of experiments, DoE)構建數學模型探索CMPs與CMAs之間的關系, 以建立方法參數的可操作設計區域(method operable design region, MODR)和分析方法控制策略。與基于傳統理念開發的分析方法相比, 基于AQbD理念開發的分析方法在MODR范圍內具有更高的穩健性, 能夠減少因分析方法所導致的超趨勢或不合格結果的產生, 從而實現監管靈活性并降低分析成本。本文綜述了AQbD的工作流程及其在生物藥物分析方法開發中的應用現狀, 并探討了該領域實施AQbD的機遇與挑戰。
關鍵詞
生物藥物; 分析方法開發; 分析質量源于設計; 分析目標概況; 可操作設計區域; 分析方法控制策略
生物藥物(biologics)是綜合運用生物學、生物化學、免疫學及現代藥學等原理與方法, 利用生物體、生物組織及其成分等生產的一類用于預防、診斷和治療疾病的制品。常見的生物藥物包括抗體藥物、重組蛋白、疫苗、血液制品及細胞與基因治療產品等。近年來, 生物藥物以超越傳統小分子藥物的增速在全球迅猛發展。其分析方法涵蓋結構表征、純度與雜質分析、功能及穩定性評價等多個層面, 各類方法都獨具特點和作用。通過綜合運用這些技術, 可以全面評估和控制生物藥物的質量與安全性。
“質量源于設計”(quality by design, QbD)是一種基于科學和風險的系統方法學, 最早由約瑟夫·朱蘭于1990年提出, 強調產品質量問題與其設計密切相關。為推廣QbD在制藥領域的實施, 人用藥品技術要求國際協調理事會(International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use, ICH)與美國食品藥品監督管理局(US Food and Drug Administration, FDA)及歐洲藥品管理局(European Medicines Agency, EMA)聯合發布了相關質量指南, 詳細闡述了QbD的原則、工具及實際應用, 包括ICHQ8(R2)藥品開發, ICHQ9(R1)質量風險管理, ICHQ10藥品質量系統, ICHQ11藥品原料的開發和制造, ICHQ12藥品產品生命周期管理的技術和法規考慮, ICHQ13藥品原料和制劑的連續制造。QbD運用設計工具與統計分析, 優化工藝并降低生產波動, 在確保藥物質量的同時, 通過全流程成本控制加速產品上市。如今, QbD已成為制藥行業工藝和產品設計與優化的強制性要求。
“分析質量源于設計”(analytical quality by design, AQbD)是QbD在分析方法開發中的延伸應用, 旨在建立穩健的分析方法, 有效防控超趨勢(out of trend, OOT)、失控(out of control, OOC)或不合格(out of specification, OOS)等質量偏差事件, 通過在方法參數的可操作設計區域(method operable design region, MODR)內實現參數變化的監管靈活性, 從而降低分析成本。AQbD在分析方法開發中的應用與QbD在藥物研發中的應用高度相似, 兩者涉及的關鍵要素可相互映射(表1)。

近年來, 隨著FDA批準的一些新藥展示了AQbD在分析方法開發中的重要性和應用價值, AQbD在分析方法開發中的推廣得到了進一步推動。此外, 美國藥典(US Pharmacopoeia, USP)于2022年5月發布了新通則<1220>《分析方法生命周期》, 英國藥典(British Pharmacopoeia, BP)也在2022版補充章節“分析質量源于設計在藥典方法中的應用”中指出, 基于AQbD開發的方法, 可在經驗證的范圍內調整方法參數而無需重新驗證, 從而為分析方法變更提供了更大的靈活性。與此同時, ICH發布了新指導原則《分析方法開發》(Q14)和《分析方法驗證》(Q2(R2))并于2023年11月正式生效。這些指南均涉及AQbD框架的制定, 進一步推動了其在制藥行業中的應用。在當前形勢下, 結合AQbD理念開發高效、高質量的分析方法已成為制藥行業的重要趨勢。值得一提的是, Beg等撰寫的《分析質量源于設計手冊》系統地梳理了AQbD術語, 并提供了實際應用案例, 為分析人員提供了寶貴的參考。
鑒于AQbD在生物藥物分析中的技術革新價值及國際監管推動趨勢, 本綜述基于ICH系列質量指南的框架, 結合USP、BP相關章節及最新文獻報道, 系統闡述了AQbD的工作流程, 總結了AQbD理念在生物藥物分析方法開發中的應用現狀, 并對該領域實施AQbD所帶來的機遇與挑戰提出了見解與展望。
1AQbD工作流程
傳統上, 分析方法開發通常采用單因素法(one factor at a time, OFAT), 即一次改變一個因素。基于該方法開發的分析方法存在實驗參數耐用性范圍較窄的問題, 可能導致方法轉移時需要重復驗證, 進而增加開發成本; 同時, 為實現同等的準確度和精密度, 該類方法往往需要開展更多的試驗, 且無法評估各因素間的交互作用。相比之下, AQbD從產品質量出發, 基于科學認知將風險評估(risk assessment, RA)與方法選擇相結合, 采用多因素實驗設計(design of experiments, DoE), 在方法參數與預期結果之間建立聯系, 最終開發出高度穩健且成本效益高的分析方法。AQbD可減少OOT、OOC及OOS結果, 實現監管靈活性, 現已成為分析方法開發的首選策略。圖1展示了AQbD的典型工作流程及關鍵要素。
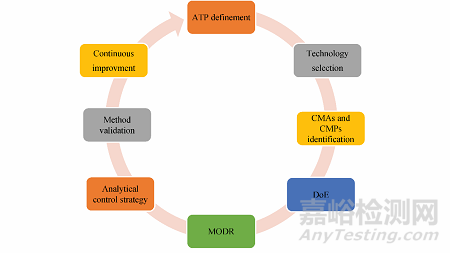
Figure 1 Typical workflow and key elements of AQbD
1.1 ATP制定
AQbD的工作流程始于分析目標概況(analytical target profile, ATP)的制定。ATP類似于產品的質量目標概況(quality target product profile, QTPP), 明確了分析方法的預期目的、關鍵質量屬性及方法性能標準, 但不涉及具體技術或操作模式。作為AQbD的基石, ATP指導分析技術的選擇, 并促進方法的持續監測與改進。在分析方法生命周期中, 方法的開發、驗證及監測均以ATP為基準, 確保方法始終符合預期目的。
1.2 技術選擇
確定ATP后, 下一步即是根據ATP需求, 基于先驗知識或預實驗選擇合適的分析技術。此時需考慮一系列問題, 如: 分析方法的目的是什么? 性能要求如何? 待測樣本有何特點? 實驗室設備及操作條件是否滿足? 方法復雜性如何? 是否需要特殊培訓? 檢測時間和成本如何控制? 對于這些問題的思考有助于分析人員準確理解擬開發方法的需求, 從而選擇最合適的分析技術。總體而言, 應綜合考慮方法的科學性、實用性和經濟性, 選擇適用于檢測目的的分析技術; 也可使用決策樹、流程圖或決策矩陣等工具比較不同分析技術的優劣。
1.3 基于風險評估確定CMAs和CMPs
選定分析方法后, AQbD將聚焦于方法開發, 全面評估儀器配置、樣品特性、樣品制備、環境條件及方法參數等與變異性相關的風險。其主要目的是通過風險評估確定關鍵方法屬性(critical method attributes, CMAs)和關鍵方法參數(critical method parameters, CMPs)。CMAs可直接衡量分析方法的變異性或準確度, 如以RSD評價精密度或回收率評價準確性; 也可以是與系統相關的屬性指標, 如色譜法中的分離度、拖尾因子和信噪比等。這些指標需控制在適當范圍內, 以確保數據質量。CMPs則是可能影響CMAs的潛在變量, 涵蓋樣品制備、分析測量和數據分析等環節。
風險評估需遵循ICH Q9指南, 分為風險識別、風險分析和風險評估三個步驟。常用的風險管理工具包括Ishikawa圖(魚骨圖或因果圖)和失敗模式效應分析(failure mode and effect analysis, FMEA), 前者常用于識別CMPs和CMAs, 后者常用于對風險因素進行優先排序。通過FMEA, 根據各風險因素影響結果的嚴重程度(severity, S)、產生影響的概率(probability, P)和產生影響后檢測的難易程度(detection, D), 計算風險優先指數(risk priority number, RPN), 對各因素進行打分和排序。其他工具還包括比較矩陣(comparison matrix, CM)、故障樹分析(fault tree analysis, FTA)和危害分析與關鍵控制點(hazard analysis and critical control point, HACCP)等。
在風險評估過程中, 重點是對識別出的CMPs進行分類: 哪些參數可以固定或通過小范圍調整控制; 哪些參數難以預測或控制; 哪些參數需通過實驗研究確定其對CMAs的影響及可接受范圍。因此, 風險評估的重要產出之一是根據FMEA的RPN打分和排序制定評價策略, 以確定需通過DoE進一步研究的CMPs, 如將超過某一RPN閾值或RPN值位于前30%的高風險參數納入DoE研究范圍, 作為DoE考察的核心變量。
1.4 DoE實驗設計
DoE是一種系統的化學計量學工具, 專門用于方法開發與優化, 它通過將方法參數(輸入因子, Xn)與輸出響應(Yn)相關聯, 幫助分析人員獲取過程相關信息, 并構建數學模型以反映參數與響應之間的因果關系。根據實驗目的, DoE設計通常分為篩選設計和優化設計(響應曲面設計)兩大類。此外, 多種專業軟件可用于DoE設計和統計建模, 如JMP、MATLAB、Fusion、Drylab、Design-Expert和MODDE等。
1.4.1 篩選設計
篩選設計能夠在較少實驗次數下研究大量輸入因子, 識別關鍵因子以納入優化實驗, 并可同時評估定性和定量參數對CMAs的影響, 由于具備顯著的經濟效益優勢而被廣泛應用。通過篩選設計, 不僅能確定不影響CMAs的參數及其工作條件, 還可獲得部分參數的最優值, 從而減少優化階段需研究的CMPs數量, 降低實驗次數。此外, 基于篩選實驗獲得的參數范圍, 可進一步調整以獲得最佳結果。
在篩選階段, 通常采用兩水平設計, 以較少的實驗次數研究盡可能多的參數。其中Plackett-Burman設計(PBD)和部分因子設計(fractional factorial design, FFD)為最常用的方法, 尤其適用于因子數量≥5的情況。若根據現有信息能合理規劃后續優化設計, 有時也可基于先驗知識或初步單變量實驗直接決策, 而不必開展篩選研究。
1.4.2 優化設計
優化階段通常采用響應曲面方法(response surface methodology, RSM)來評估CMPs對CMAs的主要相互作用和二次效應。與篩選階段相比, 優化階段旨在評估模型是否存在曲率, 因此每個參數需至少研究3個水平, 實驗次數相應增加。該階段一般側重于研究連續CMPs對CMAs的影響, 例如色譜法中的梯度條件、流速、緩沖液濃度和pH值等。所考察的CMPs可基于篩選試驗結果或直接從風險評估中選擇。
在優化階段, 常用的對稱設計包括全因子設計(full factorial design, FD)、中心組合設計(central composite design, CCD)、Box-Behnken設計(Box-Behnken design, BBD)、田口設計(Taguchi design, TD)和Doehlert設計(Doehlert design, DD)。當需要研究的CMPs數量較多時, 可采用D-最優設計(D-optimal design, DoD)以減少實驗次數。此外, I-最優、G-最優和A-最優設計也可用于特定模型的優化, 這些設計可根據模型主效應或系統復雜性包含二次項, 并可用于篩選目的。優化設計還包括混料設計(mixture design, MD)以及混料–過程變量設計(mixture process variable, MPV)。
1.5 MODR
根據ICH指南Q8, 分析方法的MODR等同于產品開發中的“設計空間”(design space, DS)。ICH指南Q14將MODR定義為“由兩個或多個分析方法參數的組合范圍組成, 在這些參數范圍內, 分析方法產生的結果始終符合ATP規定的目標”。因此, MODR可被視為分析方法的穩健性區域, 在MODR范圍內調整參數將不被視為方法變更, 且在每個點上以特定概率水平保證方法性能的質量。MODR越大, 方法滿足CMAs要求的穩健性越強。計算MODR時, 需考慮模型參數的不確定性及滿足CMAs要求的概率等因素, 常用工具包括蒙特卡洛模擬、貝葉斯建模和自舉法等。
1.6 分析方法控制策略
為保證分析方法的性能和質量, 制定合適的控制策略至關重要。“控制策略”的概念首次出現在ICH Q8(R2)中, 并在ICH Q10和Q11中進一步發展, 隨后在ICH Q14“分析方法開發”中擴展至分析方法領域。分析方法控制策略(analytical control strategy, ACS)包括方法描述、待控制的分析參數及系統適用性測試(system suitability test, SST)。分析方法描述應涵蓋分析測試的所有步驟, 如標準物質、樣品和試劑的準備, 儀器使用, 標準曲線生成, 結果計算公式及其他必要步驟。
與傳統方法的ACS相比, AQbD下的ACS可能沒有顯著差異, 但基于AQbD的ACS在分析方法參數的操作范圍內提供了更大的靈活性, 允許參數在允許范圍內波動。此外, 由于ACS基于ATP、DoE實驗數據和MODR制定, 它在分析方法性能與目的之間建立了更強的聯系。ACS應在方法驗證前確定, 并在驗證完成后加以確認。
1.7 方法驗證
一旦建立ACS并將其納入分析方法生命周期, 下一步即可開展方法性能驗證, 以確認方法符合ATP的要求。驗證的目的是識別不同實驗室使用該方法時可能引入的變異來源, 并加深對方法的整體理解, 以確保其始終符合ATP的規定。為此, 需制定驗證方案以確認方法性能, 并遵循ICH Q2等相關驗證指南。
1.8 持續改進
經驗證的方法投入日常使用后, 作為持續性能維護的一部分, 應建立持續收集、評估和分析與分析方法性能相關的信息和數據的程序。通過性能監控系統、糾正預防系統及變更管理系統等工具, 實現對分析方法的持續監測與改進。例如, 預先設定OOT標準, 使用統計過程控制(statistical process control, SPC)圖或其他工具跟蹤系統適用性數據或方法相關調查。這種持續監測使分析人員能夠檢測、識別并解決方法的異常; 當出現不符合時, 及時記錄并采取行動。此外, 可將風險管理和風險溝通工具嵌入工作流程, 必要時基于風險評估結果實施部分或完整的再驗證。
2AQbD在生物藥物分析方法開發中的應用現狀
AQbD是一種系統的方法論, 旨在確保“在合適的時間使用合適的方法”, 通過了解和控制變異源, 并在MODR范圍內工作, 以確保監管的靈活性。近年來, AQbD在化學藥、中藥等領域的分析方法開發中已廣泛應用, 涉及多種理化分析技術, 包括液相色譜法(liquid chromatography, LC)、紫外–可見分光光度法(ultraviolet-visible spectrophotometry, UV-Vis)、毛細管電泳法(capillary electrophoresis, CE)、超臨界流體色譜法(supercritical fluid chromatography, SFC)、高效薄層色譜法(high-performance thin-layer chromatography, HPTLC)以及一些分析聯用技術, 如UPLC-MS、LC MS/MS和GC-MS/MS等。
隨著對AQbD理念理解的深入, 其在生物藥物分析方法開發中的應用也逐漸推廣。盡管AQbD在不同藥物領域的應用流程相似, 但由于生物藥物的復雜性, 其分析方法開發仍面臨挑戰。因此, 實際應用中需根據方法特點和需求保持靈活性。本節將通過不同的生物藥物分析方法開發實例, 展示AQbD在該領域的具體應用場景, 以期為生物藥物分析方法開發提供參考。
2.1 液相色譜法(LC)
根據文獻檢索, LC作為分離技術的“金標準”, 不僅在化學小分子領域是最常見的基于AQbD理念開發和優化的分析技術, 在生物藥物領域也得到廣泛應用。
Nompari等基于AQbD理念開發了一種快速、選擇性好、靈敏度高的超高效液相色譜檢測方法(ultra-high-performance liquid chromatography, UHPLC), 用于檢測乙型腦膜炎疫苗Bexsero上清中的抗原含量。Bexsero是首個獲批用于2月齡及以上個體主動免疫的疫苗, 用于預防B群腦膜炎奈瑟菌引起的侵襲性疾病, 其未吸附抗原含量是關鍵質量屬性。該研究以準確定量Bexsero的5個活性蛋白成分并實現基線分離為目標, 選擇了RP-UHPLC作為分析技術。研究以奈瑟菌肝素結合抗原的容量因子、抗原峰分離度和峰面積作為CMAs, 基于Ishikawa圖評估識別可能影響CMAs的CMPs, 并通過預實驗優化了檢測器類型、樣品表面活性劑等CMPs。在實驗設計階段, 采用兩輪非對稱篩選矩陣和CCD, 系統評估了樣品小瓶類型、濃度、進樣量、色譜柱類型等因素對CMAs的影響, 并通過RSM和蒙特卡洛模擬確定了CMPs的MODR。最終優化的條件使抗原在5min內實現完全分離。在方法驗證階段, 研究人員通過全因子設計進行耐用性測試, 并按照ICH Q2指南開展驗證, 結果表明方法具備良好的選擇性、線性、準確度(回收率90.9%~115.9%)和精密度(重復性RSD為1.7%, 中間精密度RSD為2.8%~8.4%), 且定量限低至0.5μg·mL-1, 可用于Bexsero疫苗的常規分析。此外, 還考察了分析人員、色譜柱批次、樣品制備等日常使用中易變因素對結果的影響, 進一步證實了方法的穩健性。該研究首次將AQbD應用于疫苗質量控制, 展示了其在復雜生物藥物分析方法開發中的系統性和科學性, 為類似產品的質量控制提供了可借鑒的開發框架。
Moineau等報道了應用AQbD建立了一種高效陰離子交換色譜–脈沖安培檢測法(high-performance anion-exchange chromatography with pulsed ampero metric detection, HPAEC-PAD), 用于定量市售六價液體疫苗中非吸附多糖—聚核糖核糖醇磷酸酯(polyribosyl ribitol phosphate, PRP)的含量及其去聚合PRP的百分比。HPAEC-PAD是一種已建立的多糖變體檢測方法, 其分析步驟包括低速離心提取非吸附PRP、超速離心分離去聚合多糖與原生共軛多糖, 隨后在堿性條件下將PRP水解為二糖并進行HPAEC-PAD分析。研究中, AQbD用于優化超速離心和色譜分離階段的關鍵實驗參數。首先, 基于歐洲藥典要求和液相色譜標準, 制定了ATP。同時, 根據放行標準和先前色譜法相關的歷史驗證數據, 明確了方法的專屬性、范圍、準確度、精密度和定量限等性能指標的可接受標準。隨后, 采用FMEA對可能影響方法精度和準確性的CMPs進行風險評估, 識別了7個高風險CMPs, 包括超速離心的速度、溫度、時間、超速離心后在上清液回收之前的保持時間以及色譜分析中流動相的氦氣壓力、存儲時間和自動進樣器中的樣品存儲時間。接下來, 采用Ishikawa圖的方式展示了上述7個參數對分析方法精度的影響。這與多數文獻中風險評估先采用Ishikawa圖工具羅列所有可能影響CMAs的CMPs, 再采用FMEA進行打分排序的方式略有不同; 而且, 該研究中FMEA評分與常規風險評估也不同, 未考慮可檢測性, 僅基于嚴重性和發生概率計算RPN。這可能是因為擬優化的方法已獲批準, 研究人員對其有充分理解, 因此風險評估策略根據實際情況作了調整。在實驗設計階段, 采用L18田口正交設計研究了7個CMPs對結果的影響, 并通過18輪實驗確定了每個CMP的MODR。最終, 基于對方法的理解和耐用性研究, 建立了ACS。該研究展示了AQbD在優化已批準分析方法中的應用, 顯著提升了方法的穩健性和可操作性, 為復雜疫苗產品的質量控制提供了有力支持。同時, 與傳統方法相比, 基于AQbD優化的方法參數, 未來在定義的MODR范圍內變動時, 都將被接受和認可, 這為變更管理提供了更大的靈活性。
2.2 酶聯免疫吸附法(ELISA)
ELISA作為最常用的免疫化學方法之一, 廣泛用于蛋白疫苗抗原含量、體外效價或蛋白藥物結合活性的測定。以下案例展示了如何在免疫分析方法開發中實施AQbD。
Yarovoi等將AQbD應用于四價疫苗候選物體外相對效力測定放行方法的開發。研究首先制定了ATP, 明確了方法的用途、開發周期及性能要求。基于ATP對精密度、耐用性、樣品類型和檢測通量的要求, 選擇ELISA作為開發技術。隨后, 使用Ishikawa圖識別可能影響方法性能的因素, 并通過因果矩陣對其進行風險排序, 以確定需優化或控制的關鍵因素。在風險評估中, 研究團隊采用FMEA計算RPN, 綜合考慮嚴重性、發生概率和可檢測性。通過棋盤滴定法初步探究了實驗條件, 并根據實驗結果確定因子范圍, 開展后續DoE研究。DoE設計采用Design Expert軟件完成, 篩選階段使用FFD, 優化階段采用五水平半區CCD。基于篩選結果, 將堿性磷酸酶偶聯抗體和底物顯色時間等參數控制在最優水平, 并對捕獲和檢測條件進行優化。最終, 通過第二輪CCD確認最優條件, 并采用完全巢式方差分析和Minitab軟件評價方法的精密度。該研究系統展示了AQbD在ELISA方法開發中的應用, 通過風險評估和實驗設計優化關鍵參數, 顯著提升了方法的精密度和耐用性, 為疫苗效力測定提供了可靠的分析工具。
Han等基于AQbD理念開發了一種通用雙抗體夾心ELISA法, 用于檢測嚴重急性呼吸綜合征冠狀病毒2型(severe acute respiratory syndrome coronavirus2, SARS-CoV-2)蛋白亞單位疫苗的抗原含量。研究中, 采用豬抗SARS-CoV-2蛋白受體結合區域(receptor-binding domain, RBD)多克隆抗體作為包被抗體, 辣根過氧化物酶(horseradish peroxidase, HRP)標記的單克隆抗體20D8作為檢測抗體。通過風險評估, 研究確定了包被抗體和酶標抗體濃度、抗原抗體孵育及顯色溫度、抗原抗體孵育時間及顯色培養時間等CMPs, 并以信噪比作為CMA。采用JMP軟件進行定制化實驗設計, 并通過蒙特卡洛模擬確定了各參數的MODR。方法驗證指標通過BMV®軟件計算, 抗原含量則采用Biostat®軟件中的量反應平行線法進行定量分析。經驗證, 該方法具有足夠的特異性和準確度, 精密度≥90%, 在70%~143%的質量標準范圍內, 方法能力指數>0.96, 且誤判概率<0.39%; 另外, 可檢測5個不同廠家的SARS-CoV-2蛋白亞單位疫苗抗原, 展示了其廣泛的適用性。該研究開發的通用ELISA方法不僅解決了SARS-CoV-2疫苗抗原含量檢測的技術瓶頸, 還為已上市、緊急使用及研發中的疫苗提供了高效、可靠的分析工具, 體現了AQbD在生物藥物分析方法開發中的實際應用價值。
在另一項研究中, Rodríguez等基于AQbD工具開發了一種簡便可靠的間接ELISA方法, 用于檢測針對重組SARS-CoV-2蛋白RBD的人IgG。研究中, 使用HEK293細胞生產和純化的SARS-CoV-2蛋白RBD作為捕獲抗原, 兔抗人IgG-HRP作為檢測抗體。以提高陽性血清與陰性血清的信號比為目標, 研究對包被抗原用量和兔抗人IgG-HRP稀釋度進行了三水平全因子設計, 包含4個中心點, 共完成13次實驗。采用Stat-Ease Design-Expert軟件分析數據, 并通過分層多項式模型擬合信號比。在響應優化階段, 應用滿意度函數確定了最佳條件, 并進行了驗證。通過Cohen's kappa統計量評估, 該方法與參考方法RT-PCR的一致性達到0.92, 表明其具有較高的可靠性。該研究開發的間接ELISA方法操作簡便、結果可靠, 不僅可用于檢測病毒暴露, 還具備評估保護性免疫的潛力, 展示了AQbD在高通量免疫分析方法開發中的高效性和實用性。
2.3 毛細管電泳法(CE)
CE系基于電場中電荷分子的差異遷移進行分離, 目前已成功用于生物藥物活性成分及相關變異體的檢測。
van Tricht等基于AQbD開發了一種快速穩健的CE方法, 用于定量生產全工藝段樣品中的完整腺病毒顆粒。傳統方法如定量聚合酶鏈式反應(quantitative polymerase chain reaction, qPCR)和陰離子交換HPLC(anion exchange HPLC, AEX-HPLC)分別存在耗時長、成本高、重復性差或回收率低等問題, 難以滿足全工藝段樣品的定量需求。因此, 該研究以開發一種可在一天內完成分析, 且能對0.5×1011~1.5×1011·mL-1的完整腺病毒顆粒實現準確精密定量作為ATP, 同時還期望建立的方法可用于上游工藝(upstream processing, USP)和下游工藝(downstream processing, DSP)樣品的定量分析。CE因其對化學小分子、多肽、蛋白質及顆粒的高效分辨能力而被選為替代方法。研究中, 從USP和DSP中選取具有代表性的一組樣本, 用于優化完整腺病毒顆粒與其他基質成分的分離。通過全因子設計, 優化了Tris濃度、N-三(羥甲基)甲基甘氨酸濃度、分離電壓和毛細管有效長度4個CMPs, 并采用JMP統計軟件確定了各參數的MODR。方法開發完成后, 研究人員選取了裂解收獲液、澄清收獲液、陰離子交換純化液、超濾液和原液等5個代表性樣品進行驗證, 并與傳統方法結果進行比較。結果顯示, 基于AQbD開發的CE方法能夠精確定量含有細胞碎片、裂解液、宿主細胞蛋白、DNA、鹽和去污劑等復雜基質的腺病毒樣品, 加樣回收率為95%~110%, 中間精密度RSD為7.8%(n=18), 重復性RSD為2.1%~4.8%(n=18), 顯著優于傳統方法(qPCR和AEX-HPLC重復性RSD一般分別為10%和25%)。該研究開發的CE方法不僅解決了腺病毒顆粒定量中的技術難題, 還為疫苗生產過程中的質量控制提供了高效、可靠的分析工具, 展示了AQbD在復雜生物樣品分析方法開發中的優勢。
另外, Simeoni等報道了采用AQbD理念開發了還原型毛細管電泳法(reduced capillary electrophoresis sodium dodecyl sulfate, rCE-SDS), 以取代SDS-聚丙烯酰胺凝膠電泳(SDS-polyacrylamide gel electrophoresis, SDS-PAGE)作為商品化單克隆抗體產品的放行和穩定性測試方法, 展示了如何通過AQbD對過時技術進行更新。研究中, 首先明確了方法的預期用途: 在還原條件下分析和定量IgG1X變體, 以替代SDS-PAGE。盡管RP-HPLC和rCE-SDS均可滿足ATP要求, 但rCE-SDS對IgG1X片段的分離度更優, 且符合USP通則“重組治療性單克隆抗體分析方法”的推薦, 因此被選為目標方法。通過Ishikawa圖進行風險評估, 確定了重鏈峰拖尾因子、非糖基化重鏈峰分離度等CMAs和遷移電壓、緩沖液稀釋度和樣品pH等CMPs。隨后, 采用MODDE軟件進行DoE優化設計, 確定了方法的MODR。方法開發完成后, 按ICH Q2指南進行全面驗證, 并通過橋接研究比較了rCE-SDS與SDS-PAGE在檢測IgG1X變體方面的一致性。結果顯示, 兩種方法均能指示樣品穩定性, 但rCE-SDS比SDS-PAGE更靈敏, 測得的雜質總量更高, 而且對于SDS-PAGE無法定量的非糖基化重鏈也可進行定量, 通過建立兩種方法測定結果間的轉換因子補償了靈敏度差異, 避免了歷史數據的丟失, 為方法變更提供了支持。該研究展示了AQbD在方法變更中的應用, 通過系統風險評估和實驗設計, 成功開發了更靈敏、更可靠的rCE-SDS方法, 為單克隆抗體產品的質量控制提供了高效工具。
2.4 其他分析技術
除上述分析技術外, AQbD工具還可應用于生物藥物其他方法的開發和優化。
Yao等基于AQbD理念開發了一種UV-Vis方法, 用于測定L-天冬酰胺酶(L-ASNase)的活性, 以滿足藥品質量控制的需求。研究中, ATP被定義為開發一種操作簡單、省時且成本低, 能夠準確精密測定L-ASNase藥物制劑的活性的方法。通過對Nessler法、Berthelot法、吲哚克辛法、谷氨酸脫氫酶法和天冬氨酸轉氨酶法的性能特征、操作便捷性和成本進行比較, Nessler法被選為目標開發技術。研究評估了測定過程的每個步驟, 包括溶液制備、實驗操作和數據處理, 確定了450nm處的吸光度值(A450nm)及其精密度作為CMAs; 而CMPs分別從Nessler方法和酶活性反應條件進行評估, 其中Nessler方法選擇CKI/CHgI2、CNaOH/CHgI2、CHgI2final和反應時間作為4個CMPs, 而酶活性反應條件選擇了反應溫度、L-天冬酰胺濃度、緩沖液pH值和KH2PO4濃度4個對L-ASNase活性有顯著影響的CMPs。最終, 該方法的MODR為Nessler法和酶活性反應條件MODR的組合。通過設置系統適用性要求, 以保證方法性能的一致性, 并建立了ACS。實驗結果表明, 基于AQbD開發的UV-Vis法能夠有效測定加壓處理和未加壓處理的L-ASNase活性。該研究展示了AQbD在酶活性測定方法開發中的應用, 通過系統風險評估和實驗設計, 成功開發了一種高效、可靠的UV-Vis方法, 為L-ASNase制劑的質量控制提供了有力支持。
Pathak等基于AQbD理念開發了一種新型天然聚丙烯酰胺凝膠電泳法(native gel electrophoresis, N-PAGE), 作為分析單克隆抗體聚集體的低成本工具, 并與現行金標準分子排阻色譜法(size exclusion chromatography, SEC)進行了比較。SEC設備昂貴且存在固定相與分析物二次相互作用導致洗脫時間較長等問題, 研究提出了將N-PAGE作為正交分析方法。研究中, 首先對運行緩沖液pH值、摩爾濃度、氨基己酸濃度、凝膠緩沖液pH值、上樣染料、樣品濃度和運行電壓等參數進行了初篩。隨后, 通過兩輪DoE設計優化分離膠條件和凝膠百分含量。第一輪DoE以運行緩沖液pH值、摩爾濃度、氨基己酸濃度和凝膠緩沖液摩爾濃度為CMPs, 聚集體條帶數為CMA, 采用JMP軟件進行實驗設計。第二輪DoE采用三因素兩水平全因子設計, 通過監測聚集體條帶數量、擴散情況及聚集百分比誤差評估分離質量。實驗結果表明, N-PAGE與SEC在分析單克隆抗體聚集體方面具有相當的一致性, 且成本顯著降低。該研究開發的N-PAGE方法不僅為單克隆抗體聚集體分析提供了一種低成本、高效的替代方案, 還展示了AQbD在優化電泳方法中的應用潛力, 為生物藥物質量控制提供了新的工具。
Kochling等基于AQbD理念開發了一種具有通用性的平臺分析方法, 用于分析蛋白質的不同關鍵質量屬性, 展示了AQbD在平臺方法開發中的潛力。研究中, 考慮到肽圖分析、氧化物檢測和C末端變異體分析具有相同的樣品前處理步驟(還原、烷基化和脫鹽), 研究人員將這三種方法的開發同步進行, 以優化資源利用。根據分析目標, 分別選擇UHPLC-UV、UHPLC-MS和UHPLC-UV作為肽圖、氧化物和C末端變異體擬開發的分析方法。開發過程中, 既有對三種方法共有的步驟樣品前處理條件的考慮, 也有針對每種方法各自不同的檢測特點特定的考慮, 其中風險評估均采用Ishikawa進行, 色譜方法開發軟件采用Drylab。在肽圖分析中, 研究以兩個關鍵肽段的酶切錯切量為CMA, 還原時間、還原溫度、烷基化時間和烷基化溫度為CMPs, 通過全因子設計和RSM確定了前處理的通用條件和MODR。在氧化物LC-MS定量分析中, 研究以待測峰與相鄰峰的分離度(Rs)為CMA, 評估了去溶劑化氣體流量和溫度的影響。對于C末端變異體分析, 研究人員通過Drylab軟件進行全因子設計模擬, 優化了色譜分離條件, 將開發時間從1~3個月縮短至1周左右。該研究通過AQbD策略成功開發了通用的平臺分析方法, 顯著縮短了開發時間并降低了成本。其系統性風險評估和實驗設計為蛋白質多屬性分析提供了高效、可靠的解決方案, 展示了AQbD在平臺方法開發中的顯著優勢。
3總結與展望
AQbD是一種基于風險評估的系統開發策略, 旨在開發高質量的分析方法, 提升方法性能, 同時滿足監管靈活性, 確保方法在穩健的MODR范圍內運行, 避免方法轉移過程中的故障。其核心是在方法設計和開發階段, 聚焦于對最終產品質量有重要影響的因素的理解和控制, 包括方法選擇、樣品前處理、儀器性能等。通過系統研究這些因素, 可以更好地預測和控制方法性能, 從而實現高質量的藥物分析。
為支持AQbD的實施, ICH、USP及BP陸續發布了相關指南。其中, ICH于2023年11月發布的Q14與Q2(R2)指南終稿, 提供了全球統一的協議框架, 并在關鍵要素和術語上達成一致, 以推動分析方法的全生命周期管理。根據文獻調研表明, AQbD在化學小分子藥物和中藥分析方法開發中已廣泛應用, 而生物藥物由于其復雜性, 給分析方法的開發帶來挑戰, 使AQbD在該領域的應用尚處于起步階段。盡管如此, 這一系統化的開發策略正逐步得到認可和推廣。AQbD可有效應用于疫苗、單抗、重組蛋白藥物及酶等多種生物藥物領域, 既可用于全新方法的開發, 也可用于已批準方法的優化或替代。此外, 它不僅適用于高純度原料藥或制劑的活性成分及雜質分析, 還適用于中間品及強制降解產物等不同工藝階段的產品分析。涉及的分析手段既包括色譜法、CE、LC-MS等理化分析技術, 也包括ELISA、PAGE等免疫分析方法, 甚至在平臺分析方法開發中也有嘗試。
從不同方法的開發和優化流程可以看出, AQbD開發策略并非固定模式, 而是基于實際開發目的和便捷性, 有選擇性地涵蓋重點要素。在實際應用中, AQbD強調建立分析方法的設計空間, 即在特定參數范圍內確保方法的穩健性和可靠性, 通常涉及優化條件的確定及對潛在變化的敏感性評估。與傳統開發方法相比, AQbD開發策略的優勢在于分析方法可在全生命周期管理中進行持續改進, 即基于開發過程中的知識和經驗不一定可以獲得“滿分”方法, 但可以通過在日常使用中的持續監測, 繼續改進解決該方法仍然存在的缺點。隨著各種創新生物藥的迅猛發展, 基于多技術聯合分析的場景越來越多, 比如CE與MS聯用, 流式細胞術與MS聯用, qPCR與高通量測序聯用等, 由于AQbD策略可實現從“經驗驅動”向“數據驅動”的模式轉變, 將通過理念創新與監管協同, 為這些復雜的生物分析方法開發提供便捷和保障, 并有望將生物藥分析方法開發效率提升30%~50%, 同時降低驗證失敗率和方法生命周期內的管理成本。當然, 為了充分利用AQbD在分析方法開發中的優勢, 分析人員需具備深厚的專業知識和敏銳度, 針對不同方法的特點, 制定有針對性的開發策略, 以有效管理知識和風險, 提高數據質量并降低重新開發和驗證的成本。基于開發經驗, 分析人員可不斷建立新的知識空間, 并將其應用于后續工作。
盡管AQbD在生物藥物分析方法開發中顯著提升了分析效率并減少了資源消耗, 但仍面臨一些挑戰。例如, 生物藥物分析方法開發本身的復雜性、對設備和技術的高要求、人員培訓及知識管理和風險管理的綜合性等問題, 仍需在成本效益之間取得平衡。未來, 隨著技術的發展和經驗的積累, AQbD有望在生物藥物分析領域發揮更重要的作用。通過深入研究AQbD的應用, 可以更好地理解其原理, 并為其進一步發展提供有價值的參考。

來源:Internet


