您當前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網 2025-05-10 10:34
|
藥品名 |
CRENESSITY (Crinecerfont) |
|
劑型 |
膠囊 |
|
規(guī)格 |
25 mg, 50 mg, 100 mg |
|
使用途徑 |
口服 |
|
Rx/OTC |
Rx處方藥 |
|
適應癥 |
適應于糖皮質激素替代的輔助治療,以控制4歲及以上患有經典先天性腎上腺增生的成人和兒科患者的雄激素 |
|
最大日服用劑量 |
200mg |
Crinecerfont屬于新化學分子,其特性鑒定、純度、雜質及生產工藝均通過適當質量管理體系和驗證的分析方法得到有效控制。原料藥在商業(yè)包裝內于規(guī)定貯存期內穩(wěn)定性良好。
該新藥為口服軟膠囊劑型,輔料成分包括:中鏈甘油三酯、二辛酸/二癸酸丙二醇酯、月桂酰聚氧-32甘油酯及維生素E聚乙二醇琥珀酸酯。需說明的是二辛酸丙二醇酯雖首次應用于口服制劑,但根據藥學/毒理學審評意見確認其在處方中的定量水平可接受。藥品規(guī)格分為25mg、50mg和100mg三種,采用兒童防護蓋的HDPE瓶包裝。生產過程由cGMP合規(guī)生產設施的質量管理體系有效管控。從質量角度評估,擬定的控制策略能夠充分保證產品在特性、規(guī)格、純度、效價及穩(wěn)定性方面的質量一致性。
原料藥部分評估
Crinecerfont分子中含有一個S構型的手性中心。表征數據確保了原料藥的同一性和純度。原料藥結構已通過核磁共振氫譜(1H NMR)、核磁共振碳譜(13C NMR)、元素分析、傅里葉變換紅外光譜(FTIR)、質譜(MS)以及單晶X射線衍射分析得到充分表征。立體中心絕對構型通過X射線晶體學結構測定確證。商業(yè)化工藝生產得到的原料藥為單一晶型X,為BCS 4類。原料藥粒度大小和晶型并不是關鍵質量屬性。
申請人采用了成熟的原料藥合成工藝,該工藝根據ICH指導原則充分控制了殘留溶劑、元素雜質及致突變雜質,起始物料設定合理。原料藥質量控制標準包含了性狀、紅外光譜和高效液相色譜法鑒別、含量測定、手性純度、水分、有機雜質及微生物限度等關鍵質量屬性。用于控制原料藥質量的分析方法充分且經過適當驗證。穩(wěn)定性數據可以用于支持擬定條件下的儲存時間。
Crinecerfont原料藥為低溶解低滲透性化合物,符合BCS 4類特征。不同于多數原料藥的質量控制,Crinecerfont原料藥的質量標準中控制了微生物限度。
制劑部分評估
從藥理/毒理學以及CMC角度來看,制劑中新型輔料(即丙二醇二辛酸酯)的含量水平被認為是適宜的。制劑中有固定比例的已知輔料,3期和商業(yè)化制劑對比時,其比例沒有變化。
原料藥粒徑預計不影響產品質量。在產品開發(fā)過程中,已確定關鍵質量屬性,并通過包含性狀、鑒別、含量測定、降解產物、溶出度、劑量單位均勻性和微生物屬性等項目檢測產品,進行了充分控制。用于產品質量控制的分析方法均充分且經過適當驗證。根據提供的穩(wěn)定性數據,申請方擬定的15個月有效期(儲存條件15°C - 25°C/59°F至77°F)可被接受。
藥品裝在一個120cc的高密度聚乙烯瓶中,瓶口上有一個38毫米的兒童防護帽和鋁箔密封。
Crinecerfont軟膠囊處方中使用了一種新型輔料丙二醇二辛酸酯,評估了其在制劑中的含量水平,安全性可控。企業(yè)申請了15個月的有效期。儲存條件為15°C - 25°C,不同于一般固體制劑的USP要求:20°C - 25°C 常見儲存條件。
生物藥劑學:
Crinecerfont軟膠囊,規(guī)格為25 mg、50 mg和100 mg,是一種選擇性促腎上腺皮質激素釋放因子1(CRF1)受體拮抗劑。該藥物用于4歲及以上患者的推薦劑量:應隨餐服用,每日兩次(早晚各一次)。
FDA審評員認為Crinecerfont是一種溶解性差的化合物。在質量控制上,申請人擬定的兩階段溶出方法是充分的,總體生物藥劑學風險較低。FDA認為三種規(guī)格的膠囊配方在組成成分上呈現比例一致性。基于提交的關于處方間橋接、新增規(guī)格、生產場地及批量的整體性信息與數據,根據21 CFR 320.22(d)(2)法規(guī)要求,針對"擬上市"處方中25 mg和50 mg規(guī)格豁免體內生物等效性研究證明的要求具有可接受性,無需開展額外的體內研究。
(i)體外溶出方法的開發(fā)、體外溶解數據和體外溶解接受標準;
(ii)臨床和商業(yè)/上市藥物產品之間的橋接數據、制造地點和批次大小;
(iii)擬定低規(guī)格藥物的生物豁免請求。
體外溶出方法及驗收標準:
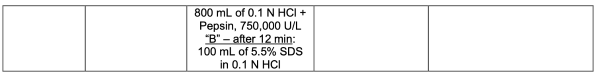
本品含低溶解性藥物活性成分,采用中鏈甘油三酯、丙二醇、月桂酰聚氧乙烯甘油酯及維生素E聚乙二醇琥珀酸酯(維生素E TPGS)作為溶劑配制成溶液。申請人提出了一種兩階段溶出方法,在第二階段溶出方法中,介質中使用胃蛋白酶的方法被認為是可接受的。所提出的溶出方法CFVs/CPPs/ CMAs變化(針對某輔料濃度的改變)具有有限的區(qū)分能力,經評估被認為可以接受。
基于溶出兩階段的接受限度,擬定的標準是可以接受。經申請人和FDA達成的一致同意,用于Crinecerfont軟膠囊(25 mg、50 mg和100 mg)在批放行及穩(wěn)定性研究期間質量控制的最終溶出度方法和驗收標準如下表1所示。

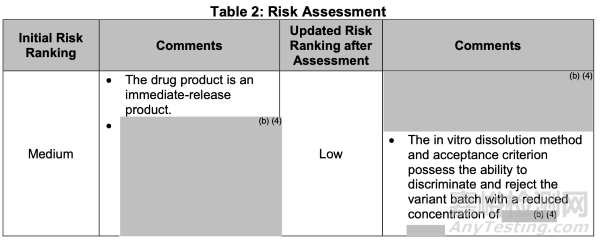
從生物藥劑學角度,基于對關鍵制劑變量(CFVs)/關鍵生物利用度屬性(CBAs)的識別,初始風險等級被評估為"中"。該評估基于分裝單元操作已建立并維持所有適用的GMP規(guī)范的假設。通過風險緩解及控制策略的實施,最終風險等級已更新為"低"(見表2)。
企業(yè)擬定的商業(yè)化溶出方法為兩階段溶出,第1階段使用0.6%SDS表面活性劑;第2階段前12分鐘使用了胃蛋白酶,12分鐘后增加了100ml 5.5%的SDS,Q點設定為45分鐘,使用了高濃度表活和高濃度胃蛋白酶,可預見原料藥溶解度是難溶化合物。
低規(guī)格(25 mg和50 mg)的橋接:
針對100 mg規(guī)格的擬商業(yè)化(TBM)制劑進行了一項1期研究。根據21 CFR 320.22(d)(2)規(guī)定,為支持25 mg和50 mg規(guī)格的TBM制劑與100 mg規(guī)格TBM制劑的橋接,申請人提交了數據證明。
1.單次口服Crincefont后,其暴露參數(Cmax和AUC)在膠囊制劑的臨床相關劑量范圍(25至200 mg)內呈劑量比例關系。
2.TBM膠囊100 mg、50 mg和25 mg規(guī)格的填充制劑生產工藝及定性與定量組成均保持比例一致性。
3.用于體外對比的參比制劑(100 mg TBM膠囊)已在體內臨床研究中證明與III期膠囊具有生物等效性。
4.TBM 100 mg膠囊(1×100 mg)與注冊批25 mg膠囊(4×25 mg和1×25 mg[標示量%])、50 mg膠囊(2×50 mg和1×50 mg[標示量%])的體外溶出曲線比較數據(f2值)。
企業(yè)在臨床1期使用了100mg規(guī)格制劑,對于其他擬上市規(guī)格25mg和50mg,對比了與100mg規(guī)格之間相似性,包括:25mg和50mg規(guī)格暴露劑量與100mg規(guī)格呈現劑量比例關系;對比100mg處方,25mg和50mg規(guī)格是等比例處方。而且25mg,50mg和100mg三個規(guī)格在等濃度的溶出試驗中呈曲線呈相似性。因100mg已證明與確證性臨床膠囊等效,因此上述三個規(guī)格在體內的等效性可橋接。
生產場地的橋接:
擬商業(yè)(TBM)三種規(guī)格批次的制造均使用單一生產場地。TBM產品的100毫克規(guī)格已用于臨床1期研究。因此無需進行生產場地橋接。
批次規(guī)模的橋接:
擬商業(yè)化代表批/臨床批次三種規(guī)格的生產處方均為軟膠囊劑型。由于各代表批/臨床批次規(guī)模差異在10倍范圍內,基于I期研究數據,代表性/臨床批次進行橋接被認為可接受。擬上市商業(yè)化批次的三種規(guī)格規(guī)模,根據SUPAC-IR指南,由于代表性/臨床批次與擬上市商業(yè)批次規(guī)模差異也在10倍范圍內,建議通過對比代表性/臨床批次與擬上市商業(yè)批次的體外溶出曲線,即可建立商業(yè)批次與臨床批次的橋接關系。
擬上市三規(guī)格的批量規(guī)模與確證性臨床批次的批量規(guī)格在10倍以內,因此不需要進行體內數據橋接,僅需進行制劑體外的溶出曲線對比,參考上述的溶出數據,可認為擬上市三個規(guī)格的批量規(guī)模與確證性臨床批次的規(guī)格是可橋接的。
生物等效性豁免申請:
基于橋接不同制劑、新增規(guī)格、生產場地及批量大小所提交信息的整體性,支持對擬商業(yè)化制劑25 mg和50 mg規(guī)格免于體內生物等效性研究的依據,符合21 CFR 320.22(d)(2)要求,被認為是可接受的。無需進行額外的體內研究。25 mg與50 mg規(guī)格的療效研究將由臨床/臨床藥理學審評員進行評估。
因此,擬商業(yè)化制劑25 mg和50 mg規(guī)格的生物等效性豁免申請得到了FDA的同意,基于制劑處方、場地、批量和暴露量等核心數據的可橋接性。

來源:文亮頻道


