您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2025-03-27 18:13
在醫(yī)療器械的研發(fā)與生產(chǎn)過程中,滅菌是確保產(chǎn)品安全性的核心環(huán)節(jié)。濕熱滅菌憑借其高效、安全可靠的特點(diǎn),成為醫(yī)療器械行業(yè)中應(yīng)用較為廣泛的滅菌方式之一。但在醫(yī)療器械行業(yè),濕熱滅菌相對于環(huán)氧乙烷滅菌和輻照滅菌又是一個比較小眾的滅菌方式,因此很多人對此并不太熟悉。本文結(jié)合法規(guī)標(biāo)準(zhǔn)與個人的滅菌實(shí)踐,系統(tǒng)解析濕熱滅菌的知識要點(diǎn)和常見的問題,期望能夠給從業(yè)者帶來一些啟示。
1.濕熱滅菌法規(guī)
濕熱滅菌需要參考的核心標(biāo)準(zhǔn)以及指南主要包括:
GB18278.1/2(ISO17665-1/2) 醫(yī)療器械產(chǎn)品滅菌 濕熱 第一部分 醫(yī)療器械滅菌過程的開發(fā)、確認(rèn)和常規(guī)控制要求以及指南
藥品GMP&WHO GMP
ISO11138-1 醫(yī)療器械滅菌 生物指示劑一般要求
EN 285:歐洲大型滅菌設(shè)備(如預(yù)真空滅菌柜)的性能與測試標(biāo)準(zhǔn),涵蓋蒸汽質(zhì)量檢測要求。
PDA技術(shù)報告:PDA TR1(濕熱滅菌驗(yàn)證)和TR48(濕熱滅菌工藝監(jiān)控)提供行業(yè)實(shí)踐指南。
2.濕熱滅菌工藝類別
根據(jù)滅菌原理與適用場景,主要滅菌工藝包括:
1. 飽和蒸汽重力置換工藝
重力置換程序是基于滅菌器腔體內(nèi)空氣比蒸汽更冷更重而將下沉腔體底部的原理。主要用于物體表面滅菌。由于蒸汽進(jìn)入腔體,空氣被排擠底部排水溝并且連同冷凝水一起從排水閥和或疏水閥排出腔體外,疏水閥是被設(shè)計(jì)為有效地允許大量空氣通過的通道。

滅菌過程由3個階段組成,第1段為加熱過程,使滅菌柜達(dá)到相應(yīng)的滅菌溫度和飽和蒸汽壓力。第2段是滅菌暴露過程,維持飽和蒸汽滅菌溫度和時間。第3段是冷卻階段,冷卻階段避免快速減壓,需通入空氣。

2. 飽和蒸汽-預(yù)真空和脈動真空工藝
該滅菌主要用于難以排出空氣的產(chǎn)品,比如多孔材料、管路或者包裝等。真空的目的就是有效排除空氣,消除冷點(diǎn),讓飽和蒸汽與滅菌產(chǎn)品充分接觸。目前普遍采用的技術(shù)是脈動真空。
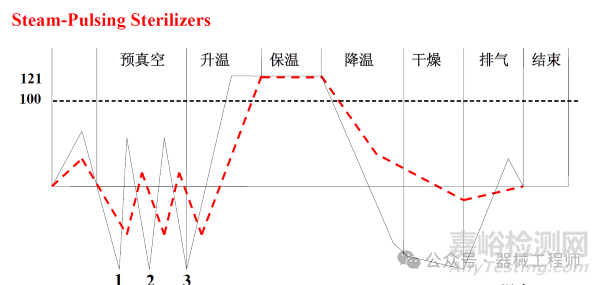
3. 空氣蒸汽混合滅菌工藝
盡管空氣通常被認(rèn)為會降低純蒸汽的滅菌穿透效率,但是有時候需要空氣和蒸汽混合滅菌的方式。例如一個裝有注射液的無菌玻璃瓶需要進(jìn)行濕熱滅菌,瓶內(nèi)有一定的空氣存在,當(dāng)溫度升高后,瓶內(nèi)壓力升高。當(dāng)排氣過程中壓力差變得非常大的情況下,玻瓶瓶可能會破裂。因此通過諸如壓縮空氣維持壓力并快速冷卻產(chǎn)品是有必要的。目前比較流行的醫(yī)美產(chǎn)品所使用的預(yù)灌封注射器在滅菌過程也存在類似問題,通過空氣加壓避免膠塞活動。
4. 過熱水噴淋等滅菌工藝
藥品制劑類可能會用到此滅菌工藝,比如乳劑、氨基酸等。滅菌過程主要包括4個階段,注水階段、加熱階段(蒸汽加熱循環(huán)水,水噴淋產(chǎn)品)、滅菌階段(保溫)和冷卻階段。醫(yī)療器械很少有這種滅菌方式。
3.濕熱滅菌工藝要點(diǎn)
1. 滅菌關(guān)鍵參數(shù)定義:
D值:在特定溫度下殺滅90%微生物所需時間(單位:分鐘),用于評估生物指示劑抗性。
Z值:使某種微生物D值降低一個對數(shù)級所需的溫度變化(單位:℃),滅菌溫度升高的度數(shù),反映微生物對溫度的敏感性,如下圖濕Z值為10℃。

F0值(標(biāo)準(zhǔn)滅菌時間):是指參照高溫度121.1℃,Z取10℃時計(jì)算的等效滅菌時間。例如當(dāng)生物指示劑Z取10℃,F(xiàn)(T=121.1℃,Z=10℃)賦予產(chǎn)品8分鐘的程序,F(xiàn)0=8, 與一個116℃滅菌25.9分鐘滅菌等效,F(xiàn)0均為8分鐘。
2. 滅菌柜設(shè)備以及軟件驗(yàn)證
濕熱滅菌柜是一個比較復(fù)雜的設(shè)備,通常來說應(yīng)當(dāng)具有完整的設(shè)備驗(yàn)證文件以及軟件驗(yàn)證文件,包括URS/DQ/FAT/SAT/IQ/OQ/PQ。URS由設(shè)備需求方輸出,需求方結(jié)合產(chǎn)品的特點(diǎn),給出滅菌柜的關(guān)鍵需求,例如尺寸需求、選擇的滅菌工藝等。設(shè)備制造方根據(jù)用戶需求設(shè)計(jì)設(shè)備,同時提供全套的滅菌驗(yàn)證服務(wù),包括DQ/FAT/SAT等驗(yàn)證服務(wù)。

3. 滅菌工藝開發(fā)
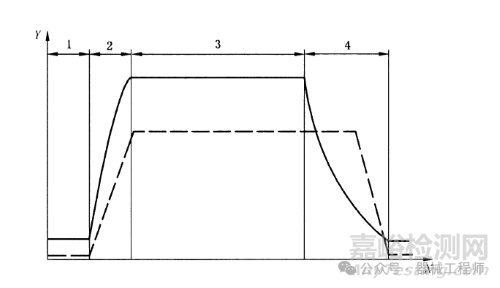
不同產(chǎn)品的滅菌工藝需要進(jìn)行針對性的開發(fā)和研究,例如無菌服、西林瓶產(chǎn)品、預(yù)灌封產(chǎn)品的額滅菌工藝是不同的,選擇合適的滅菌工藝至關(guān)重要。當(dāng)確定滅菌工藝后,要針對滅菌不同階段的工藝參數(shù)進(jìn)行調(diào)整和摸索,包括加熱階段(heating)、暴露階段(exposure)、冷卻階段(cooling)。
4. 滅菌工藝驗(yàn)證(OQ)
滅菌工藝部分的驗(yàn)證包括OQ以及PQ部分。OQ部分包括的內(nèi)容主要有:
純蒸汽質(zhì)量檢測(不冷凝氣體、過熱值、干燥值,一般委托第三方測試);
溫度分布測試(小裝載熱分布、滿載熱分布3次);
BD測試驗(yàn)證純蒸汽換頭情況(化學(xué)指示劑);
空氣泄露率測試
需要注意的是在做溫度均勻分布測試時,需要合理的布置探頭數(shù)量,并且完成測試后應(yīng)當(dāng)對每個階段數(shù)據(jù)進(jìn)行分析,尤其是保溫階段溫度分析,確定溫度波動范圍以及冷點(diǎn)位置。溫度探頭位置以圖示形式進(jìn)行展示。

5. 滅菌工藝驗(yàn)證(PQ)
濕熱滅菌PQ驗(yàn)證的思路基本同環(huán)氧乙烷,核心要點(diǎn)如下:
過程挑戰(zhàn)裝置(PCD)應(yīng)當(dāng)是產(chǎn)品族中最難滅菌的規(guī)格,BI應(yīng)當(dāng)在最難滅菌位置。
過程挑戰(zhàn)裝置(PCD)均勻分布在滅菌器內(nèi),且考慮最難滅菌位置放置過程挑戰(zhàn)裝置(PCD)。
過度滅殺法包括運(yùn)行一次短周期、3次半周期以驗(yàn)證無菌保障水平是否能達(dá)到10-6,同時進(jìn)行兩次全周期以確認(rèn)產(chǎn)品性能不受滅菌影響(包括包裝完整性)。短周期考慮產(chǎn)品和PCD強(qiáng)度對比,確認(rèn)PCD強(qiáng)度高于產(chǎn)品。當(dāng)產(chǎn)品不耐高溫滅菌時,考慮部分陰性法(和EO類似,這個驗(yàn)證較為復(fù)雜)。
半周期和全周期可同步進(jìn)行熱穿透試驗(yàn)(3次),確認(rèn)產(chǎn)品內(nèi)部溫度穿透情況(例如探頭插入玻璃瓶)。探頭位置要明確表示。
F0值以最冷點(diǎn)達(dá)到121℃后開始計(jì)算。
4.濕熱滅菌常見問題
1. 滅菌溫度為何選擇121℃而非120℃?
121℃(250℉)是早期研究確定的飽和蒸汽滅菌基準(zhǔn)溫度,其對應(yīng)的壓力(約2 bar)可實(shí)現(xiàn)高效微生物殺滅。
根據(jù)Z值=10℃的模型,121℃下的滅菌效率比120℃高約1.26倍(Fo值計(jì)算更易達(dá)標(biāo))。
2. 常見的問題
BI培養(yǎng)天數(shù)
很多嗜熱芽孢桿菌BI說明書規(guī)定的天數(shù)為3,但是ISO11138-1建議參考的濕熱滅菌BI培養(yǎng)的天數(shù)是7天,并且明確如果培養(yǎng)天數(shù)少于建議的天數(shù),應(yīng)當(dāng)進(jìn)行驗(yàn)證。 FDA在“FDA guildline to validation of BI incubation time”指南中給出了縮短BI培養(yǎng)時間的指南。
沒有對驗(yàn)證的數(shù)據(jù)進(jìn)行充分的分析
ISO17665標(biāo)準(zhǔn)明確需要對滅菌驗(yàn)證過程的數(shù)據(jù)進(jìn)行分析,包括溫度、壓力、F0值等。
沒有定期進(jìn)行純蒸汽質(zhì)量檢測
標(biāo)準(zhǔn)要求至少每年需要進(jìn)行純蒸汽質(zhì)量檢測,因此每年應(yīng)當(dāng)進(jìn)行該測試。很多企業(yè)忽視這一點(diǎn)。
PCD選擇不合適
PCD選擇應(yīng)當(dāng)涵蓋產(chǎn)品族最難滅菌產(chǎn)品,因此企業(yè)要在滅菌驗(yàn)證方案中要充分論證PCD選擇的合理性。
滅菌柜驗(yàn)證不充分,包括軟件驗(yàn)證
完整的驗(yàn)證包括URS/DQ/FAT/SAT/IQ/OQ, FDA對于滅菌柜驗(yàn)證文件審核較為嚴(yán)格。另外應(yīng)當(dāng)重視軟件驗(yàn)證的數(shù)據(jù)完整性問題,技術(shù)備份電子溫度數(shù)據(jù)以及紙質(zhì)記錄。

來源:器械工程師


