您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2024-11-07 09:16
目的:為我國藥品附條件批準(zhǔn)上市制度的完善和相關(guān)工作的順利實(shí)施提供參考。 方法:通過文獻(xiàn)研究和數(shù)據(jù)統(tǒng)計(jì),從適應(yīng)證、加速審評時(shí)間、臨床試驗(yàn)、上市后要求、納入醫(yī)保情況等方面闡述我國藥品附條件批準(zhǔn)上市制度的實(shí)施情況,分析制度實(shí)施過程中存在的問題,并提出改進(jìn)建議。 結(jié)果:附條件批準(zhǔn)上市藥物以抗腫瘤藥為主;附條件批準(zhǔn)可加快具有突出臨床價(jià)值的臨床急需藥品上市;支持附條件批準(zhǔn)的關(guān)臨床試驗(yàn)中以客觀緩解率為終點(diǎn)指標(biāo)的Ⅱ期單臂臨床試驗(yàn)占比最高;上市后研究除確證性臨床研究外還包括藥學(xué)研究、真實(shí)世界研究等;納入醫(yī)保情況與常規(guī)批準(zhǔn)的創(chuàng)新藥基本相同。 結(jié)論:為推動(dòng)我國附條件批準(zhǔn)上市制度的順利實(shí)施,仍需要監(jiān)管部門不斷完善相關(guān)法規(guī)、配套的制度、組織機(jī)構(gòu)及職能。
【關(guān)鍵詞】 附條件批準(zhǔn)上市;附條件批準(zhǔn);藥品
附條件批準(zhǔn)上市是指用于嚴(yán)重危及生命且尚無有效治療手段的疾病、公共衛(wèi)生方面急需的藥品,現(xiàn)有臨床研究資料尚未滿足常規(guī)上市注冊的全部要求,但已有臨床試驗(yàn)數(shù)據(jù)顯示療效并能預(yù)測其臨床價(jià)值,在規(guī)定申請人必須履行特定條件的情況下,基于替代終點(diǎn)、中間臨床終點(diǎn)或早期臨床試驗(yàn)數(shù)據(jù)而批準(zhǔn)上市。應(yīng)對重大突發(fā)公共衛(wèi)生事件急需的疫苗或者國家衛(wèi)生健康委員會(huì)認(rèn)定急需的其他疫苗,基于Ⅲ期臨床試驗(yàn)期中分析數(shù)據(jù),經(jīng)評估獲益大于風(fēng)險(xiǎn)的也可附條件批準(zhǔn)上市[1]。附條件批準(zhǔn)側(cè)重于減少上市前臨床試驗(yàn)的研究周期,從而加速藥品上市進(jìn)程,以保障公眾迫切的用藥需求。
附條件批準(zhǔn)上市制度自 2020 年正式實(shí)施以來取得了積極成果。在2020-2022年國家藥品監(jiān)督管理局藥品審評中心(以下簡稱藥審中心) 批準(zhǔn)的新藥申(new drug application,NDA)中,通過附條件批準(zhǔn)上市分別占比為7.21% ,18.58%和17.47% 。特別是在新型冠狀病毒感染(以下簡稱新冠) 疫情期間這一制度發(fā)揮了重要作用,5種新冠疫苗和16種新冠病毒治療藥物均為附條件批準(zhǔn)上市。但我國實(shí)施附條件批準(zhǔn)上市制度的時(shí)間較短,法規(guī)體系仍不完善,仍存在配套指導(dǎo)文件缺失、程序銜接不明確、上市后監(jiān)管不完善等問題,可能影響這項(xiàng)制度在我國的順利實(shí)施,甚至產(chǎn)生新的用藥安全隱患。本研究通過文獻(xiàn)和數(shù)據(jù)統(tǒng)計(jì)分析,從適應(yīng)證、加速審評時(shí)間、臨床試驗(yàn)、上市后要求、納入醫(yī)保情況等方面綜述我國附條件批準(zhǔn)上市藥品的情況,進(jìn)而分析附條件批準(zhǔn)上市制度的實(shí)施效果和存在的問題,并提出相關(guān)建議。
1、 數(shù)據(jù)來源
我國附條件批準(zhǔn)上市藥品數(shù)量來源:2024-2019年的數(shù)據(jù)來源于宋茵茵等[2]、唐輝等[3]的研究;2020-2023年的數(shù)據(jù)來源于國家藥品監(jiān)督管理局發(fā)布的年度藥品審評報(bào)告[4-6]。通過查詢藥審中心網(wǎng)站的藥品技術(shù)審評報(bào)告,整理研究所用的藥品品種、適應(yīng)證、藥審中心承辦時(shí)間、批準(zhǔn)上市時(shí)間、上市后研究、上市后風(fēng)險(xiǎn)管理等信息。通過查詢米內(nèi)網(wǎng)和藥智網(wǎng)的藥品信息,統(tǒng)計(jì)研究所用藥品上市后研究進(jìn)展、納入醫(yī)保的數(shù)量和時(shí)間。
由于存在藥品新增適應(yīng)證和2種藥品聯(lián)合用藥治療同一適應(yīng)證的情況,為方便統(tǒng)計(jì),采用“品種/適應(yīng)證”作為數(shù)量統(tǒng)計(jì)單位,即首次獲批的品種數(shù)量或新增的適應(yīng)證數(shù)量。同時(shí),由于新冠疫苗、新冠病毒治療藥物受理號不對外公開,無法準(zhǔn)確查詢審批信息,故部分指標(biāo)不納入統(tǒng)計(jì)。由于部分藥品未能獲得受理號而無法查詢相應(yīng)的藥品審評報(bào)告,故關(guān)鍵臨床試驗(yàn)、上市后要求情況僅納入2020-2022年數(shù)據(jù),納入醫(yī)保情況采用2024-2022年數(shù)據(jù)。具體納入數(shù)據(jù)情況見圖1。

▲圖1-研究流程圖
2、 結(jié)果與分析
2.1 附條件批準(zhǔn)上市藥品基本情況
自2024年我國第1件附條件批準(zhǔn)藥品西達(dá)本胺片上市以來,2014-2023年間共有122件藥品(品種/適應(yīng)證) 附條件批準(zhǔn)上市,其中35件為新增適應(yīng)證。2015-2017 年間無藥品附條件批準(zhǔn)上市,2018-2021年間附條件批準(zhǔn)上市藥品數(shù)量持續(xù)增長,2022-2023年間數(shù)量減少( 見圖2)。根據(jù)2023年度藥品審評報(bào)告,已有 19個(gè)品種轉(zhuǎn)為完全批準(zhǔn)[7]。在適應(yīng)證分布上,抗腫瘤藥物占比最高(75.41% ),其次為新冠疫苗和治療藥物(10.66% ),見圖3。

▲圖2-2014-2023年我國附條件批準(zhǔn)上市品種/適應(yīng)證的數(shù)量分布

▲圖3-2014-2023年我國附條件批準(zhǔn)上市品種/適應(yīng)證的種類分布
在品種類別上, 主要為生物制品 (64件, 占52.46% ),其次為化學(xué)藥(56 件,占45.90% ),中藥僅淫羊藿素軟膠囊(國產(chǎn)) 和香雷糖足膏(進(jìn)口)2項(xiàng)。同時(shí),國產(chǎn)藥品占比(69件,占56.56% ) 高于進(jìn)口藥品(53件,占 43.44% ),見圖4。

▲圖4-2024-2023年我國附條件批準(zhǔn)上市品種/適應(yīng)證的類型和數(shù)量分布
2.2 加快具有突出臨床價(jià)值的臨床急需藥品上市
附條件批準(zhǔn)上市制度的實(shí)施可有效加快具有突出臨床價(jià)值的藥品上市,滿足臨床急需。2014-2023年間附條件批準(zhǔn)上市藥品(新冠疫苗、新冠病毒治療藥物無法準(zhǔn)確查詢審評信息,故不納入統(tǒng)計(jì)),自藥審中心承辦至批準(zhǔn)上市所需的平均時(shí)間為12 個(gè)月,中位數(shù)時(shí)間為11個(gè)月(范圍為1-22個(gè)月),見表1。
▲表1-2014-2023年附條件批準(zhǔn)上市品種/適應(yīng)證審評審批時(shí)間情況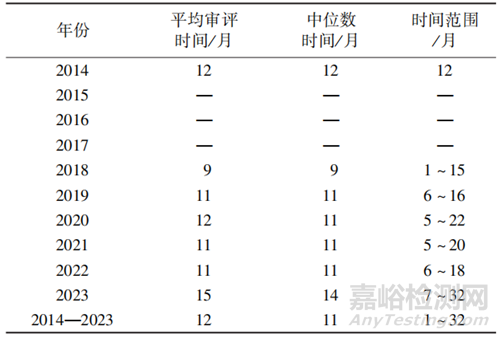
因2020年7月1日起新版《藥品注冊管理辦法》正式施行,其中針對審評時(shí)限進(jìn)行部分調(diào)整,為更直觀對比,選擇2021-2022年藥審中心建議批準(zhǔn)的NDA數(shù)據(jù)進(jìn)行對照研究。經(jīng)統(tǒng)計(jì),2021-2022年通過常規(guī)批準(zhǔn)上市的藥品平均審評時(shí)間約為21個(gè)月,僅通過附條件批準(zhǔn)的為16個(gè)月,同時(shí)通過優(yōu)先審評審批和附條件批準(zhǔn)的為10 個(gè)月,同時(shí)通過優(yōu)先審評審批、附條件批準(zhǔn)和突破性療法的為12個(gè)月,見表2。以2022年通過附條件批準(zhǔn)、優(yōu)先審評和突破性治療認(rèn)定的抗腫瘤藥為例,均為在我國尚無有效治療手段或具有突出臨床療效的臨床急需藥品,平均審評時(shí)間約為12.7個(gè)月,比同年常規(guī)批準(zhǔn)的抗腫瘤藥快1.6個(gè)月上市,見表3。綜上所述,附條件批準(zhǔn)程序與其他加速程序的組合應(yīng)用更有助于加快具有突出臨床價(jià)值的臨床急需藥品上市。
▲表2-2021-2022年藥審中心建議批準(zhǔn)上市的藥品自承辦至批準(zhǔn)上市所需時(shí)間
+ 為通過該項(xiàng)程序批準(zhǔn)上市;- 為未通過該項(xiàng)程序批準(zhǔn)上市;采用特別審評上市的藥品未公開受理號,故未納入統(tǒng)計(jì)
▲表3-2022年部分附條件上市抗腫瘤藥審評信息
R/ R:復(fù)發(fā)性/ 難治性;FL:濾泡性淋巴瘤
2.3 支持附條件批準(zhǔn)的關(guān)鍵臨床試驗(yàn)
以下從臨床試驗(yàn)設(shè)計(jì)、終點(diǎn)指標(biāo)的選擇和臨床試驗(yàn)階段三方面探討支持附條件批準(zhǔn)的關(guān)鍵臨床試驗(yàn)的基本情況。2020-2022年附條件批準(zhǔn)上市藥品(新冠病毒治療藥物和新冠疫苗除外) 涉及關(guān)鍵臨床試驗(yàn)的共91項(xiàng)(其中12件品種/適應(yīng)證有2項(xiàng)關(guān)鍵臨床試驗(yàn),1件品種/適應(yīng)證有3項(xiàng)),其中終點(diǎn)指標(biāo)為客觀緩解率(Objective response rate, ORR)的Ⅱ期單臂臨床試驗(yàn)占比最高(47項(xiàng),占比51.65% )。在臨床試驗(yàn)設(shè)計(jì)上,主要分為單臂臨床試驗(yàn)( 占67.03% )和隨機(jī)對照臨床試驗(yàn)(占 32.97% )。在臨床試驗(yàn)階段上,主要分為Ⅰ期(占2.20% )、Ⅱ期(占68.13% )和Ⅲ期臨床試驗(yàn)(占29.67% )。在主要終點(diǎn)指標(biāo)的選擇上,使用ORR的臨床試驗(yàn)有54項(xiàng)(占比59.34% ),見圖 5。

終點(diǎn)指標(biāo)的選擇,ORR:客觀緩解率,CR:完全緩解,MRR:主要緩解率,CHR:血液完全緩解,OS:總生存期,PFS:無進(jìn)展生存期,MFS:無轉(zhuǎn)移生存期,8:其他(包括基線的血清磷濃度、3年無事件生存期率、主要細(xì)胞遺傳學(xué)反應(yīng)或主要血液學(xué)反應(yīng)等14項(xiàng))
▲圖5-2020-2022年附條件上市藥品的關(guān)鍵臨床試驗(yàn)情況
2.4 附條件批準(zhǔn)上市藥品的上市后要求
2.4.1 上市后研究
確證性臨床試驗(yàn)是藥品附條件批準(zhǔn)上市后研究的主要內(nèi)容,其中部分進(jìn)口藥品除要求遞交全球確證性臨床研究外,還要求在中國開展或納入合適比例的中國受試者上市后臨床研究,以優(yōu)化中國患者的給藥劑量或給藥方案。在2020-2022年附條件批準(zhǔn)上市藥品中,上市前確證性臨床試驗(yàn)的進(jìn)度不同,據(jù)此制定的上市后臨床研究計(jì)劃也存在差異。① 部分藥品上市前未進(jìn)行確證性臨床試驗(yàn),需要啟動(dòng)新的臨床試驗(yàn)。如替雷利珠單抗注射液上市后要求包括進(jìn)一步細(xì)化并完善上市后確證性Ⅲ期臨床研究方案,在批準(zhǔn)上市后1年內(nèi)啟動(dòng)Ⅲ期臨床研究,并在5年內(nèi)完成[8]。② 部分藥品上市前已進(jìn)行階段性研究,可繼續(xù)正在進(jìn)行的臨床試驗(yàn)。如甲磺酸奧美替尼片上市后要求包括按計(jì)劃完成正在進(jìn)行的Ⅲ期臨床試驗(yàn)確證性隨機(jī)對照研究,按年度報(bào)告進(jìn)展,完成的研究及時(shí)提交完整的總結(jié)報(bào)告[9]。
除此之外,部分藥品還需要完善藥學(xué)研究、真實(shí)世界研究、特殊人群的用法用量研究等。在2020-2022年附條件批準(zhǔn)上市藥品的公開技術(shù)審評報(bào)告中,4項(xiàng)品種/適應(yīng)證要求完成上市后藥學(xué)研究,7項(xiàng)品種/適應(yīng)證要求開展真實(shí)世界研究,見表4。
▲表4-2020-2022年附條件批準(zhǔn)上市品種/適應(yīng)證需要完成的其他上市后研究

PK:藥動(dòng)學(xué);BICR:設(shè)盲的獨(dú)立評審委員會(huì);NSCLC:非小細(xì)胞肺癌;PTC:甲狀腺乳頭狀癌;最新進(jìn)展數(shù)據(jù)檢索截至2024年3月10日;上表僅列舉部分需完成“特殊人群用藥”的藥品
2.4.2 上市許可有效期與研究完成日期
2020-2022年附條件批準(zhǔn)上市藥品中僅2項(xiàng)明確藥品注冊證書有效期,分別為奧雷巴替尼片3年和注射用卡非佐米5年。明確上市后臨床試驗(yàn)時(shí)間期限的品種/ 適應(yīng)證有46 項(xiàng) ( 占比58.97% ), 期限范圍為1~6年,見圖6。同時(shí),未明確期限的品種/ 適應(yīng)證中3項(xiàng)要求按年度提交報(bào)告,有1項(xiàng)提出在獲批后6個(gè)月內(nèi)與藥審中心溝通該研究的具體方案,4項(xiàng)提出在不晚于上市后第3年與藥審中心溝通臨床試驗(yàn)進(jìn)展,1項(xiàng)不晚于5年。

▲圖6-2020-2022年附條件批準(zhǔn)上市藥品完成上市后臨床試驗(yàn)的時(shí)間期限
2.4.3 上市后風(fēng)險(xiǎn)管理
上市后風(fēng)險(xiǎn)管理計(jì)劃的內(nèi)容主要包括產(chǎn)品信息、安全性事項(xiàng)、藥物警戒計(jì)劃、上市后有效性研究、風(fēng)險(xiǎn)最小化措施等。基于不完全統(tǒng)計(jì),總結(jié)歸納附條件批準(zhǔn)上市藥品上市后風(fēng)險(xiǎn)管理計(jì)劃中的基本內(nèi)容和需要額外關(guān)注的內(nèi)容,見表5。
▲表5-附條件批準(zhǔn)上市藥品上市后風(fēng)險(xiǎn)管理計(jì)劃的主要內(nèi)容
《藥品附條件批準(zhǔn)上市申請審評審批工作程序(試行) (修訂稿征求意見稿)》 [下文簡稱《工作程序(試行)(修訂稿征求意見稿)》]要求自附條件批準(zhǔn)上市起每12個(gè)月向藥審中心書面報(bào)告上市后研究進(jìn)展[10]。2020-2022年附條件批準(zhǔn)上市藥品中,6項(xiàng)上市后要求中明確需每年提交安全性報(bào)告,其他還包括按計(jì)劃、按 ICH E2或相關(guān)法規(guī)要求等提交安全性報(bào)告。如注射用卡瑞利珠單抗要求上市后2年內(nèi)每6個(gè)月提交安全性更新報(bào)告,2年后根據(jù)藥品的安全性情況對安全性更新報(bào)告的更新時(shí)限進(jìn)行重新要求[11]。
2.5 附條件批準(zhǔn)上市藥品納入醫(yī)保情況
我國附條件批準(zhǔn)上市與常規(guī)批準(zhǔn)上市的創(chuàng)新藥納入醫(yī)保情況基本相同。2014-2022年有44件(占43.56%)附條件上市的品種/ 適應(yīng)證納入醫(yī)保(截至2023年8 月),其中抗腫瘤藥物占比最高,為84.09% 。在程序上,附條件上市藥品僅在《醫(yī)保藥品目錄》中的備注欄顯示“該適應(yīng)證的完全批準(zhǔn)將取決于正在進(jìn)行的確證性臨床試驗(yàn)的結(jié)果”[12]。在時(shí)間上,從藥品或新增適應(yīng)證附條件上市至首次納入醫(yī)保的平均時(shí)間約為15個(gè)月,時(shí)間范圍為1-60個(gè)月,見圖7。

▲圖7-2014-2021年附條件上市的品種/適應(yīng)證納入醫(yī)保情況
3、 討論和建議
3.1 建立中藥附條件批準(zhǔn)上市的有效機(jī)制
我國附條件批準(zhǔn)上市藥品以化學(xué)藥和生物制品為主,中藥僅2項(xiàng)。中藥淫羊藿素軟膠囊和香雷糖足膏的附條件批準(zhǔn)一方面滿足了一定的臨床需求,另一方面也為推動(dòng)中藥研發(fā)和加快中藥審評審批改革開辟新思路。2021年2月,國務(wù)院辦公廳印發(fā)《關(guān)于加快中醫(yī)藥特色發(fā)展若干政策措施的通知》,強(qiáng)調(diào)要優(yōu)化中藥審評審批管理,“建立中藥新藥進(jìn)入快速審評審批通道的有效機(jī)制”[13]。淫羊藿素軟膠囊和香雷糖足膏為中藥附條件批準(zhǔn)上市提供了良好的探索,建議參考其經(jīng)驗(yàn),推動(dòng)建立中藥附條件批準(zhǔn)上市的有效機(jī)制。
3.2 完善附條件批準(zhǔn)程序與特別審批程序的銜接
通過數(shù)據(jù)統(tǒng)計(jì)分析,附條件批準(zhǔn)程序與其他加速審評程序的組合應(yīng)用可有效加快具有臨床價(jià)值的臨床急需藥品上市。目前,附條件批準(zhǔn)與優(yōu)先審評審批通過適用范圍形成銜接流程,納入突破性治療藥物程序的藥品可在申請上市許可時(shí)提出附條件批準(zhǔn)申請,但與特別審批未明確銜接程序。附條件批準(zhǔn)適用于危重疾病和公共衛(wèi)生方面急需的藥品和疫苗,而特別審批適用于突發(fā)公共衛(wèi)生事件急需藥品,在適用情形上二者存在交叉;在應(yīng)用中,2020-2023年共12件藥品品種/適應(yīng)證同時(shí)通過這2 條快速通道上市,但特別審批仍實(shí)行2005年發(fā)布的指導(dǎo)文件。建議監(jiān)管部門盡快修正《藥品特別審批程序》,增加與附條件批準(zhǔn)程序有效銜接的內(nèi)容,如在申請受理相關(guān)章節(jié)明確“對于特別審批的品種,申請人經(jīng)評估符合相關(guān)條件的,也可以在申請藥品上市許可時(shí)提出附條件批準(zhǔn)申請”。此外,參考優(yōu)先審評審批,在附條件批準(zhǔn)程序的適用范圍內(nèi)增加符合特別審批情形的藥品,形成兩程序間的有效銜接。
3.3 推動(dòng)相關(guān)指南的編纂和替代終點(diǎn)的開發(fā)并公開信息
支持附條件批準(zhǔn)的關(guān)鍵臨床試驗(yàn)主要是以O(shè)RR為終點(diǎn)指標(biāo)的Ⅱ期單臂臨床試驗(yàn)。ORR等替代終點(diǎn)存在可能無法證實(shí)與臨床結(jié)局存在真實(shí)因果關(guān)系的隱患,因此建議盡快發(fā)布我國替代終點(diǎn)驗(yàn)證認(rèn)定指南。同時(shí),參考?xì)W美等國家或地區(qū)政策,出臺相關(guān)政策鼓勵(lì)和引導(dǎo)多方參與替代終點(diǎn)的開發(fā)[14]。我國還應(yīng)定期公開替代終點(diǎn)相關(guān)數(shù)據(jù),根據(jù)疾病類型、研究進(jìn)展推薦替代終點(diǎn),以提高附條件批準(zhǔn)上市的效率[15]。
3.4 科學(xué)行使藥品審評自由裁量權(quán)
附條件批準(zhǔn)上市藥品的藥學(xué)要求與常規(guī)批準(zhǔn)上市藥品相同,但2020-2022 年附條件批準(zhǔn)藥品的上市后研究還包括藥學(xué)研究,這是因?yàn)樵趯?shí)際審評審批過程中,藥品附條件批準(zhǔn)的納入標(biāo)準(zhǔn)由多個(gè)因素共同影響,無法完全量化或固化,使藥審中心具有定的自由裁量權(quán)。但是,自由裁量權(quán)的不合理使用會(huì)放大附條件批準(zhǔn)固有的安全性和有效性風(fēng)險(xiǎn)[16]。藥品審評過程中自由裁量權(quán)的使用需要經(jīng)過科學(xué)評估,建議成立針對藥品附條件批準(zhǔn)的專家咨詢委員會(huì),并在附條件批準(zhǔn)的審評過程中至少召開一次專家咨詢會(huì),對附條件批準(zhǔn)藥品的審評提供技術(shù)支持和決策建議,以此協(xié)助藥審中心科學(xué)審查,使自由裁量權(quán)的行使更加科學(xué)合理。
3.5 持續(xù)完善附條件批準(zhǔn)上市程序
確證性臨床試驗(yàn)的完成率是附條件批準(zhǔn)上市制度最關(guān)注的風(fēng)險(xiǎn)之一,一項(xiàng)研究表明批準(zhǔn)前啟動(dòng)確證性臨床試驗(yàn)可能會(huì)使附條件批準(zhǔn)的藥品更早轉(zhuǎn)為完全批準(zhǔn)[17]。2020-2022年,附條件上市藥品存在部分藥品上市前未啟動(dòng)和已啟動(dòng)確證性臨床試驗(yàn)2種情況,而2023年8月發(fā)布的《工作程序(試行)(修訂稿征求意見稿)》要求提交附條件批準(zhǔn)上市申請前,申請人應(yīng)已啟動(dòng)確證性研究,原則上后續(xù)附條件批準(zhǔn)上市的藥品將不會(huì)存在批準(zhǔn)前未啟動(dòng)確證性臨床試驗(yàn)的情況。上市后要求的完善將保障確證性臨床試驗(yàn)的完成,降低公眾的用藥風(fēng)險(xiǎn)。但是,目前對上市后研究的要求比較籠統(tǒng),建議監(jiān)管部門規(guī)范細(xì)化上市后要求的相關(guān)條款,從風(fēng)險(xiǎn)防控的角度,根據(jù)不同種類藥品的風(fēng)險(xiǎn)差異化注冊證書中載明的條件,防止條款泛化。如參考美國加速批準(zhǔn)程序,按照抗腫瘤藥、抗傳染病藥、疫苗、非惡性血液學(xué)、神經(jīng)系統(tǒng)和其他分類,并針對不同種類藥品上市后研究的研究類型、終點(diǎn)指標(biāo)的選擇、受試者人群等進(jìn)行差異化要求和指導(dǎo)。
《藥品附條件批準(zhǔn)上市技術(shù)指導(dǎo)原則(試行) 》2020年版和《藥品附條件批準(zhǔn)上市申請審評審批工作流程(試行) 》 中未明確附條件批準(zhǔn)上市的上市許可有效期[18]。通過統(tǒng)計(jì)分析和文獻(xiàn)研究,在2020-2022年附條件批準(zhǔn)上市藥品的上市許可有效期最長為5年,但具體研究時(shí)限由溝通決定,根據(jù)2023年發(fā)布的《工作程序(試行) (修訂稿征求意見稿)》,完成時(shí)限原則上不超過4年,藥品注冊證書有效期為5年,并細(xì)化了注銷程序。研究時(shí)限的明確有助于企業(yè)按時(shí)完成上市后研究,但是目前尚缺乏對上市后研究的過程監(jiān)管。在研究中發(fā)現(xiàn),部分藥品正在進(jìn)行或已完成上市后要求的研究,表明能確證其預(yù)期的臨床獲益,附條件批準(zhǔn)上市程序在滿足臨床急需且保障用藥安全上具有一定成效。但部分藥品未查詢到相關(guān)研究的信息,不排除檢索問題、數(shù)據(jù)庫尚未納入相關(guān)信息、企業(yè)尚未上傳相關(guān)信息或尚未開啟該項(xiàng)研究等原因。因此,建議監(jiān)管部門加強(qiáng)過程監(jiān)管和信息公開,要求企業(yè)提交上市后研究計(jì)劃時(shí)間表,通過對重要時(shí)間節(jié)點(diǎn)的過程監(jiān)管保障上市后研究如期完成[19-20]。
3.6 基于風(fēng)險(xiǎn)分擔(dān)的醫(yī)保支付方式
通過統(tǒng)計(jì)分析和文獻(xiàn)研究,附條件批準(zhǔn)與常規(guī)批準(zhǔn)的創(chuàng)新藥在納入醫(yī)保的程序、時(shí)間等因素上基本相同。但是,附條件批準(zhǔn)藥品的安全性、有效性存在風(fēng)險(xiǎn),真實(shí)世界應(yīng)用結(jié)果尚不明確,且缺乏經(jīng)濟(jì)性數(shù)據(jù)。因此,針對附條件批準(zhǔn)藥品的特點(diǎn),建議醫(yī)保支付方可選擇風(fēng)險(xiǎn)分擔(dān)的醫(yī)保支付方式,如證據(jù)發(fā)展支付、按節(jié)點(diǎn)支付等,使藥品供付雙方分擔(dān)預(yù)算風(fēng)險(xiǎn)和健康風(fēng)險(xiǎn)[21]。
參考文獻(xiàn)
[1] 國家藥品監(jiān)督管理局藥品審評中心,藥品附條件批準(zhǔn)上市技術(shù)指導(dǎo)原則(試行)[EB/OL].(2020-11-19)[2023-07-19], hps://www,ede, arg, o/mnin/news'viewlnloComnond1716d106190c3a1034de337373622c.
[2] 宋茵茵,徐文峰,胡欣,等.我國附條件批準(zhǔn)上市抗腫瘤藥物探討[J],中國藥業(yè),2022,31(19):12-18.
[3] 唐輝,湯立達(dá).藥品附條件批準(zhǔn)上市的內(nèi)涵與風(fēng)險(xiǎn)防控[J]中國醫(yī)藥導(dǎo)刊,2021,23(4):289 -295.
[4] 國家藥品監(jiān)督管理局藥品審評中心,2020 年度藥品審評報(bào)告[EB0L].(2021-06-21)[2023-01-26]. hups://www.mmpa.gov,evsxgk/fgwj/gawj/gwiyp20210621142136183. hhml.
[5] 國家藥品監(jiān)督管理局藥品審評中心,2021年度藥品市評報(bào)告EEOL].(2022-06-01)[2023-01-26]. hups://www.mmpa.gov,avxxgk'fgwj/gawj/gwiyp20220601110641120. hhnl.
[6] 國家藥品監(jiān)督管理局藥品審評中心,2022 年度藥品審評報(bào)告EW0L].(2023-09-06)[2023 -09-09]. hips://www.mpa.gov,avxgk'fgwygwj/gwyp20230906163722146, himl.
[7] 國家藥品監(jiān)督管理局藥品市評中心,2023 年度藥品審評報(bào)告[EEOL].(2024-02-04)[2024-03-091. hps://www.mmpa.go,exxgkfgwjgaj/gwy2021004154334141. htm.[8] 國家藥品監(jiān)督管理局藥品審評中心,替雷利珠單抗注射液(CXSS1900025)申諧上市技術(shù)審評報(bào)告[21.2020.
[9] 國家藥品監(jiān)督管理局藥品審評中心,甲磺酸奧美替尼片CXHSI900011)申請上市技術(shù)審評報(bào)告[21.2020.
[10] 國家藥品監(jiān)督管理局,藥品附條件批準(zhǔn)上市申請市評審批工作程序(試行)(修訂稿征求意見稿)[EB/0L].(2023-08-25)[2023-08-26],hps ://www. mupa. gov.en/xxgk/zlwgyjzhwyjyp20230825104212129.him1.
[11] 國家藥品監(jiān)督管理局藥品審評中心,注射用卡瑞利珠單抗CXSS1900023)申請上市技術(shù)審評報(bào)告[Z1.2020.
[12] 周菁菁,黃夢琴,孫志明,等.附條件批準(zhǔn)上市藥品納入基本醫(yī)療保險(xiǎn)藥品目錄的政策風(fēng)險(xiǎn)分析[11,醫(yī)學(xué)與社會(huì)2023.36(1):99-104.
[13] 國務(wù)院辦公廳,國務(wù)院辦公廳印發(fā)《關(guān)于加快中醫(yī)藥特色發(fā)展若干政策措施的通知》[EB/0L].[2021-02-03].hps://www.gov,ozlungezlunpeek2021-02/09/c0nlent_5586278. him.
[14] 孫字昕,魏芬芳,楊悅,美國FDA 藥品市評中替代終點(diǎn)開發(fā)寫應(yīng)用[J1,中國藥學(xué)雜志,2017.52(5):414-419.
[15] 楊莉,書彥伊,吳迪,等.美國和歐盟基于替代終點(diǎn)的新藥上市市批程序研究及啟示[J1.中國新藥雜志,2022.31(2):132 -141
[16] SMITH JA, BRINDLEY DA. Coritional approval pathways: theSpoial"ease of global regenerative medicine regulalion [ J].Rejnenwlio Re,2017,20(1):1-3.
[17] SHAHZAD M,NACI H,WAGNER AK, Asocialion beweenprapproval confinnalory trial iniliation and eonversion to tradi.tional approval or withrawal in the FDA aecelerated approva!pahway[1l.JAMA,2023,329(9):760-761.
[18] 國家藥品監(jiān)督管理局藥品審評中心,藥品附條件批準(zhǔn)上市申請審評審批工作程序(試行)[EB/0L].(2020-07-07)[2021-03-01].hips://www.nmpa.gov.en/xxgk/fgwj/xhgKwj/20200708151701834.hm1.[19]張曉方,白雪,孫婉,等.2015-2020 年美國加速審批與歐洲附條件批準(zhǔn)的上市所附條件特點(diǎn)[J].中國新藥雜志,2024.33(8):737-744.
[20] 張曉方,白雪,孫婉,等,2015-2020 年美國加速審批與歐洲附條件批準(zhǔn)的上市前有效性科學(xué)證據(jù)特點(diǎn)[J.中國新藥雜志,2024,33(1):1-9.
[21] 劉昭,張帆,向貴圓,等,基于風(fēng)險(xiǎn)管理的創(chuàng)新藥支付準(zhǔn)入案例分析及實(shí)施建議[J],中國醫(yī)療保險(xiǎn),2022(4):22-27.

來源:中國新藥雜志


