您當(dāng)前的位置:檢測資訊 > 生產(chǎn)品管
嘉峪檢測網(wǎng) 2024-08-08 23:18
結(jié)合藥品生產(chǎn)企業(yè)化學(xué)藥品注射劑滅菌驗證實例,通過空載熱分布、滿載熱分布、熱穿透試驗、滅菌前微生物負荷檢測、挑戰(zhàn)試驗結(jié)果以及滅菌驗證的總體效果進行分析和總結(jié),筆者認為該滅菌驗證基本上能夠確保終端滅菌注射劑無菌保證水平,但要更加重視通過滅菌驗證的結(jié)果制定后期生產(chǎn)質(zhì)量管理措施,在保證無菌保證水平的基礎(chǔ)上,根據(jù)風(fēng)險進一步提升質(zhì)量管理水平。
注射劑是將主藥成分用適宜的溶劑溶解、混懸、乳化包合等制備,或者再次冷凍干燥后,用于肌內(nèi)、血管靜脈、椎管等注射給藥的劑型,一般分為注射液和注射用無菌粉末。由于注射劑注射給藥后直接進入人體組織、甚至直接進入血液循環(huán)系統(tǒng),達到快速起效的目的,所以注射劑對安全性要求更加嚴格,其中無菌檢查就是注射劑最為重要的一項質(zhì)量控制指標(biāo),注射液的無菌生產(chǎn)一般分為終端滅菌、過濾除菌、無菌生產(chǎn)三種工藝方式,其中終端滅菌最為常見,即濕熱滅菌工藝,為了保證濕熱滅菌的有效性,必須對濕熱滅菌工藝進行滅菌工藝驗證[1],本文就某一企業(yè)化學(xué)藥品注射劑終端滅菌工藝驗證實例進行探討分析,并結(jié)合作者自己的幾點思考,與業(yè)內(nèi)各位專家同仁、以及企業(yè)各位同行老師進行分享。現(xiàn)將企業(yè)對于其化學(xué)藥品注射劑滅菌工藝驗證的具體情況報道如下。
Part.01 基本情況簡介
本次驗證前該車間的工藝用水系統(tǒng)、HVAC 系統(tǒng)和壓縮空氣系統(tǒng)均通過相關(guān)驗證并處在受控狀態(tài); 包括安瓿水浴滅菌器在內(nèi)的所有生產(chǎn)設(shè)備均已完成相關(guān)驗證; 本驗證前有關(guān)計量儀器、儀表均經(jīng)校驗合格; 所需的原輔料已檢驗合格,所需生產(chǎn)設(shè)備、工器具均已清潔,所有的操作人員均已進行各項培訓(xùn),滿足 GMP 標(biāo)準(zhǔn)。
此次驗證注射液產(chǎn)品包裝材料為 20mL 低硼硅玻璃安瓿,每批批量 20000 支,滅菌柜內(nèi)樣品裝載方式為 1 柜×2 車×6 筐/層×6 層×257 瓶,滿載 18504 瓶,去除管道損耗藥液批生產(chǎn)量達不到滿柜時,以相同規(guī)格的色水瓶補充至滿柜。滅菌參數(shù)為 121℃ 水浴滅菌 12min,按照制定的滅菌工藝和標(biāo)準(zhǔn)操作規(guī)程生產(chǎn) 3 個批次,具體為此滅菌設(shè)備的 3 次空載熱分布試驗、該規(guī)格包材色水瓶的 3 次滿載熱分布試驗、該規(guī)格產(chǎn)品的 3 次載熱穿透測試及 3 次微生物挑戰(zhàn)試驗,并對滅菌前的微生物進行考察,確認驗證結(jié)果的合理有效性。驗證項目及可接受標(biāo)準(zhǔn)見表1。

表1 驗證項目及可接受標(biāo)準(zhǔn)明細表
Part.02 驗證探頭分布情況
將 16 支已校準(zhǔn)的溫度探頭通過驗證接口引入滅菌腔室內(nèi),準(zhǔn)備好 16 瓶 20mL 西林瓶內(nèi)裝有 20mL 藥液,將膠塞全部壓入西林瓶后人工鎖蓋,保證藥液不外流。西林瓶啟蓋后將溫度探頭插入 20mL 西林瓶中( 用西林瓶替代安瓿瓶,西林瓶內(nèi)裝有與產(chǎn)品規(guī)格、濃度相同的藥液) ,1 ~ 16 號探頭按照驗證要求均勻分布在腔室各處,具體見圖1。
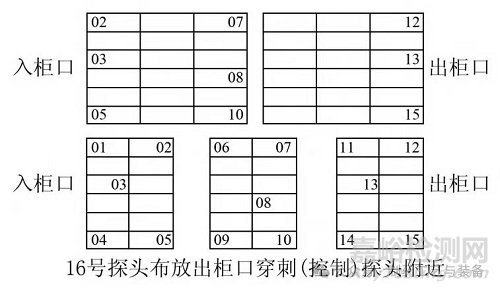
圖1 檢測探頭分布點示意圖
Part.03 空載熱分布試驗
滅菌柜內(nèi)空載,按照《**車間滅菌崗位標(biāo)準(zhǔn)操作規(guī)程》、《**車間機動門安瓿水浴滅菌器的使用清潔標(biāo)準(zhǔn)操作規(guī)程》進行操作,檢查提供的冷卻水、壓縮空氣、純化水、工業(yè)蒸汽均在使用范圍內(nèi),啟動滅菌設(shè)備,同時啟動溫度驗證系統(tǒng)進行數(shù)據(jù)采集,數(shù)據(jù)采集時間間隔 30 秒。數(shù)據(jù)采集時間不小于滅菌器的工作周期。進行 3 次空載熱分布試驗,以檢查數(shù)據(jù)結(jié)果的重現(xiàn)性。將 3 次空載熱分布的測試結(jié)果和采集的數(shù)據(jù)進行統(tǒng)計分析,最終確認的冷點位置及熱點位置,具體見表2。結(jié)果表明,該滅菌柜內(nèi)空載狀態(tài)下熱分布均勻,滿足驗證預(yù)期要求。

表2 空載熱分布試驗結(jié)果表 (℃)
Part.04 滿載熱分布試驗
將滅菌柜內(nèi)按照擬定的裝載方式裝滿 20mL 玻璃安瓿裝的色水瓶,按照上述操作規(guī)程進行操作,檢查提供的冷卻水、壓縮空氣、純化水、工業(yè)蒸汽均在使用范圍內(nèi),啟動滅菌設(shè)備,同時啟動溫度驗證系統(tǒng)進行數(shù)據(jù)采集,數(shù)據(jù)采集時間間隔 30 秒。數(shù)據(jù)采集時間不小于滅菌器的工作周期。進行3次滿載熱分布測試,以檢查數(shù)據(jù)結(jié)果的重現(xiàn)性。將 3 次滿載熱分布的測試結(jié)果和采集的數(shù)據(jù)進行統(tǒng)計分析,將最終確認的冷點位置及熱點位置,具體見表3。結(jié)果表明,該滅菌柜內(nèi)滿載狀態(tài)下熱分布均勻,滿足驗證預(yù)期要求。

表3 滿載熱分布試驗結(jié)果表 (℃)
Part.05 熱穿透試驗
將滅菌柜內(nèi)按照擬定的裝載方式裝滿 20mL 玻璃安瓿裝的本次生產(chǎn)樣品,由于生產(chǎn)管道藥液損耗,不滿柜時使用相同規(guī)格的色水瓶填滿,按照上述操作規(guī)程進行操作,檢查提供的冷卻水、壓縮空氣、純化水、工業(yè)蒸汽均在使用范圍內(nèi),啟動滅菌設(shè)備,同時啟動溫度驗證系統(tǒng)進行數(shù)據(jù)采集,數(shù)據(jù)采集時間間隔 30 秒。數(shù)據(jù)采集時間不小于滅菌器的工作周期。進行 3 次熱穿透試驗,以檢查數(shù)據(jù)結(jié)果的重現(xiàn)性。將 3 次熱穿透的測試結(jié)果和采集的數(shù)據(jù)進行統(tǒng)計分析,將最終確認的冷點位置及熱點位置,具體見表4。結(jié)果表明,柜內(nèi)溫度分布均勻,三批次滅菌最小F0值均大于12,熱穿透試驗滿足驗證預(yù)期要求,三次驗證冷點均為 15 號探頭,熱點為06、07號探頭位置。

表4 熱穿透試驗結(jié)果表 (℃)
Part.06 微生物挑戰(zhàn)試驗
在進行熱穿透試驗的同時進行微生物挑戰(zhàn)試驗。在每個溫度探頭布放的位置放置 1 支壓力蒸汽滅菌生物指示劑。對每支指示劑進行編號,生物指示劑的編號與相應(yīng)的溫度探頭編號一致。滅菌后取出做好標(biāo)記,易于識別驗證批次。置于56 ~ 60℃培養(yǎng)箱中培養(yǎng) 7 天。并另取一支未滅菌的生物指示劑同時培養(yǎng),作為陽性對照。微生物挑戰(zhàn)性試驗與負載熱穿透測試同步進行 3 次,以證明滅菌效果的重現(xiàn)性。結(jié)果表明,培養(yǎng)后經(jīng)滅菌的所有生物指示劑全部保持紫色; 所有對照品均由紫色變?yōu)辄S色,微生物挑戰(zhàn)試驗符合驗證預(yù)期要求。
Part.07 滅菌前微生物負荷檢測
穿透試驗驗證批作為考察批次,在每一柜滅菌前取灌裝好的成品最后 10 支,依《微生物限度檢查法標(biāo)準(zhǔn)操作規(guī)程》薄膜法,用滅菌的 5% 吐溫充分潤濕濾膜,取 100mL 樣品過膜,依《各品種、劑型微生物限度檢查法標(biāo)準(zhǔn)操作規(guī)程》檢驗,取膜,細菌置營養(yǎng)瓊脂培養(yǎng)基平板上,霉菌和酵母菌置玫瑰紅鈉培養(yǎng)基平板上,依《微生物限度檢查法標(biāo)準(zhǔn)操作規(guī)程》分別培養(yǎng)計數(shù)。結(jié)果表明,三批藥液每 100mL 含微生物總數(shù)均不超過 10CFU,滿足驗證預(yù)期要求。
Part.08 討論
終端滅菌工序是化學(xué)藥品注射劑藥品生產(chǎn)過程中最為重要的關(guān)鍵工藝,企業(yè)應(yīng)該在藥品研發(fā)階段、生產(chǎn)階段、上市后監(jiān)測等藥品全生命周期管理中予以重視,結(jié)合企業(yè)滅菌驗證實例,個人總結(jié)思考如下幾點與業(yè)內(nèi)各位同仁、企業(yè)各位同行分享:
①注射劑生產(chǎn)車間均為多品種共線生產(chǎn),在同一個滅菌柜內(nèi)也會生產(chǎn)滅菌多個品種、多個規(guī)格的品種,滅菌驗證中應(yīng)充分開展風(fēng)險評估,開展基于風(fēng)險評估的驗證方案設(shè)計,如耐熱性、黏度最大產(chǎn)品的滅菌驗證可代表低水平產(chǎn)品,最大、最小濃度處方產(chǎn)品的滅菌驗證可代表中間濃度產(chǎn)品,最大裝量的最大容器和最小裝量的最小容器產(chǎn)品的滅菌驗證可代表中等規(guī)格及中等容器的產(chǎn)品等[2],確保風(fēng)險控制措施與收益整體平衡。
②參照歐盟滅菌決策樹和國家局藥審中心審評要求,能耐受終端滅菌的藥品必須選用 F0 大于 8 以上的滅菌方式,企業(yè)在新產(chǎn)品研發(fā)和變更研究中加以注意。
③通過滅菌驗證得出的冷熱點,在藥品生產(chǎn)過程中,要加以管理運用,如在取樣控制中應(yīng)在冷點位置取樣進行無菌檢查,在熱點位置取樣進行有關(guān)物質(zhì)檢查,并對多批次數(shù)據(jù)進行分析,進一步加強質(zhì)量管理水平。
④終端滅菌是雖然能夠通過過度殺滅微生物達到注射劑無菌保證,但絕不能完全依賴最終滅菌,在生產(chǎn)各個工序均需要加以管理,嚴格控制滅菌前微生物水平,并關(guān)注滅菌前微生物種類變化,以降低質(zhì)量風(fēng)險。
參考文獻:
[1] 許真玉.化學(xué)藥品注射劑濕熱滅菌工藝的研究與驗證[J].現(xiàn)代藥物與臨床,2009,24(5) : 301-305.
[2] 趙娜.化學(xué)藥品注射劑滅菌工藝研究及驗證的基本考慮[J].中國新藥雜志,2021,30(16) : 1456-1459.

來源:Internet


