您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-07-15 09:07
一、注冊起始物料(RSM)的法規層面基本考量
注冊起始原料(Registering Starting Material)既是原料藥注冊申請通用技術文件(CTD格式)中工藝描述的出發點,也是藥品生產質量管理規范(GMP)第一次實施的引入點,還是今后藥品生命周期管理的起始點。對于化學合成原料藥而言,起始原料的選擇是一個首要的問題,也是原料藥藥學(CMC)審評部分的重點及難點。
起始原料的選擇若不被監管機構所接受,將可能嚴重影響原料藥的審評進程。若最終重新定義起始原料,將擬定的申報工藝前移,原擬定的起始原料作為更新后申報路線的GMP中間體,則需要重新提供新擬定的起始原料相關信息,包括但不限于制備路線(如,詳細的工藝流程圖)、質量標準及質量研究等,還需要根據對生產工藝的研究及理解,評估原制訂的原料藥控制策略,比如有關物質(有機雜質、無機雜質、殘留溶劑、元素雜質、潛在致突變性雜質等),在新擬定的起始原料基礎條件下是否需要進行相應的調整。
申請人在選擇和論證起始原料時應當綜合考慮所有的ICH Q11 原則,而不是只選擇使用少數幾個原則來論證起始原料。如果所選起始原料不符合所有的基本原則,則應該給出合理解釋說明,同時提供相應的合理論據,以說明擬定的該起始原料是合適的。
在ICH Q11 中所述的“起始原料”與ICH Q7 中所述的“原料藥起始原料”沒有差異。ICH Q11 選擇起始原料的基本原則適用于線性和匯聚式合成起始原料的選擇。ICH Q11 選擇起始原料的基本原則適用于發生多個化學變化但沒有分離出中間體的工藝,未分離的中間體通常不被考慮作為合適的起始原料。
ICH Q11 明確指出了市售化學品和定制合成化學品之間的區別。ICH Q11 聲明“市售化學品通常是指除了擬定用作起始原料外,作為已存在的、有非藥用市場進行銷售的商品”。“非藥用市場”是為了排除那些聲稱作為市售化學品的中間體。ICH Q11并未給出“定制合成化學品”的定義,但是定制合成化學品通常理解為某個原料藥生產商的需求而特別生產定制的,可以是自制或者外包生產,或者是可供購買但只用于藥物生產。如果使用市售化學品作為起始原料,申請人通常不需要論證,而如果使用了定制合成化學品作為起始原料,則需要根據ICH Q11 基本原則進行合理性的論證。
與此同時,對于外購的起始原料,需要提供起始原料生產商出具的制備工藝(包含工藝描述及其工藝流程圖、生產過程使用的溶劑試劑等相關證明性文件),并根據相關技術指導原則、技術審評要求對雜質進行全面的分析和控制,制訂合理的質量標準,并充分論述質量標準(尤其是常規的重點關注檢測項:如有關物質、含量、對映異構體等)的制定依據,并提供代表性批次起始原料的檢測數據、放行報告及相關圖譜等。同時對所有申報的起始原料應制定供應商審計計劃,并提供審計報告(上市批準前的核查批次使用*)。
*PAI(上市批準前核查),目前國內創新藥的常規模式有二合一(即注冊核查與GMP符合性檢查一同進行)、注冊核查與GMP符合性檢查分開進行。注:注冊核查由CFDI負責,GMP符合性檢查由省局主導開展。
二、注冊起始物料(RSM)質量控制的基本要求
在ICH Q11中明確了以下幾點質量控制及管理的基本要求:
1.明確了雜質含量水平對原料藥雜質譜有影響的定義,以及ICH Q11例4中“持續存在”雜質的定義。說明對于工藝上游中早期形成的,經多步步驟后仍“持續存在”的雜質,可以基于一定的科學認知和風險評估,制訂相應的控制策略,并非必需將此雜質的形成步驟納入起始物料的申報工藝中。
2.明確了如何確定哪些工藝步驟會影響原料藥的致突變性雜質譜。同時,并不建議將涉及致突變性雜質的所有步驟、或涉及區域選擇性/立體選擇性的所有步驟均包括在起始物料的申報工藝描述中。
3.明確了評估是否包括足夠工藝步驟所應考慮的事項,同時建議應保證在GMP條件下能有足夠的工藝步驟,以降低潛在交叉污染或以后起始原料相應變更(如,合成路線、供應商)所帶來的潛在風險。
三、注冊起始物料(RSM)選擇依據的主要論述點
● 起始物料為原料藥結構的重要組成片段,且經過了一定的分離純化工序,同時起始物料必須具備明確的化學特性和結構,且物料通常較穩定。
● 起始物料的上游步驟不影響原料藥的雜質譜(除了含有某個持續存在雜質以外)。
● 起始物料的雜質譜已明晰,雜質的轉化與清除環節均已明確且制定了相應的控制策略。
● 起始物料建立了有效的分析檢測方法,具有良好的雜質檢測分離能力,確保起始物料的質量,從而不影響原料藥的質量。
● 完成外購起始物料供應商的質量審計,以保證供應商的起始物料對原料藥質量的影響始終處于較可控的狀態。
四、注冊起始物料(RSM)評估工具及應用簡述
2017年Wigman等人Roche、Genentech和 Chugai Pharmaceutical 首次發布風險評估工具來評估潛在RSM。通過基于以下內容的評分系統評價參考工具中擬定的RSM。
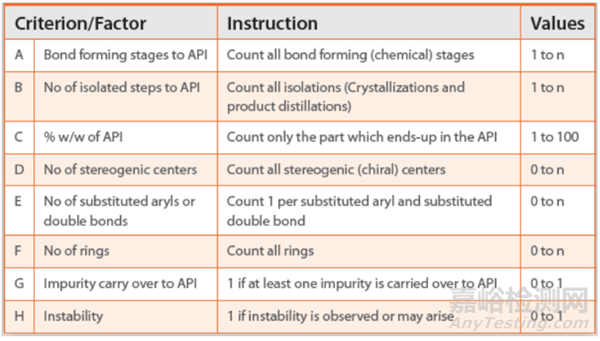
總體風險評分計算為4/A + 8/B + 0.6 C + D + E + F + G + H,評分等級分為<8、8-10和>10, 分別被視為低風險、中等風險和高風險。
案例:—Vemurafenib

工具2(僅略作介紹,實際的可參考性較弱于工具1):

2019年,Eli Lilly發布了一種基于模型的工具,該工具源自偏最小二乘加判別的方法,該方法考慮了40個被認為可能導致 RSM 認定風險的不同分子和途徑屬性。該模型評價RSM風險主要基于RSM的復雜性和雜質風險評分兩個方面:


評估工具的案例情況:
使用兩種工具進行起始物料選擇的風險,打分情況因各工具評估維度的不同而存在一些差異,整體的風險評估結論也會有所差異,最終論證各起始物料選擇的充分性還需根據項目實際情況進行各評估維度的風險論述,說明相應的潛在風險點是否已合理控制且處于持續可控狀態,對原料藥的質量風險為低,進一步證實起始物料選擇的合理性。

文章小結:
起始物料的選擇及質量控制是原料藥開發的重要組成部分,其定義和選擇是CMC研究的一個重要部分,也是NDA注冊審評中CDE、FDA和EMA等官方審評機構關注的一個永久性話題。近20多年來,在原料藥注冊技術文件要求中,這一話題一直廣受關注。隨著ICH Q11 指導原則的出臺,ICH 各地區對起始物料選擇的基本原則及質量控制要求已基本達成共識。
鑒于起始物料的重要性,各監管機構在原料藥CMC的技術審評中均給予了高度關注。歐洲EDQM 發布的統計信息顯示,CEP 證書新申請首輪審評發現的十大缺陷中,起始物料的選擇問題位列第2 位,而位列第1 位的缺陷也涉及起始物料的雜質問題。
對于起始物料選擇的合理性問題,本文提供了兩種風險評估工具供參考,論述的重點在于按照ICH指導原則中對起始物料的相關考量要求。在美國FDA 仿制藥(ANDA) 審評中,確定起始物料也被視為一個棘手的問題;對于新藥申請(NDA),FDA 則與申請人提前溝通,雙方通常會在Ⅱ期臨床末的會議(IND End-of-Phase 2 meeting) 或者新藥申請提交之前的會議( pre-NDA meeting) 上對起始物料的相關問題達成共識,申請人會提前與CDE進行溝通,會在Ⅱ期臨床末的會議(IND End-of-Phase 2 meeting)中進行進一步的溝通,最終會在新藥申請提交之前的會議( pre-NDA meeting) 上對起始物料的問題達成共識,同時針對官方在NDA審評階段要求起始物料前延的潛在風險做好預案策略,降低因起始物料選擇不合適、前延起始物料的發補項而影響注冊審評的進度,最終影響新藥上市獲批的里程碑節點。
基于以上討論章節中對起始物料的法規層面基本考量、質量控制的基本要求以及選擇依據的主要論述點,在申報資料中,建議在3.2.S.2.3物料控制的起始物料章節中納入以下幾部分內容,1)起始物料生產商的名稱和地址,并提供包括雜質譜在內的完整的質量標準;2)起始物料的生產信息,包括涵蓋足夠多合成步驟的工藝流程圖,明確工藝中使用的溶劑、試劑和催化劑;3)各起始物料的質量標準、分析方法和檢驗報告,質量標準中除鑒別、含量等項目外,應特別關注對有關物質的質量控制;4)不同來源或采用不同工藝生產的起始物料可能有不同的雜質譜,如起始物料有多個來源或多種生產工藝/合成路線等,應分別提供相關的信息,并基于研究數據分析起始物料來源、工藝的不同對原料藥質量的影響;5)原料藥生產廠如需要對起始物料進行精制,精制工藝應包含在原料藥的生產工藝描述中,并提供起始物料精制前后的質量標準。
CDE技術審評常見案例分享(起始物料相關問題):
常見問題1:請參照ICH M7、S9 等指導原則,基于本品的受試人群,結合起始物料以及本品制備工藝,酌情考慮開展遺傳毒性警示結構雜質的研究,按照相關技術要求進行臨床樣品的控制。
常見問題2:現行起始原料雜質控制較為寬泛,臨床試驗樣品采用的原料藥的起始原料雜質水平“不得高于”毒理批次原料藥的起始原料雜質水平。
常見問題3:請伴隨臨床研究進展及工藝研究的深入,參照ICH Q11 等技術要求合理指定本品起始原料(起始物料XXX和XXX結構相對較為復雜,建議前延),加強本品制備過程中主要雜質來源、轉化、清除研究以及控制,關注起始原料和中間體有關物質方法對潛在雜質的分離檢測能力,繼續累積雜質檢測數據,在此基礎上制定合理的起始原料質量標準。

來源:注冊圈


