您當前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2024-04-26 08:11
更多醫(yī)藥技術(shù)資訊,請點擊醫(yī)藥專欄:http://drug.anytesting.com/ 歡迎關(guān)注文末微信公眾號:藥研檢測drugtest
今日頭條
常山生化GLP-1R激動劑報產(chǎn)。河北常山生化藥業(yè)旗下常山凱捷健生物提交的艾本那肽注射液上市申請獲CDE受理,擬用于在飲食控制和運動基礎(chǔ)上改善2型糖尿病患者的血糖控制。艾本那肽注射液是一款長效GLP-1受體激動劑,此前已在中國2型糖尿病患者中開展的III期臨床研究中達到了主要終點和關(guān)鍵次要終點。患者接受艾本那肽注射液治療24周后,其血糖水平顯著降低,且療效維持長達52周。
國內(nèi)藥訊
1.君實PD-1單抗在香港報產(chǎn)。君實生物PD-1抑制劑特瑞普利單抗向香港衛(wèi)生署藥物辦公室(DO)提交上市申請并獲得受理,擬聯(lián)合順鉑/吉西他濱一線治療轉(zhuǎn)移性或復(fù)發(fā)性局部晚期鼻咽癌成人患者,以及單藥治療復(fù)發(fā)性、不可切除或轉(zhuǎn)移性鼻咽癌。在Ⅲ期臨床JUPITER-02中,特瑞普利單抗聯(lián)合化療使患者的疾病進展或死亡風(fēng)險降低48%,死亡風(fēng)險降低37%。
2.科倫博泰ADC亮相ASCO。科倫博泰宣布將在ASCO2024年會上口頭報告Trop2 ADC新藥SKB264兩項臨床研究的最新數(shù)據(jù)。這兩項臨床分別為:SKB264用于治療局部復(fù)發(fā)性或轉(zhuǎn)移性三陰乳腺癌經(jīng)治患者的Ⅲ期臨床OptiTROP-Breast01;SKB264聯(lián)合PD-L1單抗KL-A167一線治療晚期非小細胞肺癌患者的Ⅱ期臨床OptiTROP-Lung01。SKB264是科倫博泰采用專有毒素-連接子策略研發(fā)的一款創(chuàng)新ADC,抗體藥物偶聯(lián)比(DAR)平均值高達7.4。
3.和譽肝癌新藥獲孤兒藥資格。和譽醫(yī)藥自主研發(fā)的小分子FGFR4抑制劑依帕戈替尼(irpagratinib/ABSK011)獲FDA授予孤兒藥資格,用于治療肝細胞癌(HCC)。在具有過表達FGF19的HCC細胞中,ABSK011可以通過抑制FGFR4的自身磷酸化并阻斷FGFR4向下游通路活化的信號轉(zhuǎn)導(dǎo),最終抑制HCC患者的腫瘤。臨床數(shù)據(jù)顯示,ABSK011(每日兩次)治療的客觀緩解率(ORR)達40.7%。
4.康方雙抗實體瘤早期臨床積極。康方生物PD-1/VEGF雙抗依沃西(AK112/SMT112)在治療晚期實體瘤(包括卵巢漿液性癌、MSS結(jié)直腸癌和其他癌癥)的Ⅰa期臨床中獲積極結(jié)果。中位隨訪為12.8個月時,依沃西在這類被認為對單藥免疫治療缺乏響應(yīng)的腫瘤患者中達到了25.5%的客觀緩解率(ORR),疾病控制率(DCR)為63.8%,且具有良好的安全性。詳細數(shù)據(jù)已發(fā)表于《癌癥免疫治療雜志》(JITC)期刊上。
5.通化東寶雙靶點減肥藥獲批臨床。通化東寶1類化藥注射用THDBH120獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬開發(fā)用于超重/肥胖患者的長期體重管理。THDBH120是一款GLP-1/GIP雙靶點激動劑,通過分子設(shè)計將GLP-1和GIP這兩種促胰島素的作用整合至一個多肽分子中,同時提高了代謝穩(wěn)定性,從而改善血糖控制。去年年底,該新藥已獲批開展用于治療2型糖尿病的臨床研究。
6.邁諾威病理性瘢痕新藥獲批IND。邁諾威醫(yī)藥擬用于預(yù)防和治療病理性瘢痕的創(chuàng)新藥MI151凝膠獲FDA臨床許可。MI151可抑制成纖維細胞增殖和TGF-β1的產(chǎn)生,同時可以影響TNF-α、IL-1β等炎癥細胞因子和粘附分子的產(chǎn)生以及基質(zhì)重塑因子的表達,有望通過抗炎和抗纖維化的雙重作用來治療瘢痕。在臨床前研究中,MI151已顯示出積極治療效果;且具有良好的安全性。
7.藍納成生物完成3億元B+輪融資。東誠藥業(yè)宣布,旗下藍納成生物已完成B+輪融資金額3億元,將適時開展IPO融資上市。藍納成由東誠藥業(yè)與國際分子影像及納米醫(yī)學(xué)領(lǐng)域?qū)<谊愋≡淌诼?lián)合創(chuàng)立。目前,該公司多個用于癌癥的1類診療一體化創(chuàng)新藥物已進入臨床階段,包括:靶向PSMA的放射性體內(nèi)治療藥物177Lu-LNC1003注射液、用于前列腺癌診斷的1類創(chuàng)新核藥氟[18F]思睿肽注射液、伴隨診斷試劑68Ga-FAPI-46注射液、靶向FAP的放射性體內(nèi)診斷藥物氟[18F]纖抑素注射液、靶向FAP的放射性體內(nèi)治療藥物177Lu-LNC1004注射液等。
國際藥訊
1.Utility公司創(chuàng)新抗生素獲批上市。Utility公司口服β-內(nèi)酰胺抗生素pivmecillinam(商品名為Pivya)獲FDA批準上市,用于治療由大腸桿菌、奇異變形桿菌和腐生葡萄球菌引起的非復(fù)雜性尿路感染(UTIs)。Pivmecillinam是mecilinam的前體化合物,它通過干擾細菌細胞壁的合成來殺死細菌。在臨床試驗中,Pivya治療相比安慰劑提高了患者的綜合反應(yīng)率(62%vs10%);與布洛芬相比,Pivya組患者的綜合反應(yīng)率也顯著提高(66%vs22%)。
2.諾華放射性配體療法獲批用于兒童。諾華放射性配體療法Lutathera(Lu 177 dotatate)獲FDA批準擴展適用范圍,用于治療生長抑素受體陽性(SSTR+)胃腸胰神經(jīng)內(nèi)分泌腫瘤(GEP-NET)的兒童(12-18歲)患者。Lutathera是首款FDA批準的放射性配體療法,能結(jié)合腫瘤細胞表面的生長抑素受體進入細胞,通過放射性對腫瘤細胞造成損傷。2018年,F(xiàn)DA已批準該藥物用于治療經(jīng)治SSTR陽性的GEP-NET患者。
3.安斯泰來前列腺癌新藥獲批新適應(yīng)癥。安斯泰來AR抑制劑恩扎盧胺(enzalutamide)獲歐盟委員會(EC)批準新適應(yīng)癥,單藥或與雄激素剝奪治療(ADT)聯(lián)合,用于不適合挽救性放療的高風(fēng)險生化復(fù)發(fā)性(BCR)、非轉(zhuǎn)移性激素敏感性前列腺癌(nmHSPC)成年男性。在Ⅲ期EMBARK試驗中,與亮丙瑞林相比,恩扎盧胺單藥或與亮丙瑞林聯(lián)合用藥分別降低了36.9%和57.6%的癌癥擴散或死亡的風(fēng)險。
4.Endeavor公司融資開發(fā)肺纖維化新藥。Endeavor公司宣布完成1.325億美元的C輪融資,以用于加速其小分子抑制劑ENV-101以及HER3靶向抗體偶聯(lián)藥物(ADC)ENV-501的臨床開發(fā)。ENV-101旨在通過抑制過度激活的Hedgehog(Hh)信號通路來提高患者的肺功能,并逆轉(zhuǎn)特發(fā)性肺纖維化(IPF)和進行性肺纖維化(PPF)患者肺部的纖維化,該新藥目前已處于Ⅱ期臨床階段。此外,Endeavor也計劃在今年啟動ENV-501的Ⅰ/Ⅱ期臨床試驗。
5.癌癥小分子藥物公司Flindr完成A輪融資。Flindr Therapeutics宣布完成2000萬歐元的A輪融資,主要用于加速其靶向RNF31的潛在“first-in-class”小分子抑制劑的開發(fā),應(yīng)用于實體瘤和血液惡性腫瘤的治療。在臨床前研究中,該候選藥物已在卵巢癌和B細胞淋巴瘤模型中顯示出抗腫瘤活性,并識別相關(guān)生物標記。此輪融資還將用于該公司使用ImmunoGram藥物發(fā)現(xiàn)引擎拓寬其產(chǎn)品管線。
6.罕見皮膚病創(chuàng)新基因療法被FDA拒批。Abeona公司基因療法prademagene zamikeracel(pz-cel)用于治療隱性營養(yǎng)不良性大皰性表皮松解癥(RDEB)的上市申請收到FDA發(fā)出的完整回復(fù)函(CRL)。FDA要求Abeona必須在申請獲得批準之前,“令人滿意地解決”CMC問題,提供額外CMC信息。pz-cel是一款自體、COL7A1基因校正表皮片,利用逆轉(zhuǎn)錄病毒載體將產(chǎn)生膠原蛋白的功能性COL7A1基因送入患者自身的皮膚細胞。
醫(yī)藥熱點
1.湘雅二醫(yī)院將建設(shè)國家緊急醫(yī)學(xué)救援基地。4月24日,國家衛(wèi)健委官網(wǎng)發(fā)布了關(guān)于中南大學(xué)湘雅二醫(yī)院國家緊急醫(yī)學(xué)救援基地建設(shè)工程可行性研究報告的批復(fù)。國家衛(wèi)健委原則同意中南大學(xué)湘雅二醫(yī)院國家緊急醫(yī)學(xué)救援基地建設(shè)工程可行性研究報告。據(jù)批復(fù),該院主要建設(shè)內(nèi)容為批量傷員救治、立體救治轉(zhuǎn)運、應(yīng)急指揮、培訓(xùn)演練、物資倉儲等緊急醫(yī)學(xué)救援相關(guān)業(yè)務(wù)用房及配套設(shè)施,建筑面積為81470平方米。其中,地上建筑面積55470平方米,地下建筑面積26000平方米。
2.蘇大附一院日間手術(shù)中心啟用。近日,蘇州大學(xué)附屬第一醫(yī)院正式啟用日間手術(shù)中心。日間手術(shù)設(shè)有普外科的疝氣膽囊專科、眼科、介入科、骨科、婦產(chǎn)科、耳鼻喉科、甲乳外科、超聲科等多個學(xué)科領(lǐng)域,眼科的斜視矯正術(shù)、介入科的大隱靜脈曲張手術(shù)、血透中心的動靜脈造瘺術(shù)、婦科的宮腔鏡手術(shù)等均能在日間手術(shù)中心完成。患者在入院前完成術(shù)前檢查、麻醉評估、手術(shù)預(yù)約,手術(shù)當天辦理住院;術(shù)后經(jīng)過嚴密觀察,當天或24小時后患者即可出院回家。
3.今年北京市將新建10所社區(qū)醫(yī)院。近日,北京市衛(wèi)健委、市中醫(yī)局聯(lián)合發(fā)布《北京市“優(yōu)質(zhì)服務(wù)基層行”活動和社區(qū)醫(yī)院建設(shè)三年行動方案》,北京市將著力改善基層醫(yī)療衛(wèi)生機構(gòu)中醫(yī)藥服務(wù)條件,今年將新建成10所社區(qū)醫(yī)院。到2025年,社區(qū)衛(wèi)生服務(wù)中心(鄉(xiāng)鎮(zhèn)衛(wèi)生院)將全部設(shè)置中醫(yī)館、配備中醫(yī)醫(yī)師,能夠規(guī)范開展10項以上中醫(yī)藥適宜技術(shù)。
評審動態(tài)
1. CDE新藥受理情況(04月25日)

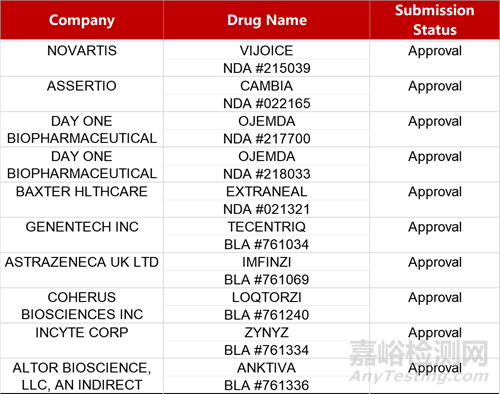
2. FDA新藥獲批情況(北美04月24日)

來源:藥研發(fā)


