您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-04-25 08:09
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
康哲引進腎性貧血新藥報產。康哲藥業從Zydus Lifesciences公司引進的創新藥德昔度司他片(原名:德度司他片)的上市申請獲NMPA受理。該產品是一款低氧誘導因子-脯氨酰羥化酶抑制劑(HIF-PHI),擬用于非透析的成人慢性腎臟病(CKD)患者的貧血治療。在中國開展的III期臨床結果顯示,與安慰劑相比,德昔度司他片治療患者第7-9周血紅蛋白平均值相對于基線的變化具統計學顯著性。此前,該新藥已在印度獲批上市。
國內藥訊
1.百濟神州PD-1獲歐盟批準新適應癥。百濟神州PD-1抑制劑替雷利珠單抗獲歐盟委員會(EC)批準用于三項非小細胞肺癌(NSCLC)適應癥的一線及二線治療:聯合紫杉醇和卡鉑或注射用紫杉醇(白蛋白結合型)和卡鉑一線治療局部晚期或轉移性鱗狀NSCLC;聯合培美曲塞和鉑類化療用于治療PD-L1表達≥50%且無EGFR和ALK陽性突變、局部晚期或轉移性非鱗狀NSCLC;以及單藥用于治療局部晚期或轉移性NSCLC經治患者。
2.康方雙抗報宮頸癌sNDA。康方生物全球首創PD-1/CTLA-4雙抗卡度尼利單抗(開坦尼)的新適應癥上市申請獲NMPA受理,聯合含鉑化療聯合或不聯合貝伐珠單抗一線治療復發或轉移性宮頸癌。在III期臨床AK104-303中,與安慰劑聯合含鉑化療+/-貝伐珠單抗相比,卡度尼利聯合用藥一線治療顯著改善患者的無進展生存期。2022年6月,NMPA已批準卡度尼利用于二/三線治療晚期宮頸癌。
3.正大天晴肺癌新藥見刊《柳葉刀》子刊。正大天晴新型多靶點酪氨酸激酶抑制劑安羅替尼聯合PD-1抑制劑信迪利單抗二線及以上治療廣泛期小細胞肺癌(SCLC)的Ⅱ期研究成果發表在《柳葉刀》子刊eClinicalMedicine上。數據顯示,信迪利單抗聯合安羅替尼治療,患者的中位無進展生存期(mPFS)達到6.1個月;中位OS為12.7個月;ORR和DCR分別達到56.8%和89.2%。目前,安羅替尼已獲批三線治療SCLC適應癥。
4.英百瑞NK細胞療法獲批IND。杭州英百瑞生物自主研發的“IBR822細胞注射液”獲國家藥監局臨床試驗默示許可,擬開發用于治療實體腫瘤。IBR822是一款非病毒非基因修飾、靶向TROP2抗原的NK細胞(CAR-raNK)產品。臨床前研究顯示,IBR822對非小細胞肺癌、消化道腫瘤、乳腺癌、前列腺癌、卵巢癌、宮頸癌腫瘤細胞系均有明顯殺傷效果。
5.樂普中美雙報ADC報IND。樂普生物自主研發的1類生物藥MRG006A的臨床試驗申請獲CDE受理。MRG006A是樂普生物第6款進入臨床階段的ADC新藥,對GPC3陽性腫瘤細胞有更強的結合力,并已在臨床前多個不同GPC3表達水平的肝癌CDX模型和PDX模型中顯示出積極的抗腫瘤功能。樂普生物也計劃今年提交MRG006A的美國IND,在中美兩國同步進行臨床開發。
國際藥訊
1.兒童膠質瘤抑制劑獲批上市。Day One公司泛RAF激酶抑制劑Ojemda(tovorafenib)獲FDA加速批準上市,用于治療6個月及以上的復發或難治性兒童低級別膠質瘤(pLGG)患者。Tovorafenib具有高腦滲透性,能夠抑制攜帶BRAF融合或BRAF V600突變的腫瘤的生長。在Ⅱ期FIREFLY-1臨床中,tovorafenib單藥達到67%總緩解率。此前,Tovorafenib已獲得FDA授予突破性療法認定和罕見兒科疾病資格,用于治療攜帶激活性RAF變異的pLGG。
2.賽諾菲BTK抑制劑III期臨床成功。賽諾菲BTK抑制劑Rilzabrutinib(SAR444671/PRN-1008)治療持續性或慢性免疫性血小板減少癥(ITP)成年患者的III期LUNA 3研究達到了主要和關鍵次要終點。與安慰劑相比,Rilzabrutinib組在24周雙盲治療期的最后12周中至少有8周能夠達到或超過50000/μL的血小板計數的患者比例顯著更高;Rilzabrutinib的安全性與既往研究一致。賽諾菲計劃今年下半年提交Rilzabrutinib的上市申請。
3.FIC抑郁癥新藥Ⅱ期臨床積極。Neurocrine 公司潛在“first-in-class”的AMPAR正向別構調節劑NBI-1065845,在治療抑郁癥(MDD)患者的Ⅱ期臨床SAVITRI中達到了主要和關鍵次要終點。第28天和第56天時,NBI-1065845治療患者的MADRS(蒙哥馬利-阿斯伯格抑郁評分量表)評分相比安慰劑均達到統計學意義的顯著改善,MADRS評分的最小二乘(LS)平均差異分別為-4.3(p=0.0159)和-7.5(p=0.0016)。研究中未報告死亡或嚴重不良事件。
4.Incyte公司購進兩款FIC新藥。Incyte公司宣布將以約7.5億美元款項收購Escient 公司,并獲得該公司炎癥與自身免疫疾病領域的兩款潛在“first-in-class”小分子新藥(EP262和EP547)。EP262是一種MRGPRX2拮抗劑,有潛力治療多種肥大細胞介導的疾病,包括特應性皮炎(AD)、慢性誘發性蕁麻疹(CIndU)和慢性自發性蕁麻疹(CSU)。EP547是一種MRGPRX4拮抗劑,擬用于治療膽汁淤積性和尿毒癥性瘙癢癥。
5.益普生擬開發神經系統新藥。益普生與Skyhawk Therapeutics將利用后者專有SkySTAR技術平臺,合作開發用于調節罕見神經系統疾病RNA的新型小分靶向藥物。根據協議,Skyhawk將獲得預付款和期權投資,開發、監管和商業里程碑后期付款,項目總交易金額高達18億美元。益普生將獲得候選藥物(DC)的全球獨家開發和商業化權益。
6.BI擬開發FIC肝病再生性療法。勃林格殷格翰與Ochre Bio公司將利用后者專有藥物發現平臺,結合機器學習和人類大數據,包括先進的成像和DNA組學數據,以及RNA化學和人類類器官模型,合作發現和開發潛力增強肝臟自我修復能力的創新療法,預防或逆轉慢性肝臟疾病進展。根據協議,Ochre Bio將獲得3500萬美元的前期和近期付款,超過10億美元的開發、監管和商業化里程碑后期付款。
醫藥熱點
1.CDE進一步優化進口藥申報程序。國家藥監局日前發布公告,優化已在境內上市的境外生產藥品轉移至境內生產的藥品上市注冊申請的申報程序:已在境內上市的境外生產藥品轉移至境內生產的,應當由境內申請人按照藥品上市注冊申請的要求和程序提出申請;已在境內上市的境外生產藥品轉移至境內生產的,可提交境外生產藥品的原注冊申報資料,并提交轉移至境內生產的相關研究資料,以支持其藥品上市注冊申請;對原研的化學藥品和生物制品轉移至境內生產的藥品上市注冊申請,國家藥監局納入優先審評審批適用范圍。
2.輝瑞任命中國區疫苗和基礎業務負責人。近日,輝瑞宣布任命金肖東為輝瑞中國疫苗和基礎業務負責人。金肖東擁有北京大學高級管理人員工商管理碩士學位(EMBA),深耕全球醫藥健康領域近27年,在產品商業化戰略決策、市場與銷售管理以及團隊管理等方面有扎實的經驗與實踐成果。加入輝瑞前,金肖東擔任諾誠健華首席業務開發官。
3.西南醫科大學附屬醫院新任兩位副院長。4月22日下午,西南醫科大學附屬醫院召開干部會議,宣布臨床醫學院·附屬醫院有關干部任免決定。其中任命:陳昌洪同志為臨床醫學院·附屬醫院副院長;周杰同志為臨床醫學院·附屬醫院副院長;卓乃強同志為臨床醫學院·附屬醫院外科黨總支委員、書記。
評審動態
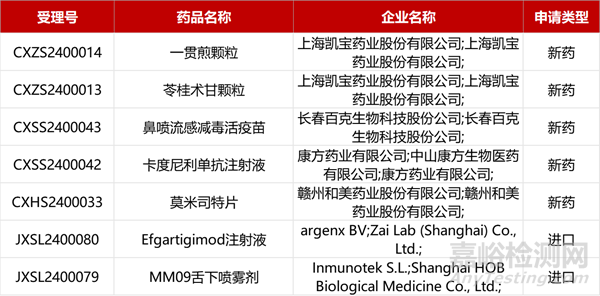
1. CDE新藥受理情況(04月24日)
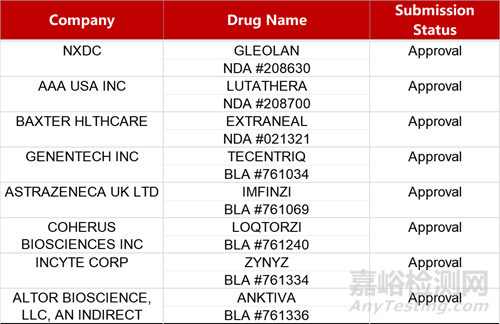
2. FDA新藥獲批情況(北美04月22日)

來源:藥研發


