[摘要] 藥品抽檢是藥品監(jiān)督和執(zhí)法的重要技術(shù)支撐手段,通過分析抽檢結(jié)果可有效發(fā)現(xiàn)上市后藥品的質(zhì)量風(fēng)險(xiǎn),同時(shí)也可評(píng)價(jià)某類或一定區(qū)域內(nèi)藥品的質(zhì)量。旨在立足于國家藥品抽檢中歷年發(fā)現(xiàn)的中成藥品種質(zhì)量問題和潛在安全風(fēng)險(xiǎn),以與中成藥質(zhì)量相關(guān)的原料�、生產(chǎn)工藝���、輔料及包裝材料等環(huán)節(jié)為切入點(diǎn)�����,分析已上市中成藥需要關(guān)注的相關(guān)問題,以期為中成藥質(zhì)量的提升和監(jiān)管工作的開展提供參考。
藥品抽檢是我國藥品監(jiān)管部門以問題為導(dǎo)向��,依相關(guān)法律法規(guī)對(duì)上市后藥品開展抽查檢驗(yàn)的監(jiān)管舉措�����。1952 年原衛(wèi)生部要求各地衛(wèi)生主管機(jī)關(guān)對(duì)成藥制造廠及經(jīng)營商店進(jìn)行檢查和抽取樣品��;1956 年提出計(jì)劃抽檢�����;1984 年《中華人民共和國藥品管理法》明確藥品抽檢的法律地位;2019 年修訂《中華人民共和國藥品管理法》���,進(jìn)一步細(xì)化了藥品的抽樣方式和被抽檢方的義務(wù)與責(zé)任等。目前����,藥品抽檢工作主要在以下 4 項(xiàng)法律����、法規(guī)文件下有序開展:《中華人民共和國藥品管理法》《中華人民共和國藥品管理法實(shí)施條例》《藥品質(zhì)量抽查檢驗(yàn)管理辦法》《藥品抽樣原則及程序》��。我國藥品上市后抽檢按照工作目的可劃分為監(jiān)督抽檢和評(píng)價(jià)抽檢。監(jiān)督抽檢由藥品監(jiān)督管理部門根據(jù)監(jiān)管需要開展,主要針對(duì)質(zhì)量可疑的藥品進(jìn)行抽查檢驗(yàn)���;評(píng)價(jià)抽檢主要為評(píng)價(jià)某類或一定區(qū)域內(nèi)的藥品質(zhì)量而開展的抽查檢驗(yàn)。藥品抽檢工作按組織層級(jí)可分為國家藥品抽檢和地方藥品抽檢。國家藥品抽檢由國家藥品監(jiān)督管理局負(fù)責(zé)組織實(shí)施,抽檢范圍涉及生產(chǎn)、經(jīng)營及使用環(huán)節(jié)[1]。
藥品抽檢工作是藥品監(jiān)督和執(zhí)法的重要技術(shù)支撐手段,通過分析抽檢結(jié)果可有效發(fā)現(xiàn)上市后藥品的質(zhì)量風(fēng)險(xiǎn)��,同時(shí)也可評(píng)價(jià)某類或一定區(qū)域內(nèi)藥品的質(zhì)量�����。本文旨在立足于歷年國家藥品抽檢中發(fā)現(xiàn)的中成藥品種的問題���,以與中成藥質(zhì)量相關(guān)的原料���、生產(chǎn)工藝�����、輔料及包裝材料等環(huán)節(jié)為切入點(diǎn),分析已上市中成藥需要關(guān)注的相關(guān)問題。
1�、 國家藥品抽檢
國家藥品抽檢以“分散抽樣���、集中檢驗(yàn)���、綜合評(píng)價(jià)���、質(zhì)量分析”為基本原則�����,從全國各地抽取抽檢品種的樣品。抽檢樣品以標(biāo)準(zhǔn)檢驗(yàn)為基礎(chǔ)�����,針對(duì)符合標(biāo)準(zhǔn)規(guī)定但實(shí)際仍存在質(zhì)量安全風(fēng)險(xiǎn)的藥品���,依據(jù)《國家藥品計(jì)劃抽驗(yàn)質(zhì)量分析指導(dǎo)原則》����,通過建立相應(yīng)的補(bǔ)充檢驗(yàn)方法及新增相關(guān)檢測(cè)項(xiàng)目����,針對(duì)問題樣品開展探索性研究,以全面評(píng)價(jià)藥品質(zhì)量����,發(fā)現(xiàn)潛在的質(zhì)量安全風(fēng)險(xiǎn)[1]����。
1.1 藥品抽檢范圍及品種抽檢原則
藥品抽檢范圍主要包括藥品上市許可持有人�、生產(chǎn)環(huán)節(jié)、經(jīng)營環(huán)節(jié)�����、藥品使用環(huán)節(jié),實(shí)行年度計(jì)劃抽檢�。
抽驗(yàn)品種的確定的原則:1)使用范圍廣�����、用藥量大的品種;2)納入國家集中招采名單���、基本藥物、醫(yī)保目錄���,群眾關(guān)切度較高的品種�;3)不良反應(yīng)報(bào)告較為集中或有明顯增加的品種;4)投訴舉報(bào)較多的品種����;5)日常監(jiān)管中發(fā)現(xiàn)存在或可能存在質(zhì)量安全隱患的品種���;6)可能存在非法添加���、摻雜使假行為�,并有相應(yīng)檢驗(yàn)方法或擬建立相應(yīng)補(bǔ)充檢驗(yàn)方法的品種�����;7)價(jià)格異常�����,可能存在違法違規(guī)生產(chǎn)行為的品種;8)質(zhì)量標(biāo)準(zhǔn)有重大提升后需要進(jìn)行質(zhì)量評(píng)價(jià)的品種���;9)新批準(zhǔn)上市的創(chuàng)新藥,有必要進(jìn)行質(zhì)量評(píng)價(jià)的品種�;10)既往藥品抽檢發(fā)現(xiàn)存在嚴(yán)重質(zhì)量問題��,需要繼續(xù)開展抽檢的品種;11)進(jìn)口量大����,或未經(jīng)過口岸檢驗(yàn)認(rèn)為有必要進(jìn)行市場抽檢的品種�;12)其他認(rèn)為有必要納入國家藥品抽檢任務(wù)的品種���。以 2023 年為例����,國家藥品抽檢共 140 個(gè)品種�,涉及中成藥 43 個(gè)品種,中藥飲片 9 個(gè)品種,同時(shí)以問題為導(dǎo)向設(shè)置專項(xiàng)檢驗(yàn)共 11 項(xiàng)����。
不同抽樣單位抽取同一品種的樣品后在規(guī)定時(shí)間內(nèi)傳遞至同一承檢機(jī)構(gòu)��,經(jīng)檢驗(yàn)發(fā)現(xiàn)為假藥劣藥時(shí),由生產(chǎn)企業(yè)和經(jīng)營使用環(huán)節(jié)所在地藥品監(jiān)管部門開展核查處置,最后由省級(jí)以上藥品監(jiān)管部門進(jìn)行抽檢結(jié)果公開�。
1.2 國家藥品抽檢中補(bǔ)充檢驗(yàn)方法的建立情況
標(biāo)準(zhǔn)檢驗(yàn)主要目的是反映藥品的質(zhì)量���,同時(shí)也是對(duì)標(biāo)準(zhǔn)適用性的考察�����,《中華人民共和國藥品管理法實(shí)施條例》中規(guī)定,針對(duì)有摻雜、摻假嫌疑的藥品,國家藥品標(biāo)準(zhǔn)規(guī)定的檢驗(yàn)方法和檢驗(yàn)項(xiàng)目不能檢驗(yàn)時(shí)����,藥品檢驗(yàn)機(jī)構(gòu)可以補(bǔ)充檢驗(yàn)方法和檢驗(yàn)項(xiàng)目對(duì)藥品進(jìn)行檢驗(yàn)�����,使用補(bǔ)充檢驗(yàn)方法和檢驗(yàn)項(xiàng)目所得出的檢驗(yàn)結(jié)果可作為食品藥品監(jiān)管部門認(rèn)定藥品質(zhì)量的依據(jù)。作為我國最高層級(jí)的抽檢項(xiàng)目,國家藥品抽檢具有規(guī)模最大����、涉及面最廣�����、技術(shù)儲(chǔ)備強(qiáng)等優(yōu)勢(shì)��。據(jù)統(tǒng)計(jì),目前涉及中成藥的補(bǔ)充檢驗(yàn)方法共計(jì)120個(gè),2013—2022年國家藥品抽檢項(xiàng)目共計(jì)1006個(gè)品種�����,抽樣 105 688 批次�����,借助探索性研究工作,共建立 60 個(gè)中成藥相關(guān)的補(bǔ)充檢驗(yàn)方法,累計(jì)檢出近 300 批次摻雜摻假的藥品�����,主要涉及問題為中成藥中原料藥染色��、摻偽使假��、非法添加及替代投料等問題[2-3]。
2 國家藥品抽檢中成藥質(zhì)量分析
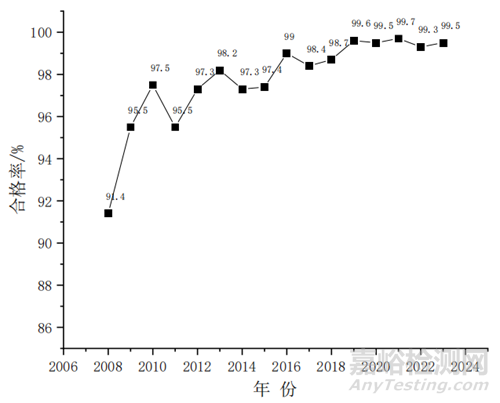
2008—2023 年,全國共抽檢中成藥品種 762 種,共計(jì) 113 104 批�,涉及劑型既包括丸����、散�、膏等傳統(tǒng)劑型,也包括滴丸劑�����、口服藥��、注射劑等現(xiàn)代劑型��。國家藥品抽檢項(xiàng)目執(zhí)行過程中,承檢機(jī)構(gòu)通過標(biāo)準(zhǔn)檢驗(yàn)同時(shí)結(jié)合探索性研究兩部分檢驗(yàn)結(jié)果對(duì)產(chǎn)品質(zhì)量進(jìn)行綜合研判�。標(biāo)準(zhǔn)檢驗(yàn)除發(fā)現(xiàn)樣品質(zhì)量問題外��,也是對(duì)標(biāo)準(zhǔn)適用性的考察,發(fā)現(xiàn)問題后以問題為導(dǎo)向進(jìn)一步進(jìn)行探索性研究�。檢驗(yàn)過程中發(fā)現(xiàn)的藥品的質(zhì)量標(biāo)準(zhǔn)�����、生產(chǎn)工藝��、標(biāo)簽���、說明書等方面存在的風(fēng)險(xiǎn)將作為“一般問題”上報(bào)���,涉嫌存在摻雜摻假�����、違法違規(guī)生產(chǎn)等問題將作為“嚴(yán)重問題”上報(bào)。統(tǒng)計(jì)發(fā)現(xiàn)�����,中成藥品種按標(biāo)準(zhǔn)檢驗(yàn)抽樣合格率整體較好(圖 1)�����,但探索性研究過程中仍發(fā)現(xiàn)一些質(zhì)量風(fēng)險(xiǎn)�����,涉及制劑生產(chǎn)全鏈條中的原料、生產(chǎn)工藝���、輔料及包裝材料等環(huán)節(jié),需有針對(duì)性地修訂標(biāo)準(zhǔn)或建立補(bǔ)充檢驗(yàn)方法進(jìn)一步規(guī)范產(chǎn)品質(zhì)量���,提升中藥行業(yè)整體水平。
圖 1 國家藥品抽檢中成藥標(biāo)準(zhǔn)檢驗(yàn)整體合格率
2.1 原料問題
由于中藥材資源緊張�����,加之價(jià)格因素��,用于中成藥生產(chǎn)的一些中藥飲片出現(xiàn)了摻偽投料���、以次充好���,同時(shí)還有近似種難以辨別的同屬近緣種混用現(xiàn)象���。此外��,重金屬及有害元素、黃曲霉毒素��、農(nóng)藥殘留�����、染色等外源性有害殘留及內(nèi)源性毒性成分等方面也存在一定問題�����。
2.1.1 摻偽、替代投料
中成藥中多采用人參全根入藥����,西洋參主根入藥���,須根不入藥����,而西洋參中人參皂苷 Re����、人參皂苷 Rb1的含量遠(yuǎn)高于人參��,易于符合《中華人民共和國藥典》(以下簡稱《中國藥典》)2020 年版人參含量測(cè)定項(xiàng)下規(guī)定�����。人參健脾丸通過采用專屬性成分篩查測(cè)定,人參測(cè)定人參皂苷 Rf,人參莖葉測(cè)定人參皂苷 F1,西洋參測(cè)定擬人參皂苷 F11���,結(jié)果發(fā)現(xiàn) 7 家生產(chǎn)企業(yè)共計(jì) 28 批次樣品檢出擬人參皂苷 F11,涉嫌西洋參摻偽投料[4]。更年安制劑 66 批次樣品中����,5批次完全以西洋參代替人參投料�,28 批次摻偽西洋參�。麥冬藥材主要產(chǎn)地為浙江和四川,分別稱為浙麥冬和川麥冬���。偽品山麥冬的主要產(chǎn)地為湖北和福建,分別稱為湖北麥冬和短葶山麥冬�����。麥冬和山麥冬外形相似很難分辨���。探索性研究過程中��,通過測(cè)定湖北麥冬特征成分山麥冬皂苷 B 和短葶山麥冬特征成分短葶山麥冬皂苷 C�����,發(fā)現(xiàn),玄麥柑桔制劑中存在山麥冬代替麥冬投料的現(xiàn)象,同時(shí)明確了代替品為湖北麥冬�����。薄荷屬植物種類較多�,形態(tài)相近�,存在摻偽風(fēng)險(xiǎn)。以往研究發(fā)現(xiàn)��,留蘭香為常見摻偽品����,但在檢測(cè)更年安的樣品時(shí)除留蘭香特征成分香芹酮外�����,還檢出了胡薄荷酮,進(jìn)一步排查野生薄荷��、荊芥及羅勒后確認(rèn)有 5 批次樣品摻偽留蘭香及羅勒�����。由于藏柴胡中柴胡皂苷 a 和柴胡皂苷 d 含量較高�,目前存在以藏柴胡摻偽柴胡投料的問題�,主要通過藏柴胡專屬性成分尼泊爾柴胡皂苷 k 進(jìn)行篩查,涉嫌品種包括更年安、解郁安神顆粒��。研究發(fā)現(xiàn)藿香正氣制劑原料紫蘇葉油由于無法定標(biāo)準(zhǔn)��,無備案管理���,均為自行提取獲得����,得油率低��、生產(chǎn)成本高�,因此存在采用肉桂油摻偽的現(xiàn)象����。肉桂油含藿香正氣制劑中指標(biāo)成分桂皮醛����,且其得油率高。此外�����,通過篩查理?xiàng)椚手?O-去甲基荷葉堿發(fā)現(xiàn)���,人參健脾丸 9 批次樣品存在理?xiàng)椚蚀嫠釛椚释读系膯栴}���。通過測(cè)定水防風(fēng)中特征成 3?(S),4?(R)-雙當(dāng)歸酰氧基-3?,4?-二氫花椒內(nèi)酯發(fā)現(xiàn)龍澤熊膽膠囊中以水防風(fēng)代替防風(fēng)投料[6-7]���。
2.1.2 加工炮制問題
黃芩藥材中含有內(nèi)源性酶�,保存不當(dāng)或炮制不到位酶解作用持續(xù),黃芩中苷類成分會(huì)轉(zhuǎn)化成相應(yīng)的苷元����,因此《中華人民共和國藥典》2020年版(一部)黃芩項(xiàng)下規(guī)定炮制方法為“置沸水中煮 10 分鐘����,取出�����,悶透�����,切薄片���,干燥��;或蒸半小時(shí)���,取出��,切薄片,干燥”[8]。此法作業(yè)即為“殺酶保苷”。檢驗(yàn)過程中發(fā)現(xiàn)�,部分企業(yè)的更年安�����,黃芩苷及漢黃芩苷的峰強(qiáng)度低于其相應(yīng)的苷元�,而大部分企業(yè)的更年安苷含量高于其苷元�。進(jìn)一步研究發(fā)現(xiàn)問題企業(yè)原料存在炮制不到位的問題,從而影響了產(chǎn)品質(zhì)量�����。
女貞子在酒制過程中��,原女貞子特征成分特女貞苷含量降低����,紅景天苷含量增加�����,因此通過對(duì)紅景天苷成分的篩查發(fā)現(xiàn)�,更年安制劑中存在女貞子原料質(zhì)量風(fēng)險(xiǎn)問題�。
2.1.3 染色問題
染色主要指采用色素及有機(jī)染料將劣質(zhì)飲片或偽造飲片進(jìn)行染色處理,以掩蓋其真實(shí)質(zhì)量�����。研究已經(jīng)發(fā)現(xiàn)的染料包括紅色系(胭脂紅��、赤蘚紅、酸性紅 73����、808 猩紅����、莧菜紅�����、新品紅���、蘇丹紅Ⅰ�����、蘇丹紅Ⅳ)、黃色系(金胺 O、金橙Ⅱ、日落黃����、檸檬黃)����、藍(lán)綠色系(孔雀石綠��、亮藍(lán))等染料���。處方中涉及紅花的中成藥品種曾檢出多種紅色系���、黃色系染料聯(lián)合染色,包括金橙Ⅱ���、檸檬黃、莧菜紅����、日落黃及胭脂紅���;此外����,牛黃清心丸(局方)中發(fā)現(xiàn)染料金胺O 及 808 猩紅�����;冠脈寧制劑中 64 批樣品中 2 批樣品檢出蘇丹紅Ⅰ��、蘇丹紅Ⅳ����,6批樣品中檢出 808 猩紅�����;三七傷藥片中 1 批次樣品同時(shí)檢出檸檬黃���、日落黃和亮藍(lán)���。隨著國家藥品抽檢工作的不斷深入����,補(bǔ)充檢驗(yàn)方法的發(fā)布實(shí)施為監(jiān)管提供了有效的技術(shù)支持�,近幾年藥材品種染色問題已得以明顯改善[6-7]�。
2.1.4 外源性污染物
中成藥外源性污染物主要源自原料藥材,包括重金屬及有害元素����、黃曲霉及農(nóng)藥殘留����。抽檢工作開展以來�����,承檢單位參照《中國藥典》2010年版����、2015 年版���、2020 年版中有關(guān) 5 種重金屬及有害元素的限量規(guī)定��,對(duì)抽檢中成藥品種進(jìn)行測(cè)定���,結(jié)果發(fā)現(xiàn)跌打丸�����、濟(jì)生腎氣丸、牛黃清心丸(局方)等百余個(gè)品種存在不同程度的某個(gè)或某幾個(gè)重金屬及有害元素超標(biāo)的情況�,其來源可能是中藥原料��,也可能是存在共線生產(chǎn)清場不徹底。含有土鱉蟲、桃仁等中藥的成藥品種��,如牛黃清心丸�����、人參再造丸、腦立清丸等為黃曲霉毒性超標(biāo)的高風(fēng)險(xiǎn)品種;此外��,中成藥品種除跌打活血散�、知柏地黃丸(蜜丸)、蘇合香丸及腦安制劑等品種檢出禁用農(nóng)藥或農(nóng)藥殘留超標(biāo)外,整體農(nóng)藥殘留控制情況良好�����。
2.1.5 內(nèi)源性毒性成分
內(nèi)源性毒性成分主要指藥味中含有的成分具有毒性作用����,而這一類成分往往同時(shí)又是藥效成分,如馬錢子中的士的寧、馬錢子堿,雷公藤和昆明山海棠中的雷公藤甲素、雷公藤紅素��,制草烏�、制川烏中的烏頭堿、新烏頭堿等。目前�,含有這些藥味的中成藥標(biāo)準(zhǔn)中僅控制毒性成分的上限�����,而對(duì)最低含量未做規(guī)定。例如�,抽檢雷公藤多苷片����,發(fā)現(xiàn) 172 批次樣品中雷公藤甲素含量不同企業(yè)間相差懸殊,部分企業(yè)甚至未檢出。
2.2 生產(chǎn)工藝環(huán)節(jié)問題
生產(chǎn)工藝環(huán)節(jié)應(yīng)關(guān)注其合理性��、可控性及穩(wěn)定性等方面內(nèi)容��,重點(diǎn)考察是否按處方投料���、是否存在擅自改變生產(chǎn)工藝等問題����。
2.2.1 未按處方投料
未按處方投料包括不投料��、少投料、替代投料等。抽檢中發(fā)現(xiàn)某企業(yè)與其他企業(yè)龍澤熊膽膠囊樣品色譜峰相似度相差懸殊,進(jìn)一步篩查發(fā)現(xiàn)為該生產(chǎn)企業(yè)未按規(guī)定量投料黃連,導(dǎo)致有關(guān)黃連藥味的色譜信息出現(xiàn)異常����。此外�����,鑒別發(fā)現(xiàn)牛黃清心丸(局方)顯微存在貴細(xì)藥羚羊角、人工麝香不投料的6現(xiàn)象。由于天然牛黃產(chǎn)量低�����、藥源稀缺���,含牛黃中成藥品種涉及處方與實(shí)際投料是否相符的問題���。我國目前牛黃投料分為天然牛黃�����、人工牛黃��、培植牛黃(體內(nèi)培育牛黃)和體外培育牛黃,由于形成過程不同�����,化學(xué)成分和含量存在差異���。通過測(cè)定膽紅素�、豬去氧膽酸等特征成分的含量及其比例�����,發(fā)現(xiàn)牛黃清心丸(局方)制劑存在處方與投料不符的情況���,處方標(biāo)注為天然牛黃投料��,實(shí)際測(cè)定發(fā)現(xiàn)為體外培育牛黃,處方標(biāo)注為體外培育牛黃�����,實(shí)際測(cè)定為人工牛黃投料[5]����。
2.2.2 未按生產(chǎn)工藝生產(chǎn)
未按生產(chǎn)工藝生產(chǎn)包括擅自改變制法,如粉碎方式�、混合方式�����、過濾方式、煎煮加水量��、干燥方式等��,以及改變?cè)幉臏缇绞?��,擅自添加防腐劑等問題�����。
麻杏甘石合劑處方為麻黃、石膏��、苦杏仁和甘草(蜜炙)���,制法規(guī)定為苦杏仁壓榨脂肪油備用�����,藥渣加水蒸餾�����,取苦杏仁水后與其余麻黃等 3 味藥加水煎煮3 次,合并煎液濃縮�,加入苯甲酸鈉����,放冷���,加入苦杏仁水和苦杏仁油��,調(diào)整總量至 1000 mL���,攪勻�,即得���。個(gè)別生產(chǎn)企業(yè)未按生產(chǎn)工藝生產(chǎn)�����,將苦杏仁油的加入方式改為藥液單瓶灌裝后���,每瓶滴加固定量的苦杏仁油。三七傷藥片將本煎煮的紅花、赤芍、骨碎補(bǔ)直接粉碎投料�����。輻照篩查發(fā)現(xiàn)����,將人參健脾丸滅菌方法規(guī)定的濕熱滅菌法改為輻照法滅菌。丹參注射液標(biāo)準(zhǔn)處方制法中未明確規(guī)定可以使用聚山梨酯-80 等助溶劑,抽檢發(fā)現(xiàn)部分企業(yè)存在違規(guī)添加的現(xiàn)象�����。
2.3 輔料問題
針對(duì)不同劑型應(yīng)關(guān)注填充劑/稀釋劑�、黏合劑、崩解劑�����、潤滑劑�����、防腐劑�����、助溶劑等, 如淀粉、蜂蜜�����、蔗糖�����、藥用乙醇、苯甲酸�、聚山梨醇酯-80 等���。
蜂蜜作為大蜜丸中的重要輔料��,不僅影響有效成分的釋放溶出���,其也具有補(bǔ)中益氣����、潤腸通便��、止咳化痰的功效��。在抽檢中發(fā)現(xiàn)不同企業(yè)間六味地黃大蜜丸產(chǎn)品的性狀差異懸殊,部分企業(yè)大蜜丸質(zhì)地堅(jiān)硬��,溶散時(shí)限不合格�����。針對(duì)蜂蜜中葡萄糖�����、果糖、蔗糖和麥芽糖 4 個(gè)成分分別建立薄層鑒別及液相測(cè)定方法�,結(jié)果發(fā)現(xiàn)正常蜂蜜中葡萄糖與果糖的含量總和應(yīng)>4 個(gè)糖含量總和的 60%�����,且果糖含量應(yīng)略高于葡萄糖。應(yīng)用所建方法對(duì) 269 批樣品篩查發(fā)現(xiàn)�����,部分企業(yè)的輔料蜂蜜為麥芽糖漿替代�,部分企業(yè)的蜂蜜中摻加了蔗糖�����。此外�,進(jìn)一步以 5-羥甲基糠醛為指標(biāo)評(píng)價(jià)更年安制劑輔料蜂蜜的加工工藝��,結(jié)果發(fā)現(xiàn)部分企業(yè)煉蜜工藝不穩(wěn)定��。藿香正氣制劑中采用藥用輔料乙醇,通過對(duì)制劑中甲醇量的測(cè)定發(fā)現(xiàn)��,部分企業(yè)7投料使用的乙醇不符合藥用要求或食用酒精標(biāo)準(zhǔn)要求��。針對(duì)防腐劑篩查發(fā)現(xiàn)�,該劑型還存在添加防腐劑過量的情況�����。此外�����,龍澤熊膽膠囊部分批次樣品崩解時(shí)限不符合規(guī)定,提示輔料膠囊殼存在質(zhì)量問題���。
2.4 包裝材料問題
包裝材料應(yīng)關(guān)注三方面問題:包材本身質(zhì)量、包裝材料對(duì)制劑中指標(biāo)成分的影響���、包裝材料中相關(guān)成分遷移到制劑中引發(fā)安全風(fēng)險(xiǎn)的問題。
丹參注射液抽檢品種涉及 2 種包裝材料:安瓿瓶及玻璃管制注射劑瓶���。研究發(fā)現(xiàn),玻璃管制注射劑瓶存在密封不嚴(yán)��,導(dǎo)致制劑中水分揮發(fā)的問題����。排石顆粒涉及 3 種包裝材料:聚酯-鍍鋁聚酯-聚乙烯 3 層藥用復(fù)合膜(A 材料)��、雙層鍍鋁藥用復(fù)合膜(B 材料)�����、聚酯-鋁-聚乙烯 3 層藥用復(fù)合膜(C 材料)����。研究發(fā)現(xiàn)����,A 和 C 材料包裝樣品中水分增加明顯,B 材料包裝樣品中指標(biāo)成分迷迭香酸含量明顯下降���。麻杏甘石合劑的包裝材料涉及低硼硅玻璃管制口服液體瓶配以鹵化丁基橡膠塞、鈉鈣玻璃管制口服液體瓶配以硅膠塞�,結(jié)果發(fā)現(xiàn)前者可在制劑中檢出對(duì)苯二甲酸二甲酯�,后者可檢出亞硝基二苯胺��,提示包裝材料成分發(fā)生了遷移�����。
3、 上市中成藥需要關(guān)注的相關(guān)問題
中成藥的原料為中藥飲片���,其源頭為中藥材,因此中藥材質(zhì)量直接影響其終端產(chǎn)品中成藥的質(zhì)量����。由于中成藥大多需經(jīng)處方配伍調(diào)配使用�,這使得體系中成分更加復(fù)雜����,此外在后續(xù)的生產(chǎn)鏈條中還涉及制劑工藝及包裝等環(huán)節(jié)��,加工工藝導(dǎo)致的固有成分變化�、輔料的引入使得基質(zhì)復(fù)雜化�����,因此中成藥的質(zhì)量控制應(yīng)為全鏈條多環(huán)節(jié)的把控�����。歷年來國家藥品抽檢項(xiàng)目中中成藥品種發(fā)現(xiàn)的質(zhì)量問題涉及如下幾個(gè)方面:1)種植、栽培問題。改變?cè)耘喾绞?,非道地產(chǎn)區(qū)擴(kuò)大種植�����,違規(guī)使用生長調(diào)節(jié)劑、農(nóng)藥等引入外源性污染物;2)飲片加工炮制問題����。采收及產(chǎn)地加工去除雜質(zhì)和藥用部位不到位��,炮制不規(guī)范;3)藥材飲片貯藏問題��。溫度���、濕度控制不當(dāng)引發(fā)蟲蛀霉變����,增加外源性污染物的引入;4)現(xiàn)行標(biāo)準(zhǔn)問題�����。檢驗(yàn)項(xiàng)目缺失�,缺少關(guān)鍵質(zhì)量指標(biāo)���,已有質(zhì)量控制指標(biāo)設(shè)定不合理�����,內(nèi)源性毒性成分質(zhì)量控制指標(biāo)缺少限度范圍等[9-12]�����。
基于上述問題上市中成藥的分析評(píng)價(jià)工作應(yīng)結(jié)合處方特點(diǎn)及處方中相關(guān)中藥飲片的潛在質(zhì)量問題開展��,修訂或新增標(biāo)準(zhǔn)應(yīng)可有效體現(xiàn)和控制該產(chǎn)品的安全8性、真實(shí)性����、有效性和質(zhì)量均一性等�。應(yīng)重點(diǎn)關(guān)注:1)原料�。真實(shí)性、有效性���、安全性等方面,包括重點(diǎn)關(guān)注摻偽投料��、以次充好��,同時(shí)還有近似種難以辨別的同屬近緣種混用�����,外源性污染物等。2)生產(chǎn)工藝��。合理性�、可控性���、穩(wěn)定性等方面����,包括原藥滅菌方式、粉碎方式����、過篩目數(shù)����,具體煎煮加水量�����、稠膏干燥方式��、干燥溫度、混合方式���,是否按處方投料,是否存在以提取物甚至對(duì)照品投料擅自改變處方工藝等問題��。3)輔料����。真實(shí)性及安全性等方面,針對(duì)不同劑型應(yīng)關(guān)注填充劑/稀釋劑、黏合劑�、崩解劑��、潤滑劑、防腐劑、助溶劑如蜂蜜、蔗糖���、淀粉、乙醇��、苯甲酸�、聚山梨醇酯-80 等��。4)包裝材料����。包材本身質(zhì)量����,包材對(duì)指標(biāo)成分的影響及包裝材料遷移等安全性方面的問題。
4、 總結(jié)
國家藥品抽檢項(xiàng)目持續(xù)開展的 15 年間,中成藥抽檢品種共計(jì) 762 種����,累計(jì)113 104 批次樣品�,包括傳統(tǒng)劑型及現(xiàn)代制劑���,基本覆蓋中成藥生產(chǎn)全鏈條�����,檢測(cè)項(xiàng)目涉及原藥材的種植�、飲片的加工炮制、制劑工藝生產(chǎn)過程,包裝及運(yùn)輸?shù)确矫?��,?duì)于發(fā)現(xiàn)的質(zhì)量問題及安全風(fēng)險(xiǎn)隱患建立了相應(yīng)的補(bǔ)充檢驗(yàn)方法,為上市中成藥的評(píng)價(jià)積累了大量的數(shù)據(jù)和研究結(jié)果,為全面分析與評(píng)價(jià)中成藥質(zhì)量提供了大量的數(shù)據(jù)支撐�,為藥品質(zhì)量監(jiān)管提供了有效的技術(shù)支持���,最終保障了藥品質(zhì)量安全可控�,保障了公眾的健康安全����。
參考文獻(xiàn)
[1] 朱炯,劉文����,王翀,等. 我國上市后藥品抽查檢驗(yàn)工作的現(xiàn)狀分析[J]. 藥物評(píng)價(jià)研究,2021���,44(6):1207-1214.
[2] 王翀,劉文,朱炯���,等. 國家藥品抽檢中補(bǔ)充檢驗(yàn)方法的建立情況分析[J]. 藥物評(píng)價(jià)研究,2023,46(10):2061-2070.
[3] 胡曉茹���,楊青云,周亞楠�����,等. 藥品補(bǔ)充檢驗(yàn)方法在中成藥質(zhì)量監(jiān)管中的應(yīng)用[J]. 中國藥事��,2023�,37(1):37-47.
[4] 劉永利��,雷蓉�,王曉蕾���,等.基于中藥質(zhì)量標(biāo)志物的人參�����、西洋參���、三七及相關(guān)中成藥質(zhì)量控制方法研究[J].中國藥學(xué)雜志�,2019�����,54(17):1402-1410.
[5] 胡曉茹,劉晶晶�,戴忠�����,等. 含牛黃中成藥的質(zhì)量控制現(xiàn)狀[J]. 中國藥學(xué)雜志,2019����,54(17):1374-1379.
[6] 劉靜�����,劉燕,鄭笑為����,等. 基于 2008—2021 年國家藥品抽檢的18 種中成藥質(zhì)量分析[J].中國現(xiàn)代中藥����,2022��,24(11):2066-2072.
[7] 劉靜���,朱炯���,王翀����,等. 2021 年國家藥品抽檢中成藥質(zhì)量分析[J]. 中國現(xiàn)代中藥,2022��,8(6):947-953.
[8] 國家藥典委員會(huì).中華人民共和國藥典:一部[M].北京:中國醫(yī)藥科技出版社����,2020.314.
[9] 劉靜�,于健東,朱嘉亮��,等. 2008—2021 年國家藥品抽檢中成藥質(zhì)量分析[J]. 中國現(xiàn)代中藥�����,2023����,25(1):9-14.
[10] 馬雙成��,王翀��,朱炯,等. 中成藥的整體質(zhì)量狀況及有關(guān)問題分析[J]. 中國藥學(xué)雜志,2019�,54(17):1369-1373.
[11] 魏鋒�,程顯隆���,荊文光���,等. 中藥材及飲片質(zhì)量標(biāo)準(zhǔn)研究有關(guān)問題思考[J]. 中國藥學(xué)雜志�,2022,8(18):1493-1503.
[12] 聶黎行��,吳炎培���,劉靜�,等. 中成藥質(zhì)量標(biāo)準(zhǔn)研究有關(guān)問題思考[J]. 藥學(xué)學(xué)報(bào),2023�,9(8):2260-2270.