今日頭條
舶望siRNA新藥心血管早期臨床積極。上海舶望制藥自研siRNA新藥BW-01針對心血管疾病同時在澳洲和中國開展的Ⅰ期臨床獲積極結果。數據顯示,BW-01單劑量皮下注射24周后,受試者藥效學指標顯著改善;BW-01在兩個試驗中均表現出良好的安全性,沒有死亡或導致停藥和退出研究的不良事件,也沒有發生嚴重不良事件。預計今年上半年啟動Ⅱ期臨床試驗。
國內藥訊
1.諾和諾德口服司美格魯肽中國獲批上市。諾和諾德口服GLP-1R激動劑司美格魯肽片獲國家藥監局批準上市, 用于治療2型糖尿病。此前,該產品注射劑型已在國內獲批用于2型糖尿病治療。在Ⅲ期臨床PIONEER系列研究中,司美格魯肽片可顯著降低糖化血紅蛋白(HbA1c)水平(最高達1.5%);顯著提高HbA1c達標率(最高達80%);顯著減輕患者體重(最高達5.0kg)等;司美格魯肽片劑與皮下注射劑型的藥效學曲線一致。
2.輝瑞口服偏頭痛新藥中國獲批上市。輝瑞口服CGRP受體拮抗劑硫酸瑞美吉泮口崩片(Rimegepant)獲國家藥監局批準上市,用于成年人有或無先兆偏頭痛的急性治療。在III期臨床中,患者單次口服Rimegepant(75mg)可在2小時內減輕疼痛及改善偏頭痛相關癥狀;且療效持續時間長達48小時。在美國,這款偏頭痛急性治療產品已被批準擴展新適應癥,用來預防成人發作性偏頭痛。
3.強生兩款EGFR抑制劑中國報產。強生EGFR/c-MET雙抗埃萬妥單抗和第三代EGFR抑制劑蘭澤替尼片(Lazertinib)兩款新藥上市申請分別獲得CDE受理,推測申報適應癥為二者聯合治療EGFR突變局部晚期或轉移性非小細胞肺癌(NSCLC)患者。在III期MARIPOSA研究中,與奧希替尼相比,埃萬妥單抗聯合方案顯著改善患者的無進展生存期(PFS);中期總生存期(OS)數據也具有獲益趨勢;而且聯合用藥安全性良好。
4.馴鹿BCMA靶向CAR-T獲批MG臨床。馴鹿生物靶向BCMA的CAR-T產品伊基奧侖賽注射液獲國家藥監局批準,即將針對難治性全身型重癥肌無力(MG)新適應癥開展新藥研究。去年6月,該產品已獲國家藥監局批準上市,用于治療至少3線治療后進展的復發/難治多發性骨髓瘤(MM)。在Ⅰ/Ⅱ期臨床中,中位隨訪為13.8個月時,伊基奧侖賽注射液的總體緩解率(ORR)為96.0%,12個月PFS率為78.8%(95% CI: 68.6–85.97)。
5.英百瑞Trop2抗體NK細胞偶聯新藥報IND。英百瑞1類生物制品IBR822細胞注射液的臨床試驗申請獲CDE受理。IBR822是一款抗體-NK細胞偶聯藥物,是靶向Trop2單抗與體外擴增的同種異體健康供者外周血來源的NK細胞通過連接子化學偶聯而成。IBR822旨在通過Trop2單抗特定靶向Trop2抗原的腫瘤細胞,并通過NK細胞的作用機制發揮殺傷腫瘤細胞的作用。IBR822擬開發用于治療三陰性乳腺癌、結直腸癌、食管癌等實體瘤患者。
國際藥訊
1.度普利尤單抗獲FDA批準治療兒EoE。賽諾菲IL-4/IL-13抑制劑Dupixent(dupilumab)獲FDA批準新適應癥,用于治療1-11歲嗜酸性粒細胞性食管炎(EoE)患者。在III期EoE KIDS研究中,與安慰劑組相比,Dupixent治療16周時達到組織學疾病緩解的患者比例顯著更高(66%vs3%);而且Dupixent療效能夠維持52周。目前,Dupixent已在全球范圍內獲批用于治療結節性癢疹、特異性皮炎、哮喘、慢性鼻-鼻竇炎伴鼻息肉以及EoE。
2.新型抗生素組合上市獲歐盟CHMP支持。歐洲藥品管理局人用藥品委員會(CHMP)推薦批準Advanz公司固定劑量抗生素組合Exblifep(cefepime/enmetazobactam)上市,用于治療復雜尿路感染(cUTI)患者。在Ⅲ期臨床中,在治愈檢驗(TOC)訪視時,exblifep治療組的總成功率為79.1%,活性對照(哌拉西林-他唑巴坦治療)組的總成功率為58.9%。目前,Exblifep的新藥申請(NDA)也正在接受FDA審查。
3.BLyS/APRIL抑制劑IgA腎病長期療效積極。Vera公司創新BLyS/APRIL雙重抑制劑Atacicept治療IgA腎病(IgAN)的Ⅱb期臨床ORIGIN最新數據積極。72周結果顯示,atacicept治療患者的半乳糖缺陷性IgA1(Gd-IgA1)降低了62%,血尿患者的比例降低到19%,尿蛋白肌酐比值(UPCR)降低了48%;患者估計腎小球濾過率(eGFR)與基線相比變化為0mL/min/1.73m2;藥物總體耐受性良好。去年6月,該項試驗在完成36周治療后已達到主要和關鍵性次要終點。
4.K藥膀胱癌Ⅲ期臨床積極。默沙東PD-1抑制劑Keytruda輔助治療局部肌肉浸潤性尿路上皮癌(MIUC)和局部晚期可切除尿路上皮癌的Ⅲ期臨床AMBASSADOR達到主要終點之一。與手術治療對照組比,Keytruda治療顯著改善患者的無病生存期(中位DFS:29.0個月vs14.0個月),使疾病復發或死亡風險降低31%(p=0.001);但兩組中位總生存期(OS)分別為50.9個月和55.8個月,未達到統計學顯著性。臨床中未發現新的安全性信號。
5.HbF靶向RNA激活劑臨床前研究積極。MiNA公司靶向胎兒血紅蛋白(HbF)的RNA激活劑NOV340在治療β-血紅蛋白病的臨床前研究中獲積極結果。該產品旨在增加γ珠蛋白(HBG)基因的轉錄,使β-血紅蛋白病患者產生更高水平的HbF。在非人靈長類動物體內,NOV340顯示出可將RNAa復合物輸送到骨髓中超過60%的紅細胞集落形成單位(CFU-E)細胞和前成紅細胞(Pro-E)。在外周血單核細胞中也觀察到了同等水平的遞送效率。
6.羅氏超6億美元開發HNPs核酸類產品。羅氏旗下基因泰克與GenEdit公司將利用后者創新納米顆粒(HNPs)技術平臺NanoGalaxy,針對基因泰克所選的自免疾病領域的核酸類產品,合作開發HNPs遞送核酸類候選藥物。NanoGalaxy平臺產生的親水性HNPs,適用于針對不同組織和細胞類型,同時可攜帶不同類型的基因藥物載荷。根據協議,GenEdit將獲得1500萬美元的前期付款,高達6.29億美元的潛在里程碑后期付款。
醫藥熱點
1.北大醫院門診心臟康復中心啟用。1月26日,北大醫院門診心臟康復中心正式啟用,旨在為心血管疾病患者提供生命周期全程管理。心臟康復中心可為患者行運動心肺功能檢查,制定運動處方,科學評估和指導運動;管理各類心血管疾病患者的綜合評估、治療與隨訪;各種外科手術術前心肺耐力評估,亞健康人群的檢查及治療,健康人群及運動員心肺耐力的定期檢查。
2.我國短期內仍將以流感病毒為主。1月25日,國家衛健委舉行新聞發布會,介紹我國冬季呼吸道疾病防治和健康提示有關情況。監測數據顯示,我國的呼吸道疾病于2023年12月上旬達到峰值之后,目前已呈現下降的趨勢。專家研判認為,在冬春季我國將繼續呈現多種呼吸道疾病交替流行或者共同流行的態勢,短期內還是會以流感病毒為主(其中近期乙流占比升高)。
3.CDMO巨頭Lonza將關閉廣州生物技術工廠。行業媒體Endpoints News報道,經過廣泛戰略評估,CDMO巨頭龍沙(Lonza)將關閉位于中國廣州開發區的生物技術工廠。該工廠在2018年啟動,2021年全面投入運營,提供涵蓋細胞系構建、細胞庫、工藝開發、中試生產、技術轉移、GMP原液(200L-2000L)及制劑生產等的一站式服務。廣州開發區工廠發言人表示,到2025年第一季度,將有約300名員工被解雇。
評審動態
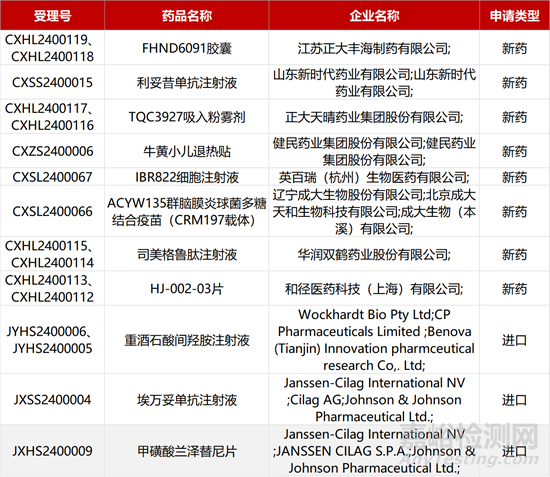
1. CDE新藥受理情況(01月28日)
2. FDA新藥獲批情況(北美01月24日)