今日頭條
祐兒醫(yī)藥多動癥改良型新藥獲批上市。祐兒醫(yī)藥與Tris Pharma公司開發(fā)的鹽酸哌甲酯口服緩釋干混懸劑獲國家藥監(jiān)局批準上市,用于治療注意缺陷多動障礙(ADHD,俗稱多動癥)。這是一款中樞神經(jīng)系統(tǒng)(CNS)興奮劑,此前NMPA已批準鹽酸哌甲酯緩釋咀嚼片上市。在臨床研究中,混懸劑和咀嚼片均可以在45分鐘至12小時內(nèi)顯著改善患者多動癥癥狀。
國內(nèi)藥訊
1.三生制藥米諾地爾泡沫劑獲批上市。三生制藥5%米諾地爾泡沫劑(蔓迪)獲國家藥監(jiān)局批準上市,用于治療男性脫發(fā)和斑禿。這是一款非處方用藥,其處方體系不含有丙二醇(少數(shù)患者敏感),可以減少過敏瘙癢的發(fā)生率;同時,泡沫劑給藥更精準,可以避免對非預(yù)期部位刺激毛發(fā)生長;易于患者脫發(fā)部位的有效定位治療,給患者帶來更好的順應(yīng)性和體驗感。
2.恒瑞兩款創(chuàng)新藥獲批上市。恒瑞醫(yī)藥兩款創(chuàng)新藥鹽酸伊立替康脂質(zhì)體注射液和恒格列凈二甲雙胍緩釋片同日獲國家藥監(jiān)局批準上市。鹽酸伊立替康脂質(zhì)體適用于聯(lián)合5-FU/LV二線治療經(jīng)吉西他濱治療失敗后局部晚期或轉(zhuǎn)移性胰腺癌患者;恒格列凈二甲雙胍緩釋片用于適合接受脯氨酸恒格列凈和鹽酸二甲雙胍治療的2型糖尿病成人患者,以改善其血糖控制。
3.藥明巨諾CD19靶向CAR-T新適應(yīng)癥報產(chǎn)。藥明巨諾靶向CD19的CAR-T產(chǎn)品瑞基奧侖賽注射液(商品名:倍諾達)的新適應(yīng)癥上市許可申請(sBLA)獲國家藥監(jiān)局受理,用于治療復(fù)發(fā)或難治套細胞淋巴瘤(r/r MCL)患者。在Ⅱ期臨床中,瑞基奧侖賽治療達到81.8%的客觀緩解率。此前,CDE已將該產(chǎn)品用于治療r/r MCL的適應(yīng)癥納入突破性治療品種,以及納入優(yōu)先審評。
4.康方PD-1/CTLA-4雙抗新適應(yīng)癥報產(chǎn)。康方生物PD-1/CTLA-4雙抗卡度尼利單抗(開坦尼)注射液新適應(yīng)癥上市申請獲CDE受理,推測申報的適應(yīng)癥為“一線治療不可手術(shù)切除的局部晚期或轉(zhuǎn)移性胃腺癌或胃食管結(jié)合部腺癌(GC/GEJC)”。在III期臨床(AK104-302)中,與安慰劑聯(lián)合化療相比,AK104聯(lián)合化療顯著延長患者總生存期(OS);安全性數(shù)據(jù)與既往研究一致。詳細結(jié)果將在國際學(xué)術(shù)會議上公布。
5.信瑞諾醫(yī)藥被諾華收購。諾華宣布收購信瑞諾醫(yī)藥,并獲得該公司2個針對免疫球蛋白A腎病(IgAN)創(chuàng)新藥項目atrasentan和zigakibart。Atrasentan是一款口服選擇性內(nèi)皮素受體(ETA)拮抗劑,正在進行IgAN的III期臨床開發(fā);Zigakibart(BION-1301)是一款皮下給藥的APRIL單抗,已在2023年10月啟動III期臨床研究。信瑞諾擁有atrasentan和zigakibart在中國和新加坡的獨家權(quán)益。
國際藥訊
1.FIC抗病毒凝膠獲FDA批準上市。Ligand公司局部抗病毒凝膠Zelsuvmi(berdazimer,10.3%)獲FDA批準上市,成為首款獲批用于成人和一歲及以上兒童傳染性軟疣患者的“first-in-class”藥物。在關(guān)鍵Ⅲ期臨床B-SIMPLE4中,SB206治療12周后患者實現(xiàn)病灶完全清除的患者比例更高,具統(tǒng)計學(xué)意義的顯著改善(p值<0.001),藥物耐受性良好。這是2024年FDA批準的首個上市許可。
2.輝瑞血友病基因療法獲批加拿大上市。輝瑞基因療法Beqvez(fidanacogene elaparvovec)獲加拿大衛(wèi)生部批準上市,這是Beqvez的全球首個上市許可,用于治療≥18歲、中重度至重度血友病B成人患者。在Ⅲ期臨床(BENEGENE-2)中,與FIX預(yù)防性治療方案相比,Beqvez單次給藥達到主要研究終點,所有患者的年平均出血率(ABR)從預(yù)處理期的4.43降至1.3(降低71%,p<0.0001);年化輸注率也降低92%(p<0.0001)。
3.Theravance公司COPD藥物IV期臨床失敗。Theravance公司長效霧化支氣管擴張劑Yupelri(revfenacin)用于治療慢性阻塞性肺病(COPD)維持治療的IV期PIFR-2研究未達主要終點。與噻托溴銨(Spiriva,粉霧劑)對照組相比,revfenacin治療第85天時患者第一秒用力呼氣谷值較基線變化的統(tǒng)計未達到統(tǒng)計學(xué)意義的顯著改善。Yupelri的安全性與耐受性與既往研究一致。
4.艾伯維超14億美元布局體內(nèi)CAR-T。艾伯維與Umoja Biopharma將利用后者專有的VivoVec平臺,針對艾伯維所選擇的靶標,合作開發(fā)多個原位生成CAR-T細胞療法候選物。艾伯維還將擁有Umoja公司臨床前期、擬用于治療血液惡性腫瘤的CD19靶向原位生成CAR-T療法UB-VV111的獨家選擇權(quán)。根據(jù)協(xié)議,Umoja將獲得前期付款,總計高達14.4億美元的選擇權(quán)行使、開發(fā)和監(jiān)管里程碑款項。
5.BI購進一款纖維炎癥性新藥。勃林格殷格翰宣布與Kyowa Kirin達成合作許可協(xié)議,獲得后者開發(fā)的一款新型、潛在“first-in-class"治療纖維炎癥性疾病療法的全球獨家權(quán)利。根據(jù)協(xié)議,Kyowa Kirin將獲得預(yù)付款,開發(fā)、監(jiān)管和商業(yè)里程碑后期付款,交易金額總計達到4.1億歐元。勃林格殷格翰專注開發(fā)纖維炎癥性疾病的相關(guān)療法,其研發(fā)管線中PDE4b抑制劑BI 1015550目前正在兩項III期臨床中用于治療特發(fā)性肺纖維化(IPF)和進展性肺纖維化。
6.Allorion公司兩款新藥授權(quán)給Avenzo公司。Avenzo Therapeutics宣布與Allorion公司達成合作許可協(xié)議,獲得后者臨床早期細胞周期蛋白依賴性激酶2(CDK2)選擇性抑制劑ARTS-021(AVZO-021)大中華區(qū)以外的全球開發(fā)和商業(yè)化權(quán)益,以及一個臨床前期項目的獨家選擇權(quán)。根據(jù)協(xié)議,Allorion將獲得4000萬美元的首付款,開發(fā)、監(jiān)管和銷售里程碑后期款項,以及產(chǎn)品的銷售分成,兩個項目的總交易金額將超過10億美元。
醫(yī)藥熱點
1.首都醫(yī)科大附屬北京地壇醫(yī)院徐州醫(yī)院揭牌。1月6日,第五批國家區(qū)域醫(yī)療中心建設(shè)項目首都醫(yī)科大學(xué)附屬北京地壇醫(yī)院徐州醫(yī)院暨徐州市第七人民醫(yī)院正式揭牌,全面啟動項目建設(shè)。目前,第一批地壇醫(yī)院專家已入駐徐州市第七人民醫(yī)院。下一步,項目醫(yī)院將實行“雙主任制”制度,全面引進北京地壇醫(yī)院優(yōu)勢專科、學(xué)科、技術(shù)、人才管理等資源,打造以肝病、艾滋病、感染性疾病等專科為主、綜合科室協(xié)同發(fā)展的全國一流國家區(qū)域醫(yī)療中心。
2.瑞金醫(yī)院緊急醫(yī)學(xué)救治中心項目獲批。為提升上海市綜合應(yīng)急醫(yī)療救援能力,上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院緊急醫(yī)學(xué)救治中心項目已獲可行性研究報告批復(fù)。瑞金醫(yī)院緊急醫(yī)學(xué)救治中心項目選址位于黃浦區(qū)瑞金二路197號上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院院內(nèi),新建總建筑面積73500平方米,設(shè)置醫(yī)療床位600張。
3.教育部:高校「新」增設(shè)2個藥學(xué)專業(yè)。近日,教育部印發(fā)《服務(wù)健康事業(yè)和健康產(chǎn)業(yè)人才培養(yǎng)引導(dǎo)性專業(yè)指南》。《專業(yè)指南》提到,為對接國家重大需求,服務(wù)健康事業(yè)和健康產(chǎn)業(yè)發(fā)展新態(tài)勢,設(shè)置醫(yī)療器械與裝備工程、老年醫(yī)學(xué)與健康、健康與醫(yī)療保障、藥物經(jīng)濟與管理,生物醫(yī)藥數(shù)據(jù)科學(xué)5個新醫(yī)科人才培養(yǎng)引導(dǎo)性專業(yè)。其中2個藥學(xué)專業(yè),藥物經(jīng)濟與管理、生物醫(yī)藥數(shù)據(jù)科學(xué);生物醫(yī)藥數(shù)據(jù)科學(xué)專業(yè)授予理學(xué)學(xué)位,藥物經(jīng)濟與管理專業(yè)授予管理學(xué)學(xué)位,各專業(yè)修業(yè)年限為四年。
評審動態(tài)
1. CDE新藥受理情況(01月06日)
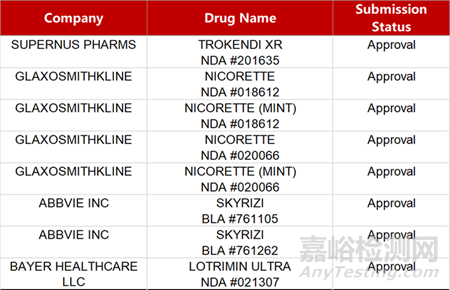
2. FDA新藥獲批情況(北美01月04日)