98%小分子和近100%大分子藥物由于血腦屏障(blood-brain barrier, BBB)的存在而被限制進(jìn)入中樞神經(jīng)系統(tǒng)(central nervous system, CNS)發(fā)揮作用����。BBB結(jié)構(gòu)如下圖所示�����,BBB阻止有害物質(zhì)由血液進(jìn)入腦組織保護(hù)我們的同時,也阻止了藥物分子被攝取吸收��,為神經(jīng)和精神領(lǐng)域工作者提出了挑戰(zhàn)����。
圖1:血腦屏障的解剖結(jié)構(gòu)
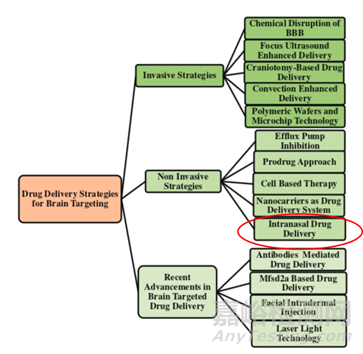
針對BBB的存在,進(jìn)行CNS給藥最直接粗暴的方法便是進(jìn)行腦室手術(shù)給藥(腦室內(nèi)或腦實質(zhì)內(nèi)注射)�,但是該方法價格昂貴�����,對操作人員素質(zhì)要求較高,患者也面臨較高的風(fēng)險����。
圖2:腦部藥物遞送策略
況且目前許多人還存在能吃藥不打針��,能打針不輸液的思想,不到疾病發(fā)展到萬不得已,沒人會進(jìn)行手術(shù)治療�,更不用說腦部手術(shù)了��。鼻腔內(nèi)給藥已經(jīng)成為侵入性給藥方法的一種替代,它可以通過嗅覺和三叉神經(jīng)途徑繞開BBB的障礙而直接靶向CNS���。
鼻腔給藥藥物靶向腦的重要途徑之一�����,它是由阿爾茨海默氏病研究中心的william ll frey博士于1989年首次提出�����,并獲得專利�����。那么,單單拿出來鼻腔給藥這個技術(shù)�,具有什么優(yōu)勢呢�����?
首先,我們的鼻腔具有豐富的血管叢����,藥物可以直接入血而避免消化道破壞和首過效應(yīng)����,改善藥物的生物利用度和動力學(xué)(針對CNS疾病��,藥物直接入血還是會存在BBB障礙)����;其次是鼻腔靠近腦部�,可以迅速提高腦部以及脊髓的藥物濃度,利于靶向治療和降低副作用���;而且鼻腔用藥量少且給藥方便,患者依從性好�。
那么��,鼻腔給藥后藥物是如何通過鼻-腦通路的呢?
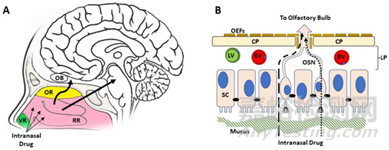
鼻腔給藥后�����,藥物穿過嗅區(qū)(olfactory region, OR)沿嗅神經(jīng)(左箭頭)移動至嗅球(olfactory bulb, OB)�,或沿側(cè)呼吸區(qū)(respiratory regions, RR)和三叉神經(jīng)(右箭頭)移動至腦橋(圖A)�。與嗅覺途徑相比,三叉神經(jīng)通路對鼻-腦藥物轉(zhuǎn)運的貢獻(xiàn)比較小���。藥物也可能通過淋巴管(lymphatics, LV)或脈管系統(tǒng)(vasculature, BV)被全身吸收(圖B)。
其中���,藥物的細(xì)胞內(nèi)轉(zhuǎn)運包括神經(jīng)元對藥物的內(nèi)化、沿軸突的轉(zhuǎn)運以及在 CNS 內(nèi)另一端的胞吐作用。細(xì)胞外途徑中,上皮細(xì)胞之間存在許多緊密連接����,但通道的短暫開放允許分子運動進(jìn)入固有層����;嗅覺神經(jīng)元進(jìn)行新舊替換時的缺口也會允許藥物進(jìn)入固有層����。細(xì)胞外途徑藥物運輸效率高于細(xì)胞內(nèi)運輸,是鼻腔給藥優(yōu)化的重點方向�����。
圖3:鼻腔��、鼻上皮和通往中樞神經(jīng)系統(tǒng)的運輸途徑的解剖學(xué)和組織學(xué)
目前鼻腔給藥的劑型有滴鼻劑(nasal drop)�����、氣霧劑(aerosol)、噴霧劑(spraying agent)��、粉劑(dusts)����、凝膠劑(gel)、微球(microspheres, 1-1,000μm)、脂質(zhì)體(liposomes, 20nm-20μm)以及乳劑(emulsion)�。
下表為部分 FDA 已批準(zhǔn)上市的鼻腔藥物信息�����,以噴劑為主,部分為粉劑提供(BAQSIMI、SPRAVATO�、XHANCE等)�����。相比于液體制劑,粉劑由于穩(wěn)定性高而更適用于蛋白質(zhì)���、多肽類的藥物分子。這些制劑適應(yīng)癥廣泛��,不單單針對CNS類疾病��。
表1:2010年以來 FDA 批準(zhǔn)上市的鼻腔藥物
如上所述���,鼻腔給藥在一定程度上具有其他給藥途徑不可比擬的優(yōu)勢�,且可針對包括CNS在內(nèi)的諸多疾病的治療�,那么鼻腔給藥看似簡單,采用滴鼻方法或噴霧類器械聯(lián)合使用便可��,實則鼻腔也存在給藥障礙����。下面我們看下針對CNS疾病,鼻腔給藥帶來哪些挑戰(zhàn)與對應(yīng)可能的應(yīng)對策略。
首先���,我們先看下鼻腔自身生理環(huán)境對藥物吸收的影響。
鼻腔粘膜面積約200cm2,上皮細(xì)胞與毛細(xì)血管緊密連接,豐富的血管和淋巴管有利于藥物的入血吸收但避免不了BBB的障礙�����。羥甲唑啉被用作過敏和感冒的減充血劑��,作為血管收縮劑,其被證明可以減少鼻子內(nèi)的血流量�����。事實上��,包括溫濕度����、疾?��。ū茄椎龋┖托睦飰毫υ趦?nèi)的多種因素均會對鼻內(nèi)血流量產(chǎn)生影響�����,這為鼻腔給藥帶來了不小挑戰(zhàn)���。
圖4:藥物從鼻腔給藥后靶向CNS通路和障礙
鼻腔有粘液(含有大量水���、離子和蛋白)和纖毛的存在��,粘液纖毛清除機(jī)制限制了疏水和帶電分子的的擴(kuò)散,這為藥物的設(shè)計帶來的挑戰(zhàn)�,因此給藥前鼻腔的清理可能是一個好策略���。纖毛鼻腔前部比后部要少��,為了避免其清除,可將藥物盡量施用在鼻腔前部���。鼻腔也存在有藥物代謝酶��,盡管其相比于消化道酶活性低���,但是在異物清除中的作用也不可忽視����。
其次,我們來看下藥物本身對其吸收的影響���。
鼻腔給藥的藥物一般是小分子(表1常見藥物分子量分布于300-500Da),不帶電�����、親脂性的小分子容易通過粘液�����。當(dāng)然�,藥物的分子量只是限制吸收因素之一�����,研究表明胰島素甚至是干細(xì)胞都能通過鼻腔給藥而達(dá)到腦部轉(zhuǎn)運的目的�。制劑輔料的添加往往會對粘液結(jié)構(gòu)產(chǎn)生影響����,因從需要注意配方問題。粉劑會存在溶解后吸收的過程����,因此溶解度大或增溶劑的添加有利于藥物吸收����。噴霧的藥液粒徑在5-10μm范圍容易沉積在鼻腔后良好吸收��。
剛才說到輔料問題,常見的輔料添加應(yīng)該考慮什么問題呢�?
一般而言��,輔料不僅對粘液產(chǎn)生影響,反過來�,小體積的藥物會被粘液理化環(huán)境所影響�����,因此需要添加緩沖劑(eg. TOSYMRA:檸檬酸鹽、磷酸鹽)�;生物黏附劑(卡波姆)的添加可以減弱粘液纖毛清除��;吸收促進(jìn)劑如表面活性劑(eg. GIMOTI:苯扎氯氨,SPRIX:依地酸二鈉)的添加可以增加鼻粘膜的通透性��;酶抑制劑(eg. SPRIX:依地酸二鈉)的添加可以減弱代謝酶活性�;為了得到一個出色噴霧效果與均一性,DYMISTA添加了纖維素和羧甲基纖維素鈉�����。當(dāng)然��,常見的抗氧化劑����、防腐劑(eg. GIMOTI苯扎氯氨����;DYMISTA:聚山梨酯80)等也是最常見的藥物輔料。輔料的添加可能存在多種作用,如苯扎氯氨兼有防腐和促進(jìn)吸收的作用�����,依地酸二鈉兼有酶抑制和促進(jìn)吸收的作用��。
克服這些問題的制劑方法的共同主題包括減少從鼻腔環(huán)境的清除、改善藥物本身性質(zhì)、合理添加輔料來達(dá)到包括增加滲透性在內(nèi)的目的�。
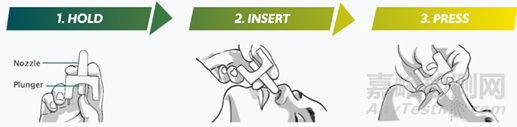
實際給藥過程中發(fā)現(xiàn)諸如頭部姿勢�����、給藥方式(劑型以及器械)、體積在內(nèi)的多種因素會影響藥物在鼻腔的沉積以及進(jìn)入CNS的途徑。臨床前以及臨床實驗建議采用仰臥位的姿勢給藥(小鼠:~5μL�,大鼠:~50μL)�,2020年FDA批準(zhǔn)治療癲癇地西泮(商品名:VALTOCO)噴霧的產(chǎn)品說明見下圖�。盡管動物與人的鼻腔載藥體積、嗅覺占比表面積等存在差異,但是相似的藥物轉(zhuǎn)運吸收途徑也為臨床試驗提供了一定依據(jù)。
圖5:地西泮(100μL/支)噴霧的產(chǎn)品使用說明
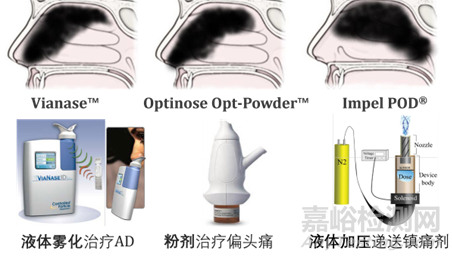
不同的給藥裝置也是影響因素之一�����,目前有包括噴霧器、干粉吸入粉、滴注鼻導(dǎo)管等在內(nèi)的多種鼻腔給藥裝置。
圖6:鼻腔給藥裝置
雖然目前存在有多種給藥裝置,但它們共同的目標(biāo)是將更多的藥物施加在鼻腔的嗅覺區(qū)域�����。
圖7:不同鼻腔給藥裝置給藥后的劑量分布
神經(jīng)系統(tǒng)疾病在老齡化快速的發(fā)展下必然成為未來世界上的一大負(fù)擔(dān)�����,單拿老年癡呆而言���,我國老年癡呆患者實際人數(shù)已遠(yuǎn)遠(yuǎn)超過1000萬���,有著巨大的臨床需求��。BBB限制了系統(tǒng)給藥療法對CNS疾病的治療,對相關(guān)CNS疾病藥物開發(fā)人員的工作提出了重大的挑戰(zhàn)。
圖8:每10萬人中阿爾茨海默病和其他癡呆癥的年齡標(biāo)準(zhǔn)化患病率
鼻腔給藥已經(jīng)有幾十年的長足發(fā)展�,其中腦部靶向已經(jīng)在嚙齒動物和人類實驗中得到了有力證據(jù)的支持�����。包括納米制劑在內(nèi)的新興的制藥技術(shù)與鼻腔給藥方法結(jié)合來突破BBB障礙����,對CNS疾病的治療具有廣闊的應(yīng)用前景。
綜上����,鼻腔給藥來突破BBB進(jìn)行CNS給藥將成為絕佳給藥的候選方案之一����。
路雖遠(yuǎn)���,行則至�����。
參考文獻(xiàn)
1. Xu G, Mahajan S, Roy I, Yong KT. Theranostic quantum dots for crossing blood-brain barrier in vitro and providing therapy of HIV-associated encephalopathy. Front Pharmacol. 2013 Nov 15;4:140. doi: 10.3389/fphar.2013.00140. PMID: 24298256; PMCID: PMC3828669.
2. Crowe TP, Hsu WH. Evaluation of Recent Intranasal Drug Delivery Systems to the Central Nervous System. Pharmaceutics. 2022 Mar 12;14(3):629. doi: 10.3390/pharmaceutics14030629. PMID: 35336004; PMCID: PMC8950509.
3. Hong SS, Oh KT, Choi HG, Lim SJ. Liposomal Formulations for Nose-to-Brain Delivery: Recent Advances and Future Perspectives. Pharmaceutics. 2019 Oct 17;11(10):540. doi: 10.3390/pharmaceutics11100540. PMID: 31627301; PMCID: PMC6835450.
4. Agrawal M, Saraf S, Saraf S, Antimisiaris SG, Chougule MB, Shoyele SA, Alexander A. Nose-to-brain drug delivery: An update on clinical challenges and progress towards approval of anti-Alzheimer drugs. J Control Release. 2018 Jul 10;281:139-177. doi: 10.1016/j.jconrel.2018.05.011. Epub 2018 May 24. PMID: 29772289.
5. Khan AR, Liu M, Khan MW, Zhai G. Progress in brain targeting drug delivery system by nasal route. J Control Release. 2017 Dec 28;268:364-389. doi: 10.1016/j.jconrel.2017.09.001. Epub 2017 Sep 6. PMID: 28887135