摘要:隨著MAH制度的全面實施,藥品技術轉移越來越被企業和各監管機構重視和關注,但目前國內還未設立針對藥品技術轉移的法規或指導原則,相關文獻報道也較少,多數企業未建立完善的制度和體系去指導如何實踐藥品的技術轉移。本文聚焦藥品研發到生產的技術轉移過程,通過梳理國內外關于藥品生產技術轉移的法規,探討技術轉移的分類及實施步驟,結合技術轉移的共性問題提出分析方法轉移、技術轉移風險評估、轉移資料交接過程的思考。為監管和企業實施技術轉移提供依據。
關鍵詞:技術轉移;MAH;過程控制
引言
藥品技術轉移作為藥品生命周期中不可或缺的重要部分,直接關系到產品的安全性、有效性和質量可控性。目前,國內還未設立針對藥品技術轉移的法規或指導原則,相關文獻報道也較少。企業應當始終貫徹“質量源于設計”的理念,建立基于風險和科學的流程和方法設計,最終實現產品受控和數據完整性。結合我公司的具體情況,如各類仿制藥新品開發、一致性評價等環節均涉及技術轉移情況,本文針對藥品技術轉移的法規要求和具體實際過程進行了梳理,為提升公司產品質量管理提出建議。
1、技術轉移的相關法規介紹
2、技術轉移的分類及實施步驟
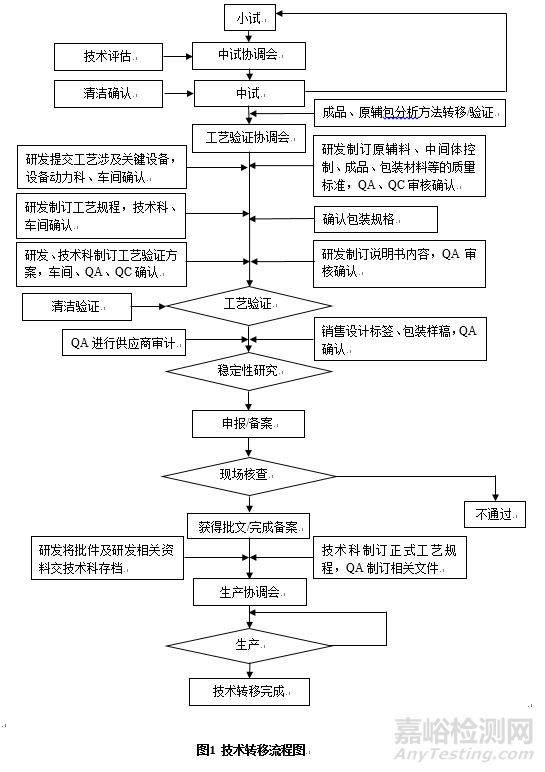
藥品技術轉移,是指把實驗室研究開發階段已經確立,但僅適用于實驗室規模產品的技術成果向商業化生產轉化。技術轉移的內容包括處方工藝、中控項目、原輔包和成品標準、檢驗方法及其它與產品質量相關聯的技術、知識等。隨著中國MAH制度的實施,越來越多的企業選擇將部分藥品研發則委托給專業的CRO,導致研究所進入公司生產車間產生二次轉移,從而導致技術轉移過程越發復雜[1]。按照涉及主體不同,技術轉移大體可以分為以下幾類(表2)。以同一公司研究所轉移至生產車間為例,具體流程主要為:成立技術轉移項目組,召開項目轉移啟動會,指定項目組長。確定需要轉移的文件清單。由接收方根據風險評估結果制定,理清轉出方和轉入方任務清單。實施中試/工藝驗證并形成工藝驗證報告。工藝驗證通過及完成注冊申報/申請備案要求的穩定性研究后,按照《化學藥品新注冊分類申報資料要求(試行)》、《ICH M4人用藥品注冊通用技術文檔》及相關指導原則等要求準備申報/備案資料待資料確認完整無誤后進行注冊申報或備案。現場核查、技術審評均通過后獲得生產批文或完成備案,最終完成資料移交,正式生產。具體流程圖參考如圖1所示。
3、技術轉移的過程控制及思考
3.1重視技術轉移的共性問題
在研發產品首次進車間前進行充分的風險評估[2],根據產品的溶解性,研究更適宜產品特性的清洗方式,加強各部門之間的溝通和協作,確保按照正確的清潔驗證程序清洗,取水取樣器具無污染,關注工藝的合理性和過程控制,分析方法驗證和轉移的合規性并重視技術轉移過程中的人員培訓。
3.2分析方法轉移方式的思考
分析方法轉移的方式通常分為4種:比對測試、兩個或多個實驗室共同驗證、再驗證和轉移豁免[3]。
3.3技術轉移過程中的風險評估管理
在技術轉移期間,通常會伴隨著變更的發生,變更的范圍經常包括物料、設備、質量標準和生產工藝。變更控制是知識管理的重要組成部分,企業應建立適當的變更管理系統,并在項目結束報告中總結相關變更的原因、過程、依據及評估結論。對于合并入工藝或系統中的變更均應清楚記錄。變更管理應當確保變更能夠按照流程進行追蹤、評估、實施和記錄。充分的變更控制能夠對技術轉移過程中的一些調查性工作提供支持。所有關鍵工藝參數及質量參數必須加以控制,以確保最終藥品的質量得到支持。在使用新設備時,通常使用中試批次來收集初始信息,同時最大程度地減少原輔料的使用。設計這些批次時要考慮最終的規模/設備,這一點很重要,有可能中試批次摸索出的工藝參數在商業化規模生產中并不適用,需要重新確定參數。中試批次還可用于解決轉移風險評估中確定的差距。團隊應共同制定取樣方案,包括取樣計劃、樣品需要進行哪些測試以及將樣品送到哪個實驗室進行檢測等。
我公司設計的中試、工藝驗證過程中的綜合評估表包括以下內容(表5),通過找出轉出方和轉入方在人員、設備、物料、生產工藝和清潔方法、環境、檢測等方面的差距和不同,評估對技術轉移的影響并給出相應的對策。可參考ICH Q9給出的風險評估方法對以上方面進行評估(圖2),找出關鍵風險點并給出相應的對策[4]。
圖2 ICH Q9質量風險管理程序總覽
3.4 技術轉移資料的移交工作
獲得生產批文或完成備案后,研究所應將注冊批、工藝驗證批等代表批次相關資料如批記錄、檢驗報告、工藝驗證方案、工藝驗證報告等;申報資料;委托第三方進行研究的相關方案、報告等;批件及附件交技術科存檔。根據生產批文、相關附件及移交的其他文件資料等,技術科制訂正式的工藝規程,QA制訂質量標準等文件。技術科召開生產協調會,準備獲批后的首次生產。
技術科負責協調安排各部門工作,藥研所、車間、QA、QC配合。生產過程中,藥研所工藝研究人員應指導車間操作人員操作,必要時由車間提出再次培訓要求;藥研所質量研究人員指導QC分析人員分析檢測。獲批后的首次生產結束后,涉及生產相關部門要將生產時的情況進行匯總。確保轉移工作順利完成。
4. 總結與展望
藥品生產技術轉移是一個極其復雜的過程,知識和經驗的傳遞是關鍵要素,傳遞過程以文件為載體,這些文件包括了藥品的生產工藝、控制策略、工藝驗證方法,除了在技術轉移過程中發生重要作用,在日后的商業化生產和持續性工藝優化過程中,也是重要的參考。參與技術轉移的各方應加強對技術轉移工作的認識,充分掌握現有藥品法律法規,優化技術轉移流程,積極有效的應對醫藥改革帶來的機遇與挑戰,充分保證我司藥品的安全、有效和質量可控。
參考文獻
[1]李力,丁滿生,路慧麗等.基于風險評估的技術轉移及其管理[J]. 中國醫藥工業雜志,2020,51(6):795-800
[2]《藥品上市許可持有人制度試點方案》政策解讀[J].中國制藥信息, 2016(9): 10-11
[3]國家藥典委員會,《中華人民共和國藥典》2020年版 9100分析方法轉移指導原則[S].北京:中國醫藥科技出版社,2020.
[4] 國家藥品監督管理局藥品審核查驗中心.關于公開征求《藥品共線生產質量管理指南(征求意見稿)》意見的通知[EB/OL].(2021-11-12).http://www.cfdi.org.cn/ resource/news/ 14085.html