包裝系統可分為直接接觸藥品的包裝組件和次級包裝組件,這兩者共同確保產品的密封性。容器的密封性對產品的質量穩定具有關鍵作用,它能夠預防內容物損失、微生物侵入以及受到氧氣、水蒸氣或其他物質的影響。根據藥審中心發布的《化學藥品注射劑包裝系統密封性研究技術指南(試行)》和《化學藥品注射劑仿制藥質量和療效一致性評價技術要求》,對于無菌制劑,需要選擇適當且經過驗證的密封性檢測方法對樣品進行監測。密封性優選能夠確定產品最大允許泄露限度的確定性方法。如果方法的靈敏度無法達到產品最大允許泄露限度水平,建議至少采用兩種方法進行密封性驗證,其中一種推薦使用微生物挑戰法。常用的密封性檢測方法見表1。
表1 常見的密封性檢測方法
對于無菌制劑而言,在產品開發階段,需結合藥品自身特點及生產設備綜合考慮,選擇合適的密封性檢測方法,并對兩種方法進行驗證,進而在日常商業化生產中,選擇靈敏度最高的方法對產品進行抽樣檢測。然而,對于熔封產品(如玻璃或塑料安瓿),應進行100%的密封性檢測。一般出于便利性和商業化成本的考慮,可以選擇微生物挑戰法和色水法對產品的密封性進行研究。通過比較色水的濃度、檢漏壓力和時間等參數,選擇開發出靈敏度更高的色水檢測方法,并將其作為日常商業化密封性檢測的方法。
如某產品選擇中硼硅管制注射劑瓶作為容器、膠塞進行加塞密閉,鋁塑組合蓋軋蓋的包裝形式進行密封,同時參考USP<1207>等相關技術要求,可選擇微生物侵入法和真空衰減法進行包裝系統密封性研究。
(1)微生物侵入法
微生物侵入試驗是對容器密封系統完好性的挑戰試驗,通過對菌種、菌液濃度、侵入壓力和侵入時間等篩選,選擇合適的微生物侵入法條件。在驗證過程中,取缺陷短波單胞菌新鮮培養物,接種至100ml胰酪大豆胨液體培養基中,置30℃-35℃培養48h,再用胰酪大豆胨液體培養基進行10倍濃度稀釋3次,進行菌液濃度檢測,保證菌液濃度不小于106cfu/ml的要求。
取100個中硼硅管制注射劑瓶(其中50個為陽性打孔樣品,分別由外部廠家打孔3.75µm,5µm,10µm,15µm,20µm,各孔徑10個,分為5組),剩余50個隨機分成10個一組,灌裝胰酪大豆胨培養基(灌裝量需與產品注射液一致),壓塞和軋蓋將容器密封。將灌裝后的容器經121℃ 15min滅菌。取出試樣冷卻,倒置使培養基與容器密封處充分接觸,在30℃~35℃下倒置培養14天,檢查是否有微生物侵入,以確定容器密封系統的完好性;所有試樣培養14天均不長菌時,隨機取10個試樣(非陽性打孔試樣),接種缺陷短波單胞菌菌懸液,在30℃~35℃培養7天,觀察菌種生長情況,且鑒定菌種,確認培養基促生長能力。
將30個經121℃ 15min滅菌的試樣(非陽性打孔試樣),倒置浸沒在菌懸液中4h,30℃~35℃培養7天,該組試樣為試驗組;取10個經121℃15min滅菌的試樣,不浸入菌懸液中,該組試樣為陰性對照組;5組陽性打孔試樣(3.75μm,5μm,10μm,15μm,20μm),每組10個浸入菌懸液中4h,30℃~35℃培養7天,該組試樣為陽性打孔對照組,進行微生物侵入法實驗驗證,結果顯示:
①試驗組、陰性對照組培養基澄清、無菌生長;
②陽性打孔對照組 3.75μm 3個長菌,泄露率30%;
陽性打孔對照組5μm 5個長菌,泄露率50%;
陽性打孔對照組10μm 9個長菌,泄露率90%;
陽性打孔對照組15μm 10個長菌,泄露率100%;
陽性打孔對照組20μm 10個長菌,泄露率100%;
且確認生長菌種為缺陷短波單胞菌。
由此確定微生物挑戰實驗靈敏度為15μm。
(2)真空衰減法
真空衰減法是一種無損的定量測試方法,可用于評估容器的密封性能。其原理是將樣品放入測試腔體內,然后對測試腔體抽真空,通過容器內外的壓差,容器內的氣體會通過漏孔進入測試腔體。壓力傳感器會檢測到壓力的變化,將其與參考壓力值進行比較,從而確定容器是否泄漏。
在進行密封性方法驗證之前,可以先委托機構制備陰性樣品(即實心體)、陽性樣品(包括3.75μm、5μm、10μm)以及大漏樣品(不帶膠塞的注射劑瓶)。然后,使用儀器的經驗參數對真空衰減法的密封性方法進行開發。如果分辨能力不強,可以調節參數以獲得合理的結果。
在進行密封性方法驗證時,可按照以下要求進行操作:
①靈敏度驗證
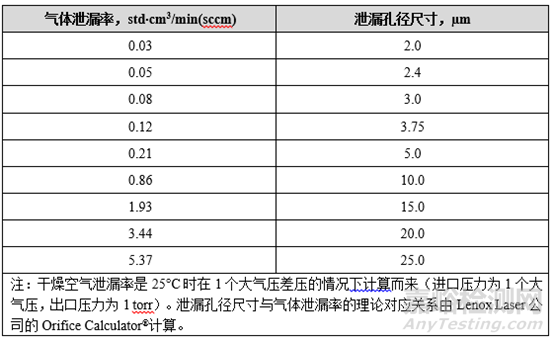
用流量計進行模擬泄露孔徑,氣體泄露率與泄露孔徑尺寸對應關系詳見表1。打開流量計在0.00ccm、0.08ccm、0.12ccm、0.21ccm依次進行20次重復測試,本品0.12ccm時20次測試結果均為不通過,可知檢出限為0.12ccm。
表2 氣體泄漏率與泄漏孔徑尺寸對應關系
②專屬性驗證
隨機對陰性樣品、陽性樣品(3.75μm、5μm、10μm)及流量計模擬的泄漏0.12ccm(檢測限級別)進行測試,結果顯示:陰性樣品檢測結果均為通過;陽性樣品(檢測限及以上級別的3.75μm、5μm和10μm陽性瓶)檢測結果均為不通過;流量計模擬的泄漏(檢測限級別0.12ccm)檢測結果均為不通過。說明方法的專屬性較好。
③線性
分別測試陰性樣品,0.03ccm、0.05ccm、0.12ccm、0.21ccm、0.86ccm,每個測試點測試6次,取壓差平均值,以壓差平均值與測試點做出線性曲線圖,求其方程和r2,得到r2為0.9998,不低于0.995,線性通過。
④準確度
陰性樣品重復測定10次,測試結果均為通過;流量計模擬的泄漏(檢測限0.12ccm及以上一個級別0.21ccm)測試結果均為Fail,能夠使不漏的樣品和流量計模擬的泄漏結果得到區分,符合標準。說明方法的準確度較好。
⑤重復性、中間精密度
由一實驗員測試3.75μm陽性樣品6次,得出6次壓差RSD為3.2%≤10%;再由另外實驗員于不同時間測試的3.75μm陽性樣品6次,得出6次壓差RSD為4.2%≤10%,且12次壓差RSD為3.1%≤10%,說明此方法重復性、中間精密度較好。
⑥耐用性
將測試方法中測試時間減少1s和增加1s,分別測試陰性樣品、3.75μm陽性樣品,每個測試6次,陰性樣品結果均為合格,3.75μm陽性樣品均為不合格。說明方法耐用性好。
由此驗證可知該方法靈敏度為3.75μm。
(3)擬定生產階段的密封性檢查
由上可知,微生物侵入法靈敏度為15μm,真空衰減法靈敏度為3.75μm,真空衰減法靈敏度高于微生物侵入法,選擇真空衰減法作為該產品日常密封性檢測方法。
參考文獻:
1.國家藥品監督管理局藥品審評中心.《化學藥品注射劑包裝系統密封性研究技術指南(試行)》(2020年第33號).
2.國家藥品監督管理局藥品審評中心.《化學藥品注射劑仿制藥質量和療效一致性評價技術要求》(2020年第2號).
3.USP <1207> Package integrity evaluation-sterile products.
4.USP <1207.1> Package integrity testing in the product life cycle-test method selection and validation.
5.USP <1207.2> Package Integrity Leak Test Technologies.
6.USP<1207.3> Package Seal Quality Test Technologies.
7.《藥品GMP指南 無菌藥品》中國醫藥科技出版社, 2011.