Surmodics宣布FDA批準其載藥球囊---SurVeil上市,SurVeil可以用于治療股動脈和腘動脈的新發或再狹窄病變。使用動脈血管直徑為 4 -7 mm。
FDA之所以批準SurVeil上市,基于SurVeil與行業標桿美敦力的IN.PACT Admiral的頭對頭臨床研究結果(SurVeil DCB TRANSCEND )強力支持。
SurVeil DCB TRANSCEND 研究結果
24 個月的臨床試驗結果證明了SurVeil安全性和有效性結果的持久耐用性。SurVeil 在顯著降低的藥物劑量下仍然不劣于美敦力的IN.PACT Admiral。
24個月時:接受 SurVeil治療的受試者中有 81.8% 達到了次要安全終點,即在指數手術后30天內沒有與器械和手術相關的死亡以及沒有主要目標肢體截肢(腳踝以上)和臨床驅動目標的綜合血管再血管化 (CD-TVR) 對比 83.2% 的接受 IN.PACT Admiral治療的受試者。
在該試驗的兩組中,不到15%的患者需要重復血運重建手術。IN.PACT Admiral組中的一名患者需要進行大腿截肢術。
SurVeil受試者的初級通暢率為 70.8%,而 IN.PACT Admiral 為 70.4%。
PI評價
“我很高興Surveil將可用于治療美國的患者,Surveil是根據TRANSCEND試驗的結果確定的下一代DCB,這是與市場領先的DCB進行的唯一的頭對頭關鍵研究。Surveil 在治療后兩年以大幅降低的藥物劑量成功證明了非劣效性安全性和有效性。”
---- Kenneth Rosenfield TRANSCEND臨床試驗的聯合首席研究員
隨著SurVeil上市,美國患者享受到下一代載藥球囊救治,而且Surmodics也能夠緩解資金壓力。早前雅培獲得SurVeil全球獨家商業化權利,一旦SurVeil在美國上市,雅培需要支付約2700萬美元里程碑獎金。3個月之前,由于FDA認定SurVeil注冊資料不完善需要修改相關資料(這是FDA第二次不準許SurVeil注冊,坊間傳聞雅培都可以放棄SurVeil),同時有行業大環境比較差和自己兩款核心產品SurVeil和Pounce商業化差,導致資金缺口越來越大,不得已裁員13%。
沒想到FDA收到Surmodics整改資料后如此之快批準(比Surmodics預期快了半年),讓年初裁員變得有點倉促。
SurVeil
SurVeil是一款低載藥劑量的載藥球囊,其負載藥物和IN.PACT Admiral藥物一樣都是紫杉醇,區別在于兩者載藥量不同。IN.PACT Admiral DCB 的紫杉醇載藥量(3.5 µg/mm²)比 SurVeil高 75%,后者的載藥量為 2.0 µg/mm²。 SurVeil的設計旨在提供更均勻的藥物分布、更高的藥物轉移效率以及更少的下游顆粒和下游栓塞。
SurVeil之所以在低載藥量情況下實現與IN.PACT Admiral相同臨床效果,主要是因為SurVeil采用了Surmodics專有的Bravo載藥涂層技術。
Bravo是采用SynBiosys和urethan多嵌段共聚,并添加了丙交酯/乙醇酯/己內酯聚乙二醇等化合物。
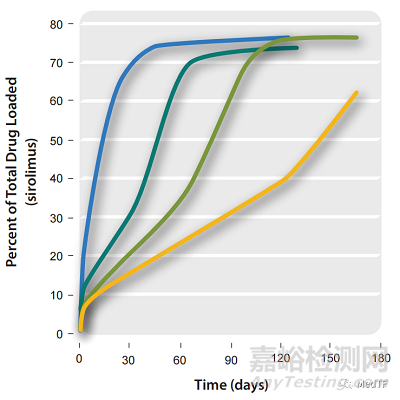
Bravo可以根據涂層中的聚合物比例實現藥物釋放速率,既可以突釋也可以緩釋。藥物釋放時間從幾周到幾個月,可以根據需要調節。
Bravo涂層在血液中主要通過水解方式降解,降解產物無毒副產物。可以通過正常的生理過程被代謝或排泄出體外。
Surmodics
Surmodics是用于體外診斷免疫測定測試和微陣列的血管內醫療器械和化學成分的表面改性技術的領先供應商。 Surmodics正在追求高度差異化的醫療設備開發和商業化,這些設備旨在滿足未滿足的臨床需求并根據最苛刻的要求進行設計。Surmodics使命仍然是改善疾病的檢測和治療。