導 讀
本篇內容詳細介紹了作為人工器官潛在的治療方法之3D生物打印,詳細介紹了目前在研究階段的3D打印技術以及技術對比,其次介紹了打印所用的天然材料和高分子材料及相應的優缺點,最后介紹了材料結合細胞的打印方式。
(一)3D打印技術
與傳統制造技術相比,3D打印技術在生物人工器官制造方面具有諸多優勢,尤其適用于快速、精準、定制化的生物醫學應用。如下圖所示是目前研究中常用的3D打印技術:
(A)噴墨3D打印(Inkjet 3D printing);基于噴墨的 3D 打印是一種非接觸式增材制造(AM)技術,改編自工業 2D 打印機。在傳統的 2D 打印中,一層液滴被選擇性地沉積,而在 3D 生物打印中,可以通過改變“生物墨水”和沉積層的內容,將細胞和蛋白質打印成所需的器官形狀。按需噴墨打印機是最常用的設備,由聲學、熱學、壓電或靜電噴墨噴嘴組成。噴墨打印機通常用于打印用于細胞接種的組織工程支架。但打印分辨率差、打印速度慢等問題極大地限制了其保真度和臨床推廣1;
( B ) 基于擠壓的 3D 打印(Extrusion based 3D printing);與 FDM 類似,基于擠壓的 3D 打印將“生物墨水”從注射器或噴嘴沉積到基于 CAD 模型的構建平臺上,但該過程不涉及任何加熱過程。含有細胞、生長因子和其他生物活性劑的聚合物溶液或水凝膠可以通過氣動壓力或物理壓力的方式通過噴嘴擠出。
與其他3D打印工藝相比,基于擠壓的3D打印技術提供了更高的打印速度。隨著擠壓3D 打印技術的發展,多種細胞類型可以以非常高的細胞密度與不同的生物相容性聚合物溶液/水凝膠一起沉積。聚合物溶液或水溶膠的固化是通過一系列物理和化學方法,如物理交聯)、聚合、化學交聯和酶促反應2。
打印后的細胞活力在40%到80%的范圍內。通過優化打印參數,如沉積速率、壓力和溫度,可以提高細胞存活率3。
( C ) 熔融沉積成型(Fused deposition modeling,FDM);通過一個或多個帶有小孔的加熱擠壓頭,以特定的鋪設模式逐層沉積熔融熱塑性聚合物,也被稱為“熱塑性擠出”。在 FDM 中,將熱塑性聚合物熔化成半液態,然后將半液態聚合物逐層擠出到平臺上。擠出前的熱塑性聚合物一般呈絲狀或顆粒狀。當熱塑性聚合物被加熱到高于其熔點的溫度時,它會變成流體并從噴嘴中流出。一旦塑料聚合物從噴嘴中流出,它就會硬化并與下面的層結合。一旦構建了一層,降低平臺或升高噴嘴,擠出噴嘴沉積另一層4。FDM技術在器官3D打印領域的致命缺點之一是細胞、生長因子和其他生物活性劑不能在高聚合物熔化溫度下直接打印。
( D )立體光刻(Stereolithography,SLA);最早出現的 3D 打印技術,SLA 是最成熟的 3D 打印方式,在業界得到廣泛應用。在 SLA 中,主要利用紫外激光為光源,再用振鏡系統來控制激光光斑掃描,激光束會在液體樹脂表面上先畫出一個物件形狀,隨后打印平臺會下降一定距離,再讓平臺浸入液體樹脂中,如此反復,形成實體打印。
與其他傳統方法相比,光固化生物3D打印具有靈活性高、分辨率高、制造速度快等特點。這些特性使其廣泛應用于角膜基質組織再生、胰島素輸送、組織工程支架制造等領域5。
目前SLA的缺點也很明顯6:
打印技術局限性:不同的SLA技術對燈管波長、打印尺寸、“生物墨水”黏度要求不同,難以標準化。
材料局限性:可用作“生物墨水”的光固化生物材料較少,且具有所需的低粘度。
成本限制:SLA儀器及其打印的生物材料價格昂貴,導致臨床試驗受限。
( E ) 氣溶膠噴射打印(Aerosol jet printing):氣溶膠噴射打印是一種非接觸式打印方法,具有高分辨率和靈活性。“生物墨水”被放置在霧化發生器中,并通過超聲波或氣動霧化成氣溶膠顆粒,然后通過惰性氣體輸送到打印噴嘴7。
該方法可以打印在金屬、半導體、聚合物等多種基材上,產品廣泛應用于電子領域。醫療設備主要是對柔性、可拉伸和可穿戴電子產品的探索。但研究表明,超聲處理可使DNA變性,限制了其在生物醫學領域的應用。到目前為止,除了心臟補片工程和蛋白質檢測外,很少有使用該方法進行 3D 打印器官的研究8。
表 打印技術對比
(二)3D生物材料墨水
生物墨水是指位于 3D 或生物材料內的細胞或細胞聚集體。在生物打印領域,生物墨水指的是載有細胞,生物材料墨水單純指材料即無細胞。因此,構成生物墨水的生物材料必須作為細胞載體,生物材料墨水可以打印,但只能在打印后播種細胞。如下圖所示9:

3D打印材料作為承載細胞以及相關因子的重要載體,材料必須具有如下的特點10:
a.可打印性:即用于打印的材料必須可以在一定的時間內精確地沉積在所指定的空間內,該性能直接關系到3D打印產品是否能取得期望的結構與尺寸精度;打印參數如噴頭尺寸,會直接影響到材料內細胞所受到的剪切應力及材料沉積形成3D結構所需的時間,需要同時考慮對細胞活性的保護能力;
b.生物相容性:從最初的要求材料能夠與組織器官共存,且不引起宿主任何不良的局部或系統反應,發展到植入材料需要與宿主產生積極的相互作用,包括與宿主組織和/或免疫系統的相互作用,以達到調控宿主細胞、組織和器官活性與功能的目的;生物相容性主要受材料的化學組成、結構形態(如多孔結構/絲狀結構)、表面特性(如親疏水性)、表面電荷以及材料的力學性能、物理化學特性等因素的影響;
c.力學穩定性:材料具有一定的力學強度,能夠一定程度上抵抗外界作用力,維持打印物的形貌結構,在3D打印構建組織器官的相關研究中,應根據不同靶組織器官(如皮膚、肝臟、軟骨、骨等)所需的結構力學環境,選用具有相應力學特性的打印材料;
d.降解特性:理想的生物打印材料,植入體內后應當隨著細胞的增殖及細胞外基質(ECM)的產生而逐漸降解,且降解速率應當與細胞產生ECM替換植入材料的速率,及新組織生成的速率相匹配,同時降解產物應該無毒。易于代謝,能夠快速代謝排除體外;
f.仿生學特性:材料仿生學特性有利于刺激細胞響應.在生物材料中摻入生物活性組分可對內源或外源細胞的粘附、遷移、增殖及功能表達產生積極作用,材料表面性質如化學基團的修飾、粗糙度、親疏水性、微納米結構等直接影響到細胞的鋪展形狀、分化過程、運動、取向、細胞骨架的組裝,甚至是細胞內部的相關信號通路。11
1、生物打印材料
用于生物3D打印的高分子材料可分為合成高分子材料與天然高分子材料。用于生物3D打印的天然高分子材料有三個突出特點:良好的生物相容性、較差的機械強度和快速的生物降解性。經過幾十年的探索,常用的高分子材料的性質總結如下表:
合成高分子網絡由可重復的惰性單元組成。它們通常在機械性能和免疫原性反應方面優于天然高分子材料。常用的可生物降解合成聚合物包括 PLA、PGA、PU、PLGA 和 PCL。與天然聚合物相比,大多數合成聚合物明顯優點包括合成方便、資源豐富、易加工、耐壓、重量輕、成本低。其特點總結如下表13:
2、多材料3D打印
材料在體外打印構建組織器官時,需起到保護支撐、維持活性、誘導分化、引導新生以及促使功能成熟等多重功能。因此,任何單一組分的材料都不可能兼具重構組織功能所需的所有特性。開發多材料3D打印成為一個必然的趨勢。多材料比單一材料方法更好地復制其宿主微環境。
多組分生物墨水是指由兩種或兩種以上不同的生物材料混合而成的單相均質生物墨水。使用多種材料打印,必須考慮材料界面處的相互作用。較高的界面粘附力可以提高生物打印結構的韌性和抗疲勞性。但是,在多材料(生物)打印過程中,將水凝膠與不同性質的材料(尤其是彈性體和熱塑性塑料)結合起來具有挑戰性15。用于多材料打印的3D打印技術如下圖所示:
以下簡單列舉幾項多材料打印技術:
1)單噴嘴生物打印技術
通過一個噴嘴擠出不同的生物墨水仍然是多材料生物打印的形式。如下圖所示:多儲液器系統和混合器是兩種最常見的相關方式。混合器的作用是混合兩種或多種不同濃度的生物墨水,以促進多材料打印,從而促進制造具有連續梯度特性的結構。
2)多噴嘴生物打印技術16
單噴嘴技術的一個缺點是(生物)墨水在一個噴嘴中流動時存在交叉污染的風險。多噴嘴多材料生物打印機與單噴嘴生物打印機相比,可以以更快的速度和更大的構建體積制造更復雜的特征。
3)同軸生物打印技術
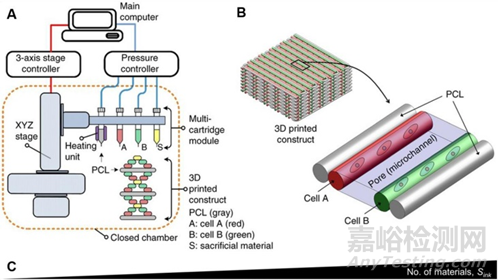
同軸噴嘴是一種用于生物打印多材料核殼結構的機制,如血管結構、異質微纖維和腫瘤模型。能夠制造具有成分和幾何復雜性的中空結構。同軸噴嘴特別適用于與交聯劑混合后快速交聯的生物墨水。例如:下圖B中,CaCl 2用于內部噴嘴以離子交聯生物墨水。雙層管狀結構隨后通過紫外線再次交聯以形成穩定的結構。使用這種設計,可以一步連續改變形狀、尺寸和層數,而無需更換噴嘴。這些圓周多層構造可用作人體套管組織模型17。

3、3D打印干細胞
干細胞是一類具有自我更新能力,并能分化成其他類型細胞的特殊細胞,而人體正常組織的更新和修復與組織特異性干細胞密切相關,如骨髓干細胞、胚胎干細胞( embryonic stem cells,ESC )、造血干細胞、內皮祖細胞等。隨著技術進步, 2007 年已實現人工將人的成年體細胞經過基因重組技術培養成誘導型多能干細胞( induced pluripotent stem cells , iPSC )18
干細胞治療特點19:
① 治療適用性強:干細胞可以從單個細胞分化成內胚層、中胚層和外胚層所有的細胞,最終形成機體的所有組織和器官,其成品可以在生物內環境中移植、存活并保持長期穩定。因而其治療范圍理論上可涵蓋人體任何組織器官及相關疾病(如神經系統損傷、免疫功能障礙、器官衰竭、美容、斷肢等),在自體組織器官移植方面有不可替代的作用;
② 獲取容易:細胞技術發展初期,細胞來源往往局限于生物組織甚至體內采集,不可避免產生創傷及相應副作用,隨著技術發展,干細胞已經可以通過人工誘導獲取,是目前免疫治療和基因治療的最佳載體。
③ 副作用少且效果持久:干細胞治療是能夠以患者自身的細胞為基礎,制作相應的干細胞并形成適用于疾病的治療手段,在應用時減少了組織相容性的問題,減低乃至消除了治療、移植過程中的排斥反應及使用免疫抑制劑所產生的副作用,且植入細胞并非快速消耗品,其定植于體內后可產生持久的治療效果。
目前細胞打印在生物醫學領域可應用的打印方案:
① 先打印出具有生物相容性的支架材料,再將有活性的細胞、干細胞組織種植到材料上形成細胞 - 材料復合體, 然后將細胞 - 材料復合體植入組織缺損部位,支架材料在逐步降解的同時,種植的細胞不斷增殖、生長,形成細胞間連接,從而達到修復組織缺損的目的20;
② 將細胞與支架材料直接混合打印,一個或多個打印噴頭打印細胞懸浮液,另一個或多個噴頭打印細胞生長所需的支架(微環境),其支架材料的主要成分是含水的生物凝膠,逐層打印, 疊加形成 3D 的多細胞 - 凝膠支架體系,最終用于治療或移植。活細胞的打印可實現組織器官結構及部分生物功能的重建,而由于打印過程是由計算機控制細胞排列,兩種方案在技術上均可在生物體內進行原位打印,如原位軟骨細胞打印進行骨修復;
③ 新興方案,將細胞預制成細胞團,打印時使用臨時的固定裝置,如微型探針等以預期打印結構為目標進行結構固定,讓細胞團生長融合達到穩定狀態再去除臨時固定裝置,最終形成細胞自行連接的緊密結構,從而實現無支架的細胞打印21。
參考文獻:
[1] Gudapati, H.; Dey, M.; Ozbolat, I. A comprehensive review on droplet-based bioprinting: Past, present and future. Biomaterials.2016, 102, 20–42.
[2] Ricci, J.L.; Clark, E.A.; Murriky, A.; Smay, J.E. Three-dimensional printing of bone repair and replacement materials: Impact on craniofacial surgery. J. Craniofacial Surg. 2012, 23, 304–308.
[3] Billiet, T.; Gevaert, E.; De Schryver, T.; Cornelissen, M.; Dubruel, P. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials 2014, 35, 49–62.
[4] Turner, B.N.; Strong, R.; Gold, S.A. A review of melt extrusion additive manufacturing processes: Process design and modeling.Rapid Prototyp. J. 2014, 20, 192–204.
[5] Mahdavi, S.S.; Abdekhodaie, M.J.; Kumar, H.; Mashayekhan, S.; Baradaran-Rafii, A.; Kim, K. Stereolithography 3D bioprinting method for fabrication of human corneal stroma equivalent. Ann. Biomed. Eng. 2020, 48, 1955–1970.
[6] Song D, Xu Y, Liu S, Wen L, Wang X. Progress of 3D Bioprinting in Organ Manufacturing. Polymers (Basel). 2021 Sep 18;13(18):3178.
[7] Serpelloni, M.; Cantù, E.; Borghetti, M.; Sardini, E. Printed smart devices on cellulose-based materials by means of aerosol-jet printing and photonic curing. Sensors 2020,20, 841.
[8] Basara, G.; Saeidi-Javash, M.; Ren, X.; Bahcecioglu, G.; Wyatt, B.C.; Anasori, B.; Zhang, Y.; Zorlutuna, P. Electrically conductive 3D printed Ti3C2Tx MXene-PEG composite constructs for cardiac tissue engineering. Acta Biomater. 2020, 19.
[9] Groll, J.; Burdick, J.A.; Cho, D.W.; Derby, B.; Gelinsky, M.; Heilshorn, S.C.; Jüngst, T.; Malda, J.; Mironov, V.A.; Nakayama, K.; et al.A definition of bioinks and their distinction from biomaterial inks. Biofabrication 2018, 11, 013001.
[10] 毛宏理,顧忠偉.生物3D打印高分子材料發展現狀與趨勢[J].中國材料進展,2018,37(12):949-969+993.
[11] 朱敏,黃婷,杜曉宇,朱鈺方.生物材料的3D打印研究進展[J].上海理工大學學報,2017,39(05):473-483+489.
[12] Fatimi A, Okoro OV, Podstawczyk D, Siminska-Stanny J, Shavandi A. Natural Hydrogel-Based Bio-Inks for 3D Bioprinting in Tissue Engineering: A Review. Gels. 2022 Mar 14;8(3):179.
[13] Assad H, Assad A, Kumar A. Recent Developments in 3D Bio-Printing and Its Biomedical Applications. Pharmaceutics. 2023 Jan 11;15(1):255.
[14] Fatimi A, Okoro OV, Podstawczyk D, Siminska-Stanny J, Shavandi A. Natural Hydrogel-Based Bio-Inks for 3D Bioprinting in Tissue Engineering: A Review. Gels. 2022 Mar 14;8(3):179.
[15] Ravanbakhsh H, Karamzadeh V, Bao G, Mongeau L, Juncker D, Zhang YS. Emerging Technologies in Multi-Material Bioprinting. Adv Mater. 2021 Dec;33(49):e2104730.
[16] Kolesky DB, Truby RL, Gladman AS, Busbee TA, Homan KA, Lewis JA, Adv. 2014, 26 , 3124.
[17] Pi Q, Maharjan S, Yan X, Liu X, Singh B, van Genderen AM, Robledo-Padilla F, Parra-Saldivar R, Hu N, Jia W, Xu C, Kang J, Hassan S, Cheng H, Hou X, Khademhosseini A, Zhang YS, Adv. Mater 2018, 30, 1706913.
[18] Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripo-tent stem cells from adult human fibroblasts by defined factors [J]. Cell, 2007, 131(5): 861-872.
[19] 莊東林,趙明一,劉南波,何標川,黃煥雷,朱平.3D打印技術在干細胞再生領域的發展及應用[J].生物醫學工程與臨床,2020,24(04):489-495.
[20] Park KM, Shin YM, Kim K, et al. Tissue engineering and regenerative medicine 2017: A year in review [J]. Tissue Eng Part B Rev, 2018, 24(5): 327-344.
[21] Moldovan NI, Hibino N, Nakayama K. Principles of the ken-zan method for robotic cell spheroid -based three -dimensional bioprinting[J]. Tissue Eng Part B Rev, 2017, 23(3): 237-244.