今日頭條
開拓AR拮抗劑美國雄禿II期臨床積極。開拓藥業雄激素受體(AR)拮抗劑福瑞他恩(KX-826)治療男性雄激素性脫發(脂溢性脫發或AGA)的美國II期臨床達到主要研究終點。治療24周后,KX-826 0.5%濃度BID組的目標區域內非毳毛數(TAHC)較基線增加約10根/cm2,具有統計學意義(P=0.0088)。KX-826較安慰劑在TAHC變化方面呈現出數值上的優勢,且不同KX-826劑量組之間存在劑量效應關系。此前,KX-826治療女性脫發的中國II期臨床試驗也達到主要終點。
國內藥訊
1.大冢Bcr-Abl激酶抑制劑中國報產。大冢制藥5.1類化藥泊那替尼片上市申請獲國家藥監局受理。泊那替尼片是大冢制藥與武田聯合開發的第三代Bcr-Abl激酶抑制劑,已于今年4月11日被CDE納入優先審評,擬定適應癥包括對既往用藥耐藥或不耐受的慢性髓性白血病(CML);復發或難治性費城染色體陽性急性淋巴細胞白血病(Ph+ALL);以及T315I陽性CML或T315I陽性Ph+ALL。
2.神州細胞4價新冠疫苗III期臨床積極。神州細胞重組新冠疫苗4價S三聚體蛋白疫苗SCTV01E用于≥18周歲已完成基礎免疫或加強免疫人群中接種加強免疫的國內III期臨床達到主要研究終點。數據顯示,1針SCTV01E加強免疫后14天至4個月,預防所有新冠病毒感染(含有癥狀和無癥狀感染者)的保護效力(VE)為82.4%(95%置信區間:57.9%,92.6%);預防有任何癥狀新冠病毒感染的保護效力為79.7%(95%置信區間:51.0%,91.6%)。此外,疫苗安全性良好。
3.正大天晴c-Met抑制劑啟動肺癌Ⅲ期臨床。正大天晴口服c-Met抑制劑AL2846膠囊登記啟動一項Ⅲ期臨床,擬聯合PD-L1單抗TQB2450注射液,評估用于治療經免疫治療失敗的晚期非小細胞肺癌(NSCLC)患者的有效性和安全性。該項試驗的主要研究者為天津醫科大學腫瘤醫院主任醫師黃鼎智博士,及中國人民解放軍總醫院主任醫師胡毅博士。今年1月,TQB2450已在中國遞交一線治療NSCLC的上市申請并獲得受理。
4.愛科諾TYK2/JAK1抑制劑獲批I期臨床。愛科諾生物創新口服小分子TYK2/JAK1抑制劑AC-201獲澳大利亞人類臨床研究倫理委員會(HREC)批準開展I期臨床。AC-201可與TYK2/JAK1的偽激酶結構域(JH2)有效結合,穩定偽激酶結構域對激酶結構域的自抑制構象,高效抑制TYK2/JAK1激酶功能,對JAK2/JAK2通路無影響。在包括銀屑病的多款動物疾病模型中,AC-201顯示出積極療效。該新藥擬開發用于治療銀屑病和其他炎癥與自免疾病。
5.恒瑞源正TCR-T獲批實體瘤臨床。恒瑞源正1類生物制品HRYZ-T101注射液獲國家藥監局臨床試驗默示許可,擬開發用于治療人乳頭瘤病毒18亞型陽性(HPV18+)的實體瘤。HRYZ-T101是一款T細胞受體(TCR)基因修飾的T細胞療法,通過在T細胞中表達腫瘤特異性TCR鏈,增強T細胞對腫瘤細胞的識別和殺傷。此前,該公司開發的“多抗原自體免疫細胞注射液(MASCT-I)”已獲NMPA批準,正在開展注冊Ⅱ期臨床研究。
6.禮新GPRC5D靶向ADC授權阿斯利康。禮新醫藥宣布與阿斯利康就其臨床前期、靶向GPRC5D的潛在first in class抗體偶聯藥物(ADC)LM-305達成獨家許可協議,授予后者在全球研究、開發和商業化LM-305的獨家權益。根據協議,禮新醫藥將獲得包括首付款在內的5500萬美元近期付款、另加最高達5.45億美元的潛在開發和商業化里程碑付款,以及未來產品全球銷售的分成。GPRC5D是多發性骨髓瘤的新興免疫靶點。
國際藥訊
1.全球首款非激素更年期新藥獲批上市。FDA批準安斯泰來開發的神經激肽3(NK3)受體拮抗劑Veozah(fezolinetant)上市,成為首款非激素治療藥物,用于治療由更年期引起的中重度血管運動癥狀(即潮熱)。在Ⅲ期臨床(SKYLIGHT 1)中,Veozah(30mg、45mg)治療較安慰劑在第4周時顯著減少患者血管運動癥狀的頻率與嚴重程度,詳細數據已發布于今年4月《柳葉刀》期刊當中。
2.全球首款AAD激越藥物獲批上市。大塚制藥與靈北聯合開發的非典型抗精神病藥物Rexulti(brexpiprazole)獲FDA擴展適應癥,治療由阿爾茨海默病癡呆癥(AAD)所導致的激越癥狀。在Ⅲ期臨床中,與安慰劑組相比,brexpiprazole治療組12周后評估激越癥狀的CMAI評分和疾病嚴重程度CGI-S評分均具統計學顯著性的改善。2015年7月,FDA已批準該新藥上市,用于治療精神分裂癥和作為抗抑郁藥物的輔助療法治療重度抑郁癥(MDD)。
3.羅氏DMD基因療法獲FDA推薦批準。FDA咨詢委員會推薦羅氏與Sarepta公司開發的基因療法SRP-9001通過加速批準通道上市,治療杜氏肌營養不良(DMD)患者。SRP-9001旨在將編碼微營養不良蛋白的基因傳遞到肌肉組織,以產生目標蛋白——微營養不良蛋白,是一種針對全部DMD患者的潛在治愈性療法。在臨床試驗中,SRP-9001顯著提高患者肌肉中微抗肌萎縮蛋白的表達水平。
4.GSK五價腦膜炎疫苗Ⅲ期臨床積極。葛蘭素史克五價腦膜炎球菌候選疫苗MenABCWY用于10-25歲健康人群中間隔6個月接種兩劑的Ⅲ期試驗達到所有主要終點。與接種兩劑Bexsero(B型腦膜炎球菌疫苗)和一劑Menveo(A、C、W-135和Y型腦膜炎球菌結合疫苗)相比,MenABCWY在五種奈瑟菌屬腦膜炎球菌血清群(A,B,C,W和Y)的免疫反應均達到非劣效性標準;疫苗的耐受性良好,其安全性特征與Bexsero和Menveo一致。
5.CDK4/6抑制劑乳癌Ⅱ期臨床結果積極。G1 Therapeutics公司CDK4/6抑制劑曲拉西利(科賽拉)在ESMO2023年會上公布其聯合TROP2-ADC藥物拓達維(戈沙妥珠單抗)治療轉移性三陰性乳腺癌(TNBC)患者的Ⅱ期臨床開放標簽研究積極數據。初步數據中可觀察到顯著的骨髓保護獲益。曲拉西利聯合治療在總體人群中的中位PFS為4.1個月;其中 PD-L1陽性腫瘤患者客觀緩解率(ORR)為35.3%,高于總體人群的ORR(25.0%)。先聲藥業擁有該新藥在大中華地區所有適應癥的開發和商業化權益。
6.乙肝siRNA組合療法啟動Ⅱ期臨床。Vir Biotechnology公司評估siRNA療法VIR-2218聯合HBV中和抗體VIR-3434、聚乙二醇化干擾素α(PEG-IFNα)以及核苷酸逆轉錄酶抑制劑(NRTI)的組合治療方案用于乙型肝炎病毒(HBV)免疫活躍、未接受過治療成人的安全性和有效性的Ⅱ期臨床(STRIVE)完成首例患者給藥。STRIVE子方案試驗是Vir的HBV臨床項目中進行中的五個關鍵組合試驗之一,Vir公司已于2021年7月啟動該項目,旨在開發功能性治愈乙肝的療法。
醫藥熱點
1.我國注冊護士總量超520萬人。5月11日,國家衛健委宣布,截至2022年底,全國注冊護士總量超過520萬人,每千人口注冊護士約為3.7人,全國醫護比為1:1.8。近十年來,全國護士隊伍總量以平均8%的增幅逐年增加,每年約有30萬左右的新護士加入到護士隊伍中。下一步,國家衛健委將持續采取有力措施,進一步加強護士隊伍建設,推動實施《全國護理事業發展規劃(2021-2025年)》,到2025年,全國護士隊伍總量力爭達到550萬人,每千人口注冊護士數達到3.8人,基層護士數量達到120萬人。
2.我國7名護理工作者榮獲南丁格爾獎。5月12日,紅十字國際委員會公布第49屆南丁格爾獎獲獎者名單,共有來自22個國家的37名護理人員獲得南丁格爾獎。我國共有7名優秀護理工作者獲此殊榮,分別為:陳靜(女)海軍軍醫大學第二附屬醫院急診重癥醫學科兼血透室護士長;邢少云(女)海南省第五人民醫院麻風病區護士長;劉小娟(女)首都醫科大學附屬北京朝陽醫院內科原科護士長;甘秀妮(女)重慶醫科大學附屬第二醫院護理部主任;趙雪紅(女)浙江大學醫學院附屬第一醫院護理部副主任;蔣艷(女)四川大學華西醫院護理部主任;張穎惠(女)山西醫科大學第二醫院護理部副主任。
3.2023年醫藥領域整治項目啟動。5月10日,國家衛健委發布《關于印發2023年糾正醫藥購銷領域和醫療服務中不正之風工作要點的通知》,要求深入治理醫療領域亂象,治理利用緊缺醫療資源或檢查、手術等診療安排損公肥私牟取個人利益,以及強推基因檢測或院外購藥等第三方服務、接受網上開藥提成、違規直播帶貨獲利、利用執業開單提成、違規轉介患者等問題;聚焦醫療美容、口腔、輔助生殖等重點領域,依法依規嚴厲打擊虛假宣傳、無證行醫、非法生產經營使用相關藥品醫療器械行為。
評審動態
1. CDE新藥受理情況(05月14日)
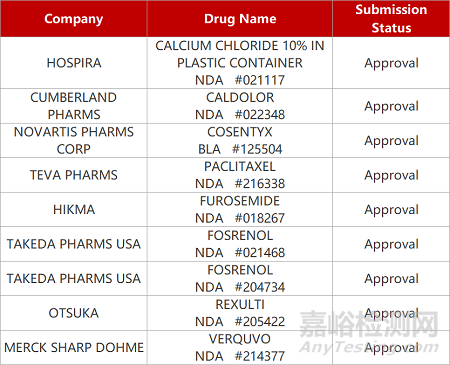
2. FDA新藥獲批情況(北美05月11日)