今日頭條
舒泰神TSLP靶向單抗報(bào)哮喘IND。舒泰神1類生物制品“STSA-1201皮下注射液”的臨床試驗(yàn)申請(qǐng)獲CDE受理。STSA-1201是一款靶向胸腺基質(zhì)淋巴細(xì)胞生成素(TSLP)的單抗藥物,旨在通過特異性結(jié)合并阻斷TSLP與其受體的結(jié)合,從而阻斷其生物學(xué)功能(如樹突細(xì)胞的激活、Th2細(xì)胞因子和趨化因子的釋放、嗜酸性粒細(xì)胞浸潤(rùn)和IgE的產(chǎn)生,以及氣道高反應(yīng)等)。該新藥擬開發(fā)用于哮喘的治療。
國(guó)內(nèi)藥訊
1.安進(jìn)鈣敏感受體激動(dòng)劑獲批中國(guó)上市。安進(jìn)鹽酸依特卡肽(Etelcalcetide,AMG 416)注射液獲國(guó)家藥監(jiān)局批準(zhǔn)上市,為國(guó)內(nèi)首個(gè)且唯一上市的靜脈注射型擬鈣劑。Etelcalcetide是一款鈣敏感受體(CaSR)激動(dòng)劑,已于2017年在美國(guó)獲批用于治療繼發(fā)性甲狀旁腺功能亢進(jìn)癥,針對(duì)那些接受血液透析治療的成人慢性腎臟疾病患者。復(fù)星醫(yī)藥擁有Etelcalcetide在中國(guó)境內(nèi)的商業(yè)化授權(quán)。
2.信達(dá)PD-1單抗第7項(xiàng)適應(yīng)癥獲批上市。信達(dá)生物PD-1抑制劑信迪利單抗注射液(商品名:達(dá)伯舒)獲國(guó)家藥監(jiān)局批準(zhǔn)第7項(xiàng)適應(yīng)癥,聯(lián)合達(dá)攸同(貝伐珠單抗生物類似藥)以及化療用于治療EGFR-TKI治療失敗的EGFR突變非鱗狀非小細(xì)胞肺癌(NSCLC)。信達(dá)最近已在《柳葉刀》子刊上發(fā)表關(guān)鍵III期ORIENT-31研究積極結(jié)果。此前,信迪利單抗已在中國(guó)獲批6項(xiàng)適應(yīng)癥均已被納入國(guó)家醫(yī)保目錄。
3.海思科引進(jìn)漸凍癥口溶膜報(bào)產(chǎn)。海思科從Aquestive Therapeutics引進(jìn)的利魯唑口溶膜(Exservan)的上市申請(qǐng)獲國(guó)家藥監(jiān)局受理,用于治療肌萎縮側(cè)索硬化癥(ALS,俗稱漸凍癥)。Exservan是利魯唑的一種口腔膜劑,利魯唑是FDA批準(zhǔn)的首款治療ALS的藥物,用于推遲ALS患者對(duì)呼吸機(jī)的依賴、延長(zhǎng)生命。該產(chǎn)品只需放在患者的舌頭上,無需液體或食物即可迅速溶解,為吞咽困難或者無法吞咽的患者提供新的治療選擇。
4.康寧杰瑞HER2雙抗獲批Ⅲ期臨床。康寧杰瑞與石藥集團(tuán)旗下津曼特生物聯(lián)合開發(fā)的重組人源化抗HER2雙特異性抗體注射液KN026獲國(guó)家藥監(jiān)局批準(zhǔn)開展一項(xiàng)Ⅲ期臨床,評(píng)估與注射用多西他賽(白蛋白結(jié)合型)聯(lián)用一線治療HER2陽性復(fù)發(fā)轉(zhuǎn)移性乳腺癌的有效性與安全性。在II期臨床中,KN026聯(lián)合多西他賽達(dá)到76.4%的客觀緩解率(ORR),中位緩解持續(xù)時(shí)間(mDoR)為24.0個(gè)月,疾病控制率(DCR)為100%。
5.華海雙通路融合蛋白獲批實(shí)體瘤臨床。華海藥業(yè)旗下華奧泰生物自主研發(fā)的融合蛋白HB0025注射液獲FDA批準(zhǔn)開展一項(xiàng)Ⅰb/Ⅱ期臨床,擬聯(lián)合TIGIT單抗HB0030用于治療晚期實(shí)體瘤患者。HB0025是全球首個(gè)獲批進(jìn)入臨床、能同時(shí)阻斷PD-1/PD-L1和VEGF/VEGFR這兩條信號(hào)通路的雙特異性融合蛋白,目前已分別在中國(guó)和美國(guó)獲批臨床。華海藥業(yè)計(jì)劃在中美兩國(guó)同步開發(fā)HB0025以及HB0025的組合療法用于治療實(shí)體瘤。
國(guó)際藥訊
1.Eyenoiva擴(kuò)瞳產(chǎn)品獲FDA批準(zhǔn)上市。Eyenovia公司開發(fā)的托吡卡胺和鹽酸苯腎上腺素眼用噴霧劑Mydcombi獲FDA批準(zhǔn)上市,用于在診斷過程和需要短期瞳孔擴(kuò)張的情況下誘導(dǎo)散瞳。該產(chǎn)品采用了基于Eyenovia專有的微矩陣藥膜(MAP)技術(shù)而開發(fā)的微量給藥系統(tǒng)Optejet,可以將兩種散瞳藥以微液滴形式給藥至眼表。極目生物擁有MydCombi在大中華區(qū)及韓國(guó)的開發(fā)和商業(yè)化權(quán)益。
2.臺(tái)新藥改良型眼科藥物在美報(bào)NDA。臺(tái)新藥股份有限公司開發(fā)的針對(duì)眼科術(shù)后抗炎鎮(zhèn)痛的改良型新藥激素納米混懸滴眼液(APP13007)已在美國(guó)遞交了新藥上市申請(qǐng)。GPN00833為一種強(qiáng)效皮質(zhì)類固醇丙酸氯倍他索(0.05%)的新型水性納米混懸滴眼液。遠(yuǎn)大醫(yī)藥擁有APP13007在中國(guó)大陸、香港和澳門地區(qū)的獨(dú)家開發(fā)和商業(yè)化授權(quán)。今年4月,該新藥已獲國(guó)家藥監(jiān)局批準(zhǔn)開展III期臨床研究。
3.楊森IL-23抑制劑UC Ⅲ期臨床積極。強(qiáng)生旗下楊森IL-23抑制劑Tremfya(guselkumab)治療中重度潰瘍性結(jié)腸炎(UC)的Ⅲ期臨床QUASAR達(dá)到主要研究終點(diǎn)。與安慰劑組相比,Tremfya治療組患者12周時(shí)達(dá)到臨床緩解的比例更高(22.6%vs7.9%,p<0.001);兩組臨床應(yīng)答、內(nèi)鏡改善和組織內(nèi)鏡粘膜改善的患者比例分別為61.5%vs27.9%(p<0.001)、26.8%比11.1%(p<0.001)和23.5%比7.5%(p<0.001)。藥物相關(guān)不良事件發(fā)生率與安慰劑相似。
4.禮來IL-23p19單抗UC Ⅲ期臨床積極。禮來IL-23p19單抗mirikizumab治療中重度活動(dòng)性潰瘍性結(jié)腸炎(UC)的兩項(xiàng)Ⅲ期試驗(yàn)(LUCENT-1和LUCENT-2)最新結(jié)果積極。在12周和52周時(shí),mirikizumab治療組患者由于急需排便的緩解導(dǎo)致炎癥性腸病問卷(IBDQ)總分分別提高44.8%和32.5%;其中分別有22.7%和39.1%的改善是由于直腸出血得到緩解,而32.5%和28.4%的改善則是源自排便頻率的緩解。另外,mirikizumab治療UC兒科患者的Ⅱ期臨床中期數(shù)據(jù)與LUCENT-1試驗(yàn)結(jié)果一致。
5.記憶樣通用NK細(xì)胞療法獲批實(shí)體瘤臨床。INmuneBio公司NK細(xì)胞免疫療法INKmune™獲FDA批準(zhǔn)開展I/II期臨床,評(píng)估用于腫瘤治療的安全性與有效性。INKmune™是一種無復(fù)制能力的人類腫瘤細(xì)胞系,它與靜息NK細(xì)胞結(jié)合并提供多種基本的啟動(dòng)信號(hào)。臨床前研究顯示,INKmune將患者的rNK細(xì)胞轉(zhuǎn)化為記憶樣NK細(xì)胞,該種細(xì)胞能夠克服免疫微環(huán)境的免疫抑制和缺氧難題,直接靶向?qū)嶓w瘤并發(fā)揮殺傷作用。
6.蘇庇醫(yī)藥約17億美元收購(gòu)CTI公司。蘇庇醫(yī)藥(Swedish Orphan Biovitrum)宣布將以約17億美元收購(gòu)CTI BioPharma,并獲其主導(dǎo)產(chǎn)品骨髓纖維化新藥Vonjo(pacritinib)。pacritinib是一款能特異性抑制JAK2、IRAK1和CSF1R的口服激酶抑制劑,已于去年3月獲FDA加速批準(zhǔn)上市,用于治療伴有嚴(yán)重血小板減少癥的骨髓纖維化患者。交易完成后,CTI BioPharma將成為蘇庇醫(yī)藥的全資子公司,并共同推進(jìn)pacritinib在治療骨髓增生性疾病方面的潛力。
醫(yī)藥熱點(diǎn)
1.上海市胸科醫(yī)院心胸疾病臨床醫(yī)學(xué)中心項(xiàng)目獲批。據(jù)上海市發(fā)展改革委消息,上海市胸科醫(yī)院心胸疾病臨床醫(yī)學(xué)中心項(xiàng)目已獲得可行性研究批復(fù),選址位于浦東新區(qū)唐鎮(zhèn),建設(shè)用地25523平方米,新建總建筑面積119953平方米,其中:地上80794平方米、地下39159平方米。項(xiàng)目總投資金額142523萬元。該項(xiàng)目聚焦胸部腫瘤學(xué)和心血管病學(xué),將打造集臨床診療、臨床研究、轉(zhuǎn)化醫(yī)學(xué)、基礎(chǔ)研究為一體的產(chǎn)學(xué)研醫(yī)發(fā)展中心和人才培養(yǎng)高地。
2.胡華忠任復(fù)旦上醫(yī)黨委副書記、紀(jì)委書記。5月8日上午,復(fù)旦大學(xué)上海醫(yī)學(xué)院領(lǐng)導(dǎo)班子調(diào)整宣布會(huì)議舉行。會(huì)議宣布了中共上海市委決定,胡華忠同志任復(fù)旦大學(xué)上海醫(yī)學(xué)院黨委副書記、紀(jì)委書記,免去復(fù)旦大學(xué)上海醫(yī)學(xué)院黨委副書記、紀(jì)委書記楊偉國(guó)同志的紀(jì)委書記職務(wù)。
3.鄭州市階段性降低職工醫(yī)保繳費(fèi)費(fèi)率。為進(jìn)一步減輕參保單位和靈活就業(yè)人員負(fù)擔(dān),鄭州市本月起,在不降低參保人員醫(yī)保待遇水平的前提下,將階段性降低職工基本醫(yī)療保險(xiǎn)繳費(fèi)費(fèi)率。新政規(guī)定,執(zhí)行期限內(nèi), 鄭州市職工基本醫(yī)療保險(xiǎn)費(fèi)率階段性降低1個(gè)百分點(diǎn),其中,職工醫(yī)保繳費(fèi)費(fèi)率由原來的10%調(diào)整為9%,不含生育保險(xiǎn)。具體來說,就是原來單位職工醫(yī)保繳費(fèi)費(fèi)率率為8%、個(gè)人為2%,調(diào)整后,單位繳費(fèi)率下調(diào)為7%、個(gè)人繳費(fèi)率仍為2%。在此期間,鄭州市靈活就業(yè)人員基本醫(yī)療保險(xiǎn)費(fèi)率階段性也降低1個(gè)百分點(diǎn),由原來的10%調(diào)整為9%。
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(05月10日)
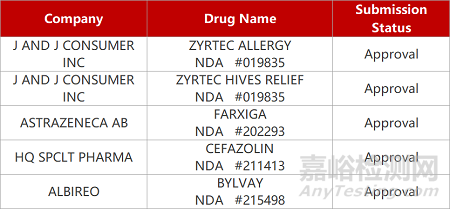
2. FDA新藥獲批情況(北美05月08日)