制藥工業向連續制造的范式轉變,最近已從概念論證發展到試生產,促進了過程系統工程( PSE) 工具的開發和應用,以實現高效和穩健的控制策略。本研究提出了一個藥品連續固體制劑生產過程控制設計與風險分析的系統框架,包括系統辨識與狀態空間模型; 控制設計和分析指標; 3 層遞階控制結構; 風險地圖、評估和規劃( 風險地圖) 戰略; 控制性能指標。該框架應用于進料混合系統,其中產品質量的主要差異源出現。可以證明,通過提出的控制設計和風險分析系統框架,可以緩解和管理進料配料系統中的差異。為了在先進的層次上實現有效的控制設計,用于原料藥質量分數測量的過程分析技術( PAT) 工具及其相對標準差( RSD) 是必不可少的。具體而言,通過實施先進的基于模型的控制策略,控制性能的改善受到模型對象失配和 PAT 工具采樣時間的限制。
在過去的 10 年中,通過廣泛的研究,連續 2 次制造工藝在制藥工業中的優勢已經得到了體現,但主要是在概念或理論層面[1]。為了從概念性的連續設計轉變為實際運行的試驗工廠或制造過程,如輝瑞公司開發的便攜式、連續式、微型和模塊化技術( PCMM) ,鑒于監管機構、學術界和工業界的努力現集中在設計和實施問題上,具體介紹了實時釋放控制結構的設計及其在連續固體制劑制造中的實現[2]。因此,本研究提出了一個系統化的控制設計與風險分析架構,以期達到有效且強健的主動過程控制。該框架由以下幾個部分組成: 狀態空間模型的系統辨識; 控制設計和分析指標; 3 層遞階控制結構; 風險地圖、評估和規劃( 風險地圖) 戰略; 控制性能指標。具體來說,遞階控制結構更側重于實現,根據控制目標的規模、所需的過程理解以及處理過程干擾和風險的潛在能力對各層進行分類[3]。此外,不依賴于傳遞函數或卷積模型,提倡狀態空間模型。
狀態空間模型由于其固有的靈活性,在表示多元非線性過程和建模不可測量的干擾和過程時滯方面具有優勢。除了常用的時間絕對誤差積分( ITAE) 進行控制整定或性能評價外,還提出了 3 個新的性能指標,將控制性能與一致的產品質量直接聯系起來[4-5]。
1、過程控制設計和風險分析的系統框架
通過廣泛的最終產品測試進行質量控制( 目前在傳統的藥品批量生產中實施) 與此相反,在連續的生產過程中,應在其指定的設定點實時監測和控制產品和通向產品的中間流的質量[6]。控制結構應能很好地響應由于過程變量、設備條件、進料原材料或環境因素的干擾和風險引起的潛在變化,以確保在產品退出過程序列時滿足產品質量規范,這就是實時發布的含義。由各種過程系統工程工具組成的系統框架,用于開發和評估可行的控制策略,具體如圖 1 所示。
擬議的控制框架還必須與其他輔助知識和工具相結合,以促進控制戰略實施的軟硬件一體化。例如,在基于從材料庫( D1) 中獲得的知識進行適當的產品設計( D2) 之后,將生成固體劑量的適當配方,需要特定的連續制造技術,即在工藝設計( D3) 中直接壓實、干造粒或濕造粒。然后,將使用制藥設備供應商提供的模塊化單元操作( 進料、混合、壓片等)配置試驗工廠或制造工藝( P2) ,并在 P1 開發步驟中集成控制平臺和 PAT 傳感器。由模型庫( S1) 和流程圖模擬( S2) 軟件組成的過程建模工具,通過加速工藝設計優化和實現期望的控制目標,在有效的全廠控制策略開發中發揮重要作用。例如,基于流程圖模擬( S2) 的全局敏感性分析和系統識別( C1)可通過基本原理控制設計指標( 如相對增益陣列( RGA) ) 幫助識別和解決過程控制設計中的潛在挑戰或風險,即分散、配對、穩定性、恢復力等,在控制設計與分析( C2) 中。一個分層的 3 層過程控制設計( C3) 和風險分析( C4) 將遵循嚴格的性能評估( C5) 。步驟 C3 到 C5 之間的迭代將繼續進行,直到實現滿足實時發布要求并遵守監管指南的控制器設計。所得到的控制設計將在制造過程( P2) 上實施,并在步驟 P3 中進行實驗驗證。制造工藝( P2) 的持續改進將通過提高模型預測精度或加強產品和工藝設計( D1 和 D2) 來實現。
2、控制性能指標
除了常用的性能指標,如用于控制整定和評估的時間絕對誤差積分( ITAE) ,圖 1 中建立了 C5 性能評估的 3 個附加性能指標,以明確地將控制性能與規范產品的一致性生產聯系起來。如圖 2 所示,第 1 個是時間到產品( T2P) ,T2P 描述干擾從其源傳播到產品所需的時間量,并且它在一個或多個CQA 中被檢測為偏差。在連續生產線中,如果在CPP 上游檢測到不可接受的干擾,則 T2P 對于確定何時開始/準備轉移不合格產品具有實際重要性。

第 2 個指標,拒絕持續時間( D2R) ,是有或沒有控制系統的過程消除過程干擾或達到 CQA 新設定點所需的時間長度。較小的 D2R 是理想的,這樣當系統中發生過程干擾時,將產生較少數量的不合格產品。
第 3 個指標,量積比( M2P) ,描述了在操作過程時CQAs 與目標設定點的最大偏差。重要的是要限制控制動作,以避免大的 M2P,從而使 CQA 保持在設計空間內。圖 2 顯示了這些性能指標的定義,以及實施主動過程控制的潛在優勢,與開環操作( 即手動或無需調整以維持 CQAs) 相比,這些標準定義了更好的性能。
對于如圖 1 所示的制造過程( P2) 中的控制設計( C2) 的性能驗證( P3) ,對于穩定的過程,應達到與 CQAs 的既定驗收標準有關的統計控制狀態,由于共同原因而產生的內在變異性可以用過程能力( Cp 和 Cpk) 指數來衡量。過程能力指數是一種廣泛使用的統計方法,用于衡量一個過程在規范極限內產生產出的能力,表明一個過程相對于其規范極限所經歷的自然變化有多大。它可以用來作為一個指標,以及如何控制過程。此外,還可以使用統計數據分析工具確定因果關系,從工藝操作條件和原材料質量中找出內在可變性的根本原因,以不斷改進和優化當前工藝。
3、連續固體制劑生產中的加料配料系統
連續混合是固體制劑連續生產的第一步,原料藥與輔料連續混合,以滿足所需的粉末混合成分。由于通常沒有進一步的下游步驟可以糾正混合成分,原料藥含量及其在粉末中的均勻性是這一子系統中必須嚴格控制的 2 個重要 CQA。另一個需要嚴格控制的重要工藝參數是混合機出口粉末的總流量。這一重要的 CPP 影響固體加工線的生產率,當考慮到下游設備的有限滯留量時,這一點極為重要[7-8]。目前國內外對配料系統的系統控制系統設計和分析的研究較少; 下面將簡要闡述該中試設備的進料混合系統,系統結構如圖 3 所示。

連續制造過程的輸入包括 2 個 Schenck Accu-Rate PureFeed AP - 300 失重給料機,它們能夠通過測量和使用組合料斗和給料機裝置中剩余粉末質量的變化來達到和保持規定的進料速率。這是通過嵌入 0 層控制系統實現的。喂料器將原料藥對乙酰氨基酚 ( APAP ) 和賦形劑 Avicel 微晶纖維素PH - 200( MCC 200) 連續喂料到 Gericke GCM - 500連續混 合 器 中,其 中 2 種組分混合。操作條件( NOC) 包括 API 流量為 1.0 kg /h,賦形劑流量為9.0 kg /h,攪拌機轉速為 200 r/min。使用近紅外光譜儀( Control Development,Inc. ) 在攪拌機出口處原位測量 API 質量分數。使用 API 質量分數測量值在一個時間窗口內的平均值和方差,以相對標準偏差( RSD) 的形式對含量均勻性進行統計估計。使用基于 X 射線的質量流量計( SETXvue XP - 300,Enurga公司) 。這些設備使用 Delta V 進行集成,這些單元操作的過程變量被傳輸到再現 Delta V 系統,NIR 的信號處理延遲為 2 s,X 射線的信號處理延遲為 1 s。通過 LinkMaster 和 KepServer 軟件包建立了 OPC DA協議,將實時過程數據從 Emerson DeltaV OPC 服務器傳輸到 MATLAB。
4、分層 3 層控制設計
圖4 說明了建議的3 層結構在典型的連續直接壓實過程中的應用,作為本工作的一個例子。一般來說,控制方法根據實現方法、復雜性和處理過程干擾和風險的潛在能力分為3 個層次。0 層控制技術包括單/多回路 SISO 控制,通常通過設備本身的可編程邏輯控制( PLC) 面板實現。簡單反饋比例、積分和微分( PID) 控制、前饋比率控制或先進的專有 MPC 控制算法( 在高度非線性過程動力學情況下) 可在設備的 PLC 上實現。該控制層通常由設備供應商設計和提供,以控制單個/多個關鍵工藝參數,從而保持該設備的標稱運行條件。
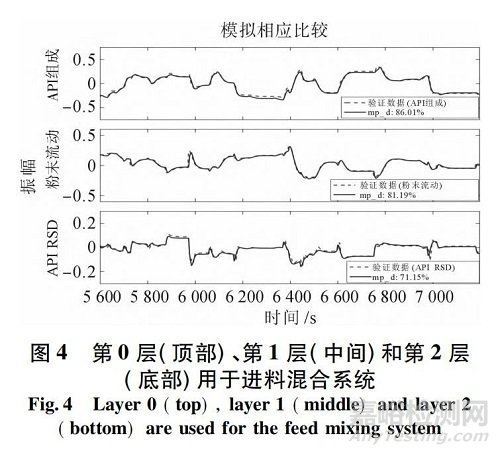
例如,失重給料機通常配備有內置控制回路,通過調整螺桿轉速,將原料藥、賦形劑或潤滑劑等成分的流速保持在所需的設定值。在大多數情況下,1 層控制技術還涉及單回路或多回路 SISO 控制器; 然而,這些回路依賴于 PAT工具的使用來測量和直接控制 CQA,并且可能涉及多個單元操作。這些控制回路通常通過監控和數據采集( SCADA) 設備執行,例如 DCS 系統的商業 OPC服務器。OPC 服務器從現場所有單元操作設備檢索數據或向其發送命令。例如,它可以在第 0 層PLC 控制面板上調整 CPP 變量的設定點。因此,第1 層控制通常使用級聯回路來監督第 0 層控制,目的是實現關鍵質量屬性( CQA) 的所需設置點,這些屬性由 PAT 傳感器現場測量。例如,在進料混合系統的情況下,粉末配方中的原料藥成分是關鍵 CQA之一,可以通過在第 0 層控制器上操縱這些 CPP 的一個設定點來直接控制,例如原料藥進料流量、賦形劑進料流量或攪拌機轉速。CQA 可與對其具有最大影響的另一 CPP 上游配對; 因此,第 1 層控制通常跨越單元操作,并使用有效的反饋/前饋控制算法設計,以減少干擾的影響,否則可能會傳播到下游。
5、結語
提出了一個基于風險的連續制造過程控制系統設計的系統框架,以評價控制系統開發的每一步。采用 SIMULINK 動態過程模型,將所提出的遞階3 層控制設計方法應用于配料系統。在風險圖設計的基礎上,在評價 3 層控制設計時還考慮了控制性能可能惡化的潛在風險。這些案例研究證明了在連續生產過程中,系統控制評價系統對于保證產品質量的重要性,并強調了基于 PAT 的反饋過程控制技術在藥品連續生產中的應用。
這項工作的擴展將考慮 PAT 工具與現場 0 層控制的向下集成,以確保在每個單元操作中保持一致的質量屬性,從而要求從上游單元到下游單元的最小程度的控制干預。這樣的設計也將減少第 1 層和第 2 層全廠控制設計的負荷,并有助于單元操作的模塊化。例如,如果 NIR 傳感器與攪拌機集成,則可以通過調整轉速將原料藥含量均勻性控制下載到 L0 控制面板。研究還表明,解耦 PID 控制回路可以有效地控制原料藥的混合均勻性。在我們正在進行的研究中,將建議的框架應用到完整的壓片線。
參考文獻
[1] SU Q L,MORENO M,GAMESH S,et al. Resilience and risk analysis of fault-tolerant process control design in continuous pharmaceutical manufacturing[J]. Journal of Loss Prevention in the Process Industries,2018,55: 411-422.
[2] SU Q,BOMMIREDDY Y,GONZALEZ M,et al. Variation and risk analysis in tablet press control for continuous manufacturing of solid dosage via direct compaction[J].Computer Aided Chemical Engineering,2018,44: 679-684.
[3] SU Q L,GANESH S,MORENO M,et al. A perspective on Quality-by-Control (QbC) in pharmaceutical continuous manufacturing[J]. Computers & Chemical Engineering:
An International Journal of Computer Applications in Chemical Engineering,2019,125: 216-231.
[4] GANESH S,SU Q,PEPKA N,et al. Design of conditionbased maintenance framework for process operations management in pharmaceutical continuous manufacturing[J].International Journal of Pharmaceutics,2020,587:119621.
[5] SU Q,REKLAITIS G V,NAGY Z K. Continuous feedingblending in pharmaceutical continuous manufacturing
[M]/ /Continuous Pharmaceutical Processing. Cham:Springer,2020.
[6] SU Q L,BOMMIREDDY Y,SHAH Y,et al. Data reconciliation in the Quality-by-Design( QbD) implementation of pharmaceutical continuous tablet manufacturing[J]. International Journal of Pharmaceutics,2019,563: 259-272.
[7] TIAN G,KOOLIVAND A,GU Z,et al. Development of an RTD-Based Flowsheet Modeling Framework for the Assessment of In-Process Control Strategies [J]. AAPSPharm Sci Tech,2021,22( 1) : 1-10.
[8] BHASKAR A,SINGH R. Residence time distribution
( RTD) -based control system for continuous pharmaceutical manufacturing process[J]. Journal of Pharmaceutical Innovation,2019,14( 4) : 316-331.
[9] SU Q L,NAGY Z K,RIELLY C D. Pharmaceutical crystallisation processes from batch to continuous operation using MSMPR stages: Modelling,design,and control[J].Chemical Engineering and Processing,2015,89: 41-53.
[10] ENGISCH W,MUZZIO F. Using residence time distributions( RTDs) to address the traceability of raw materials in continuous pharmaceutical manufacturing[J]. Journal of Pharmaceutical Innovation,2016,11( 1) : 64-81.








