今日頭條
君實PARP抑制劑婦科癌癥III期臨床積極。君實生物與英派藥業合作開發的聚腺苷二磷酸核糖聚合酶(PARP)抑制劑senaparib用于維持治療晚期上皮性卵巢癌、輸卵管癌或原發性腹膜癌患者的III期臨床(FLAMES)達到主要終點。期中分析顯示,senaparib可顯著延長患者的無進展生存期(PFS),無論患者BRCA突變狀態如何,均可獲益。兩家公司預計近期遞交該新藥的上市申請。
國內藥訊
1.禮來N3pG淀粉蛋白擬納入突破性治療品種。禮來新一代N3pG淀粉樣蛋白抗體remternetug注射液(包括靜脈注射)獲國家藥監局擬納入突破性治療品種,針對的適應癥為早期阿爾茨海默病。今年3月,remternetug在中國登記啟動一項國際III期研究(CTR20230785),擬評估用于靜脈輸注治療具有腦淀粉樣蛋白和tau蛋白病理的早期癥狀性阿爾茨海默病(AD)受試者中的安全性和有效性。
2.華輝安健乙肝中和抗體擬納入突破性品種。華輝安健乙肝病毒中和抗體新藥HH-003注射液獲國家藥監局擬納入突破性治療品種,用于治療慢性丁型肝炎病毒感染。HH-003擁有雙重作用機制,能夠阻斷病毒入侵肝細胞,打破病毒在肝臟中持續存在的感染和再感染循環;它還潛在具備Fc介導的免疫效應功能,能夠清除游離病毒/已感染的肝細胞。該新藥目前處于Ⅱ期臨床階段。
3.藝妙神州CAR-T療法報實體瘤IND。北京藝妙神州1類生物制品IM83嵌合抗原受體T細胞注射液(IM83 CAR-T細胞注射液)的臨床試驗申請獲CDE受理,擬開發用于實體腫瘤的治療。IM83采用新一代CAR分子設計,提高了CAR-T細胞在體內抑瘤的持續性。在研究者發起的臨床研究中,該產品展現出積極的療效和良好的安全性,被證實能夠有效殺傷靶點陽性的肝癌細胞。
4.信達BCMA-CAR-T療法報IND。信達生物旗下子公司信達細胞制藥申報1類生物制品IBI346的臨床試驗申請獲CDE受理。IBI346是信達生物利用羅氏的細胞技術平臺開發的新一代CAR-T細胞治療藥物,由P329G BCMA抗體和P329G CAR-T細胞兩個部分組成。此前,信達與羅氏基于通用模塊化CAR-T平臺開發的首款產品Claudin18.2 CAR-T療法IBI345已于去年2月完成首例患者給藥。
5.正大天晴康方PD-1單抗海外授權。康方生物與中國生物制藥旗下正大天晴共同合資的正大天晴康方與Specialised公司簽署一項合作與許可協議,授予Specialised公司在澳大利亞、新西蘭、巴布亞新幾內亞,以及新加坡、馬來西亞等東南亞11個國家獨家商業化PD-1單抗安尼可(派安普利單抗注射液)的權益。正大天晴康方仍保留安尼可在全球范圍內的開發權益。該合作總對價約7300萬美元,同時正大天晴康方將獲得安尼可于授權地區銷售凈額15%的提成。
6.傳奇生物任命Mythili Koneru為CMO。傳奇生物宣布任命Mythili Koneru博士為首席醫學官,負責監督公司臨床開發和醫學事務項目。加入傳奇之前,Koneru曾擔任Marker Therapeutics首席醫學官,領導其免疫腫瘤產品組合中細胞療法和肽疫苗的開發。此前,Koneru還曾擔任禮來公司腫瘤免疫學副總裁,主要負責公司早期腫瘤學組合中免疫腫瘤產品的臨床開發工作。
國際藥訊
1.FDA將審查衛材Aβ抗體上市批準。FDA即將在6月9日召開外周和中樞神經系統藥物咨詢委員會會議,討論關于衛材與渤健開發的阿爾茨海默病(AD)藥物lecanemab(商品名:Leqembi)上市申請完全批準的決議。Lecanemab是一款Aβ抗體,能與可溶性Aβ聚合體結合以促進它們的清除。今年4月,一項AD患者長期療效數據顯示,與標準護理相比,lecanemab治療能夠延緩(大約延緩兩到三年)患者進展到更嚴重的疾病階段。
2.默克BTK抑制劑RMS臨床被暫停。FDA暫停默克BTK抑制劑evobrutinib治療復發性多發性硬化癥 (RMS) 的部分III期臨床試驗。臨床暫停是因為有2例患者在III期研究中被確定了因藥物引起的肝損傷。在美國正在進行的evobrutinib治療RMS的III期EVOLUTION研究因受試者均已給藥超過70天,將按計劃繼續進行,試驗結果也將于2023年第四季度公布。
3.莫德納mRNA流感疫苗Ⅲ期臨床失敗。Moderna公司季節性流感疫苗mRNA-1010在北半球開展的III期研究(P302)未達到療效終點。獨立DSMB評估的第一個療效中期分析顯示,mRNA-1010沒有達到統計學閾值;臨床中未發現新的安全問題。目前,Moderna已開發mRNA-1010的升級版,預計對乙型流感病毒株的免疫原性會有所改善,并計劃本月啟動一項驗證性III期試驗。
4.渤健引進可入腦Aβ靶向藥物。渤健行使選擇權,獲得Denali公司抗體運輸載體(ATV)平臺開發的淀粉樣β蛋白(Aβ)靶向藥物ATV:Aβ的研發和商業化獨家授權。ATV:Aβ可穿越血腦屏障,旨在增加靶向Aβ的抗體療法在大腦中的暴露和靶向作用,從而可能實現改善斑塊清除和/或減少淀粉樣相關影像異常(ARIA)。Denali將獲得一次性選擇權行使付款,以及潛在的研發和商業里程碑付款。
5.諾和諾德引進糖尿病生物打印組織療法。諾和諾德與加拿大生物技術公司Aspect Biosystems將利用后者專有的生物打印技術平臺,開發多達4種生物打印組織候選療法,以替代、修復或補充體內的生物功能,用于糖尿病和肥胖癥的治療。根據協議,Aspect將獲得7500萬美元的首期付款,每款產品最多6.5億美元的開發、監管、商業和銷售里程碑后期付款,以及產品的銷售分成,交易總價值高達26億美元。
6.基因治療藥物公司Function完成A輪融資。Function Oncology公司宣布完成2800萬美元的A輪融資。Function Oncology的功能基因組學平臺能夠利用CRISPR技術直接對患者的臨床樣本進行基因調控,對患者的腫瘤進行個體化、全面的分析,揭示無法通過傳統基因組分析完全確定的藥物靶點依賴性。此輪融資將進一步推動該公司針對已知或新型癌癥驅動因子的新藥研發。
7.生技公司VintaBio獲6500萬美元融資。生物技術公司VintaBio宣布完成6400 萬美元融資并聘請David Radspinner擔任首席執行官一職。VintaBio是一家位于費城的 CDMO,服務于細胞和基因治療市場, 由Junwei Sun博士和Shangzhen Zhou博士創立。Radspinner曾在賽默飛世爾和通用電氣醫療集團(GE Healthcare)擔任多個領導職位,還曾擔任生命科學產品和服務提供商Cytiva的美洲副總裁。David在獲得亞利桑那大學分析化學博士學位后,曾在禮來和賽諾菲工作。
醫藥熱點
1.預防新冠公眾佩戴口罩指引發布。4月12日,國務院聯防聯控機制疫情防控組發布《預防新型冠狀病毒感染公眾佩戴口罩指引》,明確了應佩戴口罩、建議佩戴口罩、可不佩戴口罩的常見情形或場景。《指引》指出,露天廣場、公園等室外場所,以及人員相對固定的室內工作場所和會議室等7種情形或場景可不佩戴口罩。
2.上海市產科臨床質量控制中心成立。4月12日,上海市產科臨床質量控制中心正式掛靠上海市第一婦嬰保健院,上海市第一婦嬰保健院副院長應豪任上海市產科臨床質量控制中心主任。未來,上海市產科臨床質控中心將圍繞母胎一體質控模式,加強“產科—助產—圍產麻醉—新生兒”核心科室、支撐學科群和輔助科室聯動的質控體系,同時建立危重孕產婦多學科團隊搶救機制。
3.“泛血管介入復雜系統”基礎科學中心啟動。4月12日,由葛均波院士領銜的國家自然科學基金委員會“泛血管介入復雜系統”基礎科學中心啟動會在復旦大學附屬中山醫院舉行。這是我國交叉科學領域的首個醫學類基礎科學中心,該中心的成立對突破我國當前泛血管介入器械進口依賴度高、原創能力不足、臨床轉化效率較低等關鍵問題具有重要意義。
評審動態
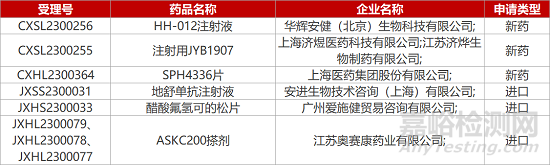
1. CDE新藥受理情況(04月13日)
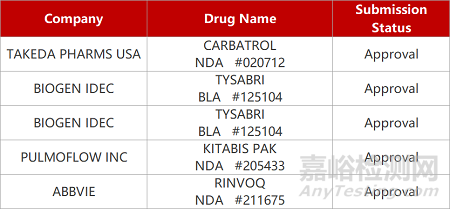
2. FDA新藥獲批情況(北美04月11日)