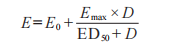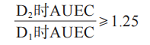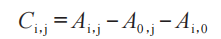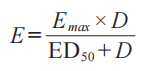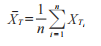美國食品藥品監督管理局(FDA)于2022年10月發布了“皮膚局部用皮質類固醇:體內生物等效性的供企業用的指導原則草案”[1]�,介紹 1種證明局部用皮質類固醇生物等效性的體內藥效學方法����。已知局部皮質類固醇可導致皮膚血管收縮����,從而產生皮膚變白的藥效學效應。變白的程度取決于皮質類固醇的作用強度,并且適當控制研究參數時��,其作用增強與滲透到皮膚中的皮質類固醇的量相關����。因此,藥效學血管收縮反應可以作為局部皮質類固醇在皮膚作用部位可獲得的速率和程度的替代測量,從而用于證明試驗的局部用皮質類固醇與其參比標準品(RS)[通常為參比制劑(RLD)]之間的生物等效性。該指導原則對用于證明局部用皮質類固醇生物等效性研究的研究設計��、方法鑒定�、數據分析和數據報告提出了詳細而具體的建議。該指導原則還討論了評估關鍵性研究參數的考慮因素和方法�。
我國目前還沒有專門針對皮膚局部用皮質類固醇的體內生物等效性指導原則����。本文詳細介紹FDA該指導原則��,期待對中國皮膚局部用皮質類固醇體內藥效學生物等效性研究和監管有幫助。
一�、該指導原則的前言
該指導原則由美國食品藥品管理局藥品評價和研究中心仿制藥辦公室與臨床藥理學辦公室協商編制�。該指導原則旨在幫助申請人提交所有作用強度(potency)組的皮膚局部用皮質類固醇產品的簡化新藥申請(ANDA)�,以下簡稱局部用皮質類固醇。局部用皮質類固醇的作用強度是產生期望的治療效果所需的藥物量�����。血管收縮試驗可用于測定作用強度��。該指導原則介紹��,證明局部用皮質類固醇生物等效性體內研究的建議。
定稿后��,該指導原則將取代 1995 年 6 月發布的“皮膚局部用皮質類固醇:體內生物等效性”供企業用的指導原則[2]���。修訂該指導原則將為潛在的ANDA申請人��,提供有關適當的試驗性和關鍵性研究(pilot and pivotal studies)���,以及評估皮膚局部用皮質類固醇生物等效性的藥效學方法的其他建議的明確信息����。自1995年發布最初指導原則以來����,這些建議不斷演變。
該指導原則對用于證明局部用皮質類固醇生物等效性的試驗性給藥-持續時間血管收縮反應研究和關鍵性血管收縮生物等效性研究的研究設計�����、方法鑒定���、數據分析和數據報告提出了建議���。該指導原則還討論了評估關鍵性研究參數的考慮因素和方法[例如�����,與血管收縮反應相關的半數有效劑量(ED50)以及關鍵性血管收縮生物等效性研究的樣本量]。
一般來說,FDA的指導原則文件沒有規定法律上強制執行的責任��。相反��,指導原則描述了FDA當前對某一主題的看法��,除非引用了具體的規章或法定要求,否則僅應視為建議。在FDA指導原則中使用“should”一詞意味著建議或推薦����,而不是必需的�����。
二�、該指導原則出臺的背景
“聯邦食品�����、藥品和化妝品法案”(FD&C Act))通常要求 ANDA 除其他外����,包含表明擬用仿制藥品(試驗產品)與其參比制劑具有生物等效性的信息����。“生物等效性”是指當在適當設計的研究中以相同摩爾劑量在類似條件下給藥時���,藥物等效物或藥物替代品中的活性成分或活性部分���,在藥物作用部位可獲得的速率和程度沒有顯著差異�。”
該指導原則描述了1種證明局部用皮質類固醇生物等效性的體內藥效學方法。已知局部皮質類固醇可導致皮膚血管收縮���,從而產生皮膚變白的藥效學效應。變白的程度(皮膚顏色的變化)取決于皮質類固醇的作用強度,并且適當控制研究參數時�����,其作用增強與滲透到皮膚中的皮質類固醇的量相關�。因此,藥效學血管收縮反應可以作為局部皮質類固醇在皮膚作用部位可獲得的速率和程度的替代測量。
常規進行的確定關鍵性血管收縮研究的適當參數的血管收縮試驗性研究�,用于證明試驗的局部用皮質類固醇與其參比標準品(通常為 RLD)之間的生物等效性����。因此�����,該指導原則建議����,擬使用體內藥效學方法證明����,試驗的局部皮質類固醇與其參比標準品之間的生物等效性的ANDA申請人,進行兩項體內血管收縮研究:(1)使用參比標準品進行試驗性給藥-持續時間血管收縮反應研究����;(2)比較試驗的局部皮質類固醇和參比標準品的關鍵性的血管收縮生物等效性研究。該指導原則后續章節將更詳細地討論所提出的方法���,包括試驗性給藥-持續時間血管收縮反應研究的研究設計、模型選擇和模型優化�,以及關鍵性血管收縮生物等效性研究的統計方法���。
試驗性給藥持續時間血管收縮反應研究(或試驗性血管收縮研究或試驗性研究)的目的是確定關鍵性血管收縮生物等效性研究中�,被研究的局部用皮質類固醇的給藥持續時間-反應關系���。試驗性血管收縮研究結果可提供�,確定在預期申請人的關鍵性血管收縮生物等效性研究中,使用的參數 ED50��、D1和 D2所需的給藥持續時間-反應信息���。ED50為半數最大血管收縮反應���;D1為給藥持續時間約等于該人群 ED50的 0.5 倍�����;D2為給藥持續時間約等于所使用的簡單 Emax模型的該人群 ED50的 2倍����。開發和驗證給藥持續時間-反應標準曲線的適當敏感和識別區域,對于估計血管收縮反應的 ED50����、D1和 D2至關重要�。該方法類似于使用標準曲線��,表征生物流體中藥物的生物分析方法的線性�、范圍和定量限�。對于研究的每種局部皮質類固醇的關鍵性研究,應在與試驗性研究相同的條件下進行��。
關鍵性血管收縮研究的目的是����,使用體內的方法證明試驗產品與RLD的生物等效性��?;蛘?�,當擬定的仿制配方在非活性成分或配方的其他方面與RLD無差異(這些差異可能顯著影響活性成分的局部或全身可利用性)時���,可以采用基于體外特征的方法���,確定局部用皮質類固醇產品的生物等效性���。如果合適���,鼓勵潛在申請人提交受控信函����,或請求召開 ANDA 中可能提交的相關復雜產品的產品開發會議�,以討論具體的科學問題(例如,在進行關鍵性血管收縮研究之前����,擬定的研究設計或與方法鑒定��、給藥持續時間-反應或試驗性給藥持續時間-反應研究的其他方面相關的問題),或討論替代的生物等效性方法(例如基于特征的方法)[3-5]��。申請人必須與ANDA一起提交�,ANDA依賴其批準的生物等效性研究的完整研究報告。
三�、藥效學血管收縮研究
3.1 血管收縮方法檢定
分光光度計是最常用于測量局部用皮質類固醇涂抹后引起的藥效學皮膚變白反應的儀器���。在為血管收縮研究收集數據之前,應校準分光光度計并應對其預期用途進行鑒定。此外��,不同操作人員進行的分光光度計測量的重復性和耐用性也應合格���。這些合格確認應在研究開始前完成�。如果研究有多個組,至少應在第一組開始日期之前進行方法確認。重復性表示在短時間間隔內����,相同操作條件下的精度��。耐用性是指該方法在各種正常但可變的試驗條件下的再現性。可變條件可能包括不同的機器、操作人員和試劑批次�。耐用性提供對實驗再現性的估計��,然而具有不可避免的誤差。
3.1.1 分光光度計檢定
使用校準的分光光度計進行分光光度計檢定,以支持證明多個分光光度計單元的分光光度計測量的耐用性����。在試驗性給藥-持續時間血管收縮反應研究和關鍵性血管收縮生物等效性研究中�����,可以設置多個分光光度計單元,測量血管收縮反應。這些試驗性和關鍵性血管收縮研究中,使用的所有分光光度計都應報告其特定的識別號碼���,并經過確認,以確保研究數據收集的一致性。應使用1名操作人員�����、1例受試者和每個規定皮膚部位的至少 4 個讀數,對計劃用于試驗性和關鍵性血管收縮研究的所有分光光度計進行檢定。分光光度計內變異性計算�����,為通過 1 名操作人員使用 1臺分光光度計計算 1個皮膚部位的多個讀數內的變異性���。不同分光光度計之間的變異性計算�����,為不同分光光度計讀數的變異性,即1名操作人員在1個皮膚部位從每臺分光光度計獲得多個讀數的平均值。應至少對4例的研究受試者重復分光光度計檢定�����,每例研究受試者至少使用4個皮膚部位�����,以證明分光光度計測量結果的再現性�����。為了確定分光光度計之間和內部的程序一致性,每例受試者的分光光度計內和分光光度計間測量的變異性變異系數(CV)不得超過15%����。
3.1.2 操作人員的資格認證
進行操作人員資格認證�,以支持證明在多位操作人員之間分光光度計測量的耐用性����。進行試驗性和關鍵性血管收縮研究的操作人員應報告其特定的識別號或名稱,并獲得資格����,以確保每位操作人員都一致性地操作分光光度計和測量皮膚反應�����。操作人員資格認證應由多名操作人員在 1例受試者身上使用 1臺分光光度計進行����,每例受試者在1個規定的皮膚部位至少有4個讀數。操作人員內變異性的計算為��,1 名操作人員在 1 個皮膚部位使用 1 臺分光光度計���,計算多個讀數內的變異性��。操作人員間變異性的計算為��,不同操作人員之間的變異性,即使用同一受試者的 1個皮膚部位的 1 臺分光光度計����,計算每位操作人員的多個讀數的平均值���。應至少對 4 例的研究受試者���,重復操作人員資格認證���,每例研究受試者至少有 4 個皮膚部位����,以支持證明方法的再現性��。為了確定操作人員之間和操作人員內部的程序一致性��,操作人員內部和操作人員之間測量值的CV應不超過每例受試者的15%。
3.2 給藥持續時間-反應模型
應優化進行關鍵性血管收縮生物等效性研究的條件��,以確保在反應曲線的敏感(陡峭)部分�,比較試驗的局部用皮質類固醇和參比標準品,在這種條件下血管收縮反應對試驗品和參比標準品之間皮質類固醇生物利用度的差異���,是敏感的和有區別力的。局部用皮質類固醇的給藥持續時間-反應關系的建立�,依賴于預定劑量的藥物產品持續給予皮膚����。建立局部用皮質類固醇的給藥持續時間-反應關系��,將確定敏感的給藥持續時間-反應區域����,以支持關鍵性研究設計����。應測量反應的時間過程,直到其回到基線����,以確保在每個給藥持續時間�,觀察到最大藥效反應���。
識別藥效學皮膚變白效應的給藥持續時間-反應曲線的敏感和區分區域��,有以下益處:(1)產生預期釋入皮膚的皮質類固醇藥物量增加的條件[調節釋入皮膚藥物(皮質類固醇)量的實際方法����,是在皮膚上給予固定量的局部用皮質類固醇產品����,逐漸增加給藥持續時間];(2)測量由皮膚血管收縮引起的皮膚變白的效果�����。
盡管有多種模型可用于表達藥物劑量和藥效學效應之間的關系�����,但 FDA 建議使用下面最大效應(Emax)模型,描述局部用皮質類固醇的給藥持續時間-反應,該模型根據基線效應(E0)、Emax和ED50時的給藥-持續時間(D)��,描述效應量(E)�����。
如果潛在申請人認為上述 Emax模型不合適�,可以使用替代模型���,并提供理由和適當的模型選擇程序(見附錄IV)����。潛在申請人應證明其選擇的Emax模型是合理的,并鼓勵他們使用藥效學血管收縮研究數據���,支持從給藥持續時間-反應模型中選擇給藥持續時間,以便群體估計。在群體給藥持續時間-反應模型中���,可以考慮 Emax和 ED50的固定效應和(或)隨機效應。應規定群體分析中Emax和ED50參數的模型參數分布假設的類型(正態或對數正態)。潛在申請人應描述其模型優化程序�����,并在ANDA前會議請求或ANDA提交資料中����,提供ED50選擇的理由。建議包括的模型優化的一些方面如下:Emax模型選擇;估算方法比較�����;模型參數選擇��;錯誤模型選擇;初始估算程序[6]��。
當皮膚血管系統不能進一步收縮時����,體內血管收縮反應(用作皮膚變白檢測)通常接近最大值�����。在強效局部用皮質類固醇的相對較高作用強度下,隨著給藥持續時間的延長�����,血管收縮反應可能減弱(高端反應曲線變平)��。相反�����,在低效局部用皮質類固醇的相對較低作用強度下,盡管給藥持續時間延長),但引發血管收縮反應可能是困難的(低端反應曲線變平)�。因此��,潛在申請人應設計試驗性血管收縮研究,根據局部皮質類固醇的作用強度,適當覆蓋大部分給藥持續時間-反應曲線,從而改進給藥持續時間-反應模型。
3.3 研究設計
3.3.1 試驗性研究
該給藥持續時間-反應研究應僅基于參比標準品 ���,并隨機化持續給藥的皮膚部位。
應使用每個臂上未經處理的對照部位,校正研究期間與藥物暴露無關的活性藥物皮膚部位的顏色變化��。由于與參比標準品相對應的輔料通常不可得��,未經處理的對照部位指的是���,未處理的皮膚區域����,而不是應用輔料的皮膚區域��。
應適當設計給藥持續時間(如 0.25~6.0 h),以探索給藥持續時間-反應關系�,并確定關鍵性研究的適當給藥持續時間�����。在去除殘留的局部皮質類固醇后,通過每個給藥持續時間結束時的分光光度計讀數 �,根據效應曲線下面積(AUEC)測量藥效學反應���。
應使用非線性混合效應模型方法��,建立給藥持續時間-反應數據模型,以確定群體 ED50值���,該值將作為關鍵性血管收縮研究的近似給藥持續時間。建議至少12例受試者��。
3.3.2 關鍵性研究
該藥效學生物等效性研究采用基于試驗性研究中確定的群體 ED50試驗的局部用皮質類固醇和參比標準品的單次給藥持續時間�。此外,關鍵性研究中還應包括參比標準品的每個給藥持續時間(D1和D2)的重復���。
對于生物等效性分析,個體受試者的選擇基于每例受試者 D2處的平均參比 AUEC 與 D1處的平均參比AUEC的可接受比率�����。如果提出簡單的Emax模型 �,則比率的最小值應為 1.25,D1 和 D2 處的平均AUEC 值均為負值�����。然而��,根據所選的給藥持續時間-反應模型,可以使用該比率的其他值并提供理由。符合該給藥持續時間-反應標準的個體受試者(在平均 D1和 D2值均為負值的條件下)被定義為檢出者(detector,即可評價的受試者)。
申請人有責任設計充分有力的關鍵性生物等效性研究�����。建議申請人納入足夠數量的受試者�����,以產生足夠數量的檢出者���,為研究提供動力��。在確定入選受試者的樣本量時��,應考慮退出率和所需檢出者的估計數量。根據ANDA中提交的研究結果����,關鍵性研究通常使用 40 例或更多檢出者����。關鍵性研究的樣本量的確定����,應在方案中預先規定并證明其合理性。應招募足夠的受試者�,持續給藥的皮膚部位隨機化��,并在研究開始時給藥,以確保所需數量的檢出者用于分析�����。分析中應包括所有檢出者����。
3.4 受試者入選標準
一般人群中的男性和未懷孕�����、未哺乳的女性�����。證明對參比標準品有充分的血管收縮反應的受試者(有關篩選反應的受試者,請參考第3.6節)。在整個研究過程中���,愿意使用相同的肥皂或潔膚液淋浴(研究完成期間的篩選訪問)。愿意遵守研究限制[請參考第9.1(.c)(-f)節]��。
3.5 受試者排除標準
臨床上嚴重的高血壓或循環系統疾病����。研究1周內吸煙。研究前或研究期間,咖啡因攝入量每天超過500 mg。咖啡、茶和能量飲料都應被視為重要的咖啡因來源����。具有臨床意義的酗酒或藥物濫用史�。
研究前1個月內在前臂腹側使用局部皮膚病藥物治療(作為治療或參與臨床研究)�����。局部或全身皮質類固醇的不良反應。任何當前或過去的疾病���,包括活動性皮炎或任何其他皮膚病����,都可能明顯影響對所給藥物的藥效學反應�。
使用任何可能調節血流的血管活性藥物(收縮劑或擴張劑�����,處方藥或非處方藥)����。這類藥物的實例包括硝酸甘油��、抗高血壓藥�、抗組胺藥�、非甾體抗炎藥、阿司匹林和含有抗組胺藥和(或)苯丙醇胺或酚妥拉明的非處方咳嗽或感冒藥���。
需要前臂腹側剃毛,以確保皮膚表面的劑量一致�。兩手臂之間膚色的任何明顯差異����。
3.6 篩選反應的受試者
在該指導原則中,“反應者(responder)”被定義為在試驗性和關鍵性血管收縮研究中���,在使用相同密封或非密封條件下,對相應參比標準品的單次給藥持續時間�,表現出皮膚變白血管收縮反應的受試者�。在試驗性和關鍵性血管收縮研究中�,用分光光度計量化皮膚變白,被認為是最令人滿意的反應測量�。然而����,反應者的狀態可基于離散多單位量表的視覺讀數(0~3或0~4)����。建議給藥持續時間4 h或6 h,在除去藥物后2 h����,評估皮膚變白。反應者顯示至少1個單元的視覺讀數����。
納入無反應者�����,可降低研究檢測試驗的局部用皮質類固醇和參比標準品之間真實差異的能力(如果存在)。因此���,對于試驗性給藥持續時間-反應研究和關鍵性生物等效性研究,只有反應者才應納入研究�。
為了保護前臂腹側的皮膚部位����,以便在給藥持續時間-反應研究或生物等效性研究中使用����,反應者的狀態可基于在前臂以外的部位(如上臂)的研究。研究報告中應包括確定反應者的標準(包含給藥持續時間��、反應強度和試驗的皮膚部位)����。
3.7 密封與非密封
當特定參比標準品的說明書中允許使用密封時,可使用非吸收性密封薄膜��,進行試驗性給藥持續時間-反應血管收縮研究和關鍵性血管收縮(生物等效性)研究�。密封可能僅適用于血管收縮研究中作用較弱的產品。建議謹慎��,因為試驗性研究數據表明 ED50(關鍵性研究中使用的給藥持續時間)隨著局部用皮質類固醇產品作用的增強而降低[7]�����。給藥持續時間-反應評價需要 ���,低于 ED50 的某個時間(即 D1)的給藥持續時間數據。很短的給藥持續時間很難進行試驗,并且往往產生反應的高變異性��。如果密封用于試驗性血管收縮研究�,它也應用于關鍵性血管收縮研究。
3.8 敷藥和除去方法
在試驗性和關鍵性血管收縮研究中,可采用同步除去的交錯敷用(即在不同時間將局部用皮質類固醇敷于皮膚部位,并同時除去)(見附錄I)���。
3.9 研究日活動和限制
3.9.1 試驗性研究
(a)受試者應在每個研究日大致相同的時間(1 h內)開始研究。
(b)通過排除可調節血流藥物(收縮劑或擴張藥)的充分洗脫史檢查。
(c)在研究持續期間����,大體上任何1只手臂都不運動���,也不劇烈運動����。
(d)在藥物敷用和皮膚變白評估期間�����,不得洗澡或淋浴�。
(e)在研究前24 h內和整個過程中�����,前臂上不得使用護膚劑���、潤膚劑或類似產品�����。
(f)前臂應無任何污垢或顆粒物質��,這些物質可干擾藥物的正確敷用或藥效學反應的評估�。不鼓勵清潔皮膚,因為可能會影響藥物吸收和藥物的藥效反應。如有必要���,應在用藥前至少 2 h進行清潔。如果進行了清潔,應在研究報告中注明���。
(g)無論研究是在密封或非密封條件下進行建議使用保護性非密封防護裝置,防止皮膚部位涂抹或從皮膚部位去除局部用皮質類固醇。應注意避免防護裝置與局部用皮質類固醇接觸����,以防止未經治療的對照部位或其他試驗部位意外污染���。
(h)皮膚部位離肘前窩或腕關節的距離不得小于3~4 cm�����。
(i)參比標準品應適用于前臂腹側相同表面積的皮膚部位。建議試驗性研究的給藥持續時間為0.25��、0.5����、0.75、1���、1.5、2、4���、6 h,但可因研究中的局部皮質類固醇而異。
(j)8個給藥持續時間(即活性藥物部位),應在兩個臂之間平均分配。
(k)研究開始前��,應確定藥物用量����、皮膚部位大小和部位間距。如研究人員在每平方厘米(cm2)皮膚表面積,可以使用 5~12 μL制劑和范圍為 1.6 cm直徑部位。根據皮膚表面的適宜性(如血管�、痣等)和手臂長度����,部位的中心距可接近2.5 cm����,可呈直線或交錯排列��。如果2個相鄰試驗部位的血管收縮效應重疊�����,且研究者無法辨別每個試驗部位的收縮效應,則應將其受試者排除在數據分析之外���。應將 8個給藥持續時間(一式兩份;見附錄 II)和 4 個未處理的對照部位隨機分配到 20個部位����,保留 2個未處理的對照部位���,每臂 8 個給藥部位(每個臂 10 個部位)���,并在每個持續時間重復測量�����。
(m)在敷藥期結束測量藥效學皮膚變白(血管收縮)反應之前,應輕輕除去皮膚上殘留的局部皮質類固醇���。這可以通過下列任一種方法實現:用干棉簽連續 3 次擦拭�;或用溫和的皮膚清潔劑和水清洗所有皮膚部位���,用非摩擦性毛巾吸干皮膚部位�,并在評估前風干至少 5 min���。用最少量的溫和液體皮膚清潔劑清潔手臂表面���,如1滴液體清潔劑����,在濕潤的手上起泡沫,然后沖洗����。如果 5 min后��,受試者有任何與洗滌相關的可見皮膚影響,則可能需要更長的等待時間�����。該方法適用于同步去除法的交錯敷藥���。
(n)評 估 每 個 部 位 的 基 線 皮 膚 顏 色 和 皮 膚變白����。交錯敷藥和同步去除的評估時間段示例如下:對于所有給藥持續時間和未處理的對照部位,在最長給藥持續時間的藥物敷用前 1 h 內���,以及在 0、2����、4��、6、8����、10、12、20����、24 h或更長時間內的基線讀數���,直到藥物產品去除后反應恢復到基線(見附錄 I)�。給藥持續時間將取決于所研究的局部皮質類固醇�。時間零點(0)定義為去除藥物后15 min內。
3.9.2 關鍵性研究
(a)如適用�����,遵循上文第“3.9.1”節中列出的建議��。為了消除潛在的操作員偏倚���,分析員(如分光光度計操作員)應該對產品處理分配處于盲態���。
(b)應隨機分配每個受試者前臂腹側皮膚部位的給藥持續時間的敷藥�,維持以下建議���。根據上文第“3.7”節的考慮因素和試驗性研究中使用的研究設計�,可能密封或非密封部位。還應包括未處理的對照皮膚部位。各臂上的給藥持續時間和對照部位應包括:
R:根據試驗性研究中的參比標準品,確定的給藥持續時間約相當于 ED50的參比標準品(如每臂 2個部位)���。
T:試驗局部皮質類固醇的給藥持續時間與參比標準品的ED50大致相同(如每臂2個部位)。
D1:較短給藥持續時間的參比標準品校準部位(如每臂2個部位)。
D2:較長給藥持續時間的參比標準品校準部位(如每臂2個部位)��。
UNT:未處理的對照組(如每臂2個部位)���。治療部位的總數為 16 個(即每臂 8 個部位)����。如上所述,8 個治療和 2 個 UNT 應隨機��。每個臂上的敷藥方式應該是互補的����,即 D2與 D1互補,R 與 T互補���,UNT 與 UNT 互補。例如����,當 T 被分配給 1 只手臂上的特定皮膚部位位置時�����,R應該被分配給另1只手臂的相應皮膚部位。如果 UNT 被分配給 1 只手臂上的特定皮膚部位位置,則UNT應被分配給另1只手臂的相應皮膚部位�。
特定受試者兩臂從肘前窩到腕關節的代表性敷 藥 順 序 可 能 如 下 :左 臂 為 D1��、T、UNT、R、D1�����、UNT�、T、D2�����、R����、D2;右臂為 D2��、R����、UNT���、T�、D2、UNT����、R����、D1���、T�����、D1���。
在研究報告或研究方案中���,應描述皮膚部位的具體模式�����,即內側(尺骨)到外側(橈骨),以及上下���。
(c)對于D1�、D2和ED50給藥持續時間,應使用與試驗性研究中使用的方法一致的交錯敷藥和同步去除方法。
(d)參考第 3.9.1(n)節,評估每個部位的基線膚色和皮膚變白��。
3.10 數據分析和藥效學模型
3.10.1 試驗性和關鍵性研究的AUEC計算
(a)調整(通過減法)每個皮膚變白反應的分光光度計原始數據與時間曲線(活性藥物部位和未處理的對照部位)�����,以確定該部位的基線值���。根據同一臂上 2 個基線調整的未處理對照部位的平均值�,校正每個基線調整的活性藥物部位。
(b)使用梯形法計算每個基線調整���、未處理對照部位校正給藥持續時間的AUEC(見附錄III)。同步去除法交錯敷藥的 AUEC(0-t() 見附錄 III)���,0 為藥物去除后 15 min 內 ,t 為藥物去除后至少24 h�。
3.10.2 試驗性研究的藥效學模型
(a)不建議通過每個給藥持續時間的各受試者的平均值���,擬合給藥持續時間-反應數據�����。相反,該數據應該通過使用非線性混合效應模型���,使用所有個體受試者的所有觀察結果擬合。模型軟件應提供����,至少 12 例受試者數據的 ED50 和 Emax 參數的總體估計�����。
(b)確定 ED50(對應于半數最大反應的給藥持續時間)�����。
(c)確定D1和D2���,分別對應于ED50的大約1/2和ED50的2倍(對于使用的簡單Emax模型)����,以用于關鍵性研究�。這些值包括 ED50,分別對應于最大反應的約33%和67%,代表給藥持續時間-反應曲線的敏感部分。估計的 ED50值最多可四舍五入 15 min,以獲得關鍵性研究中使用的 ED50值����。對于 ED50值較短的強效皮質類固醇��,這些建議可能需要調整。如果是這樣的話,可以通過受控通信或對于相關復雜產品通過ANDA前會議��,咨詢FDA����。
3.10.3 關鍵性研究的數據分析
(a)數據分析中只應包括檢出者的數據。定義檢出者的給藥持續時間-反應標準為:
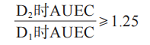
D2 時 AUEC 為 D2 時 左 臂 和 右 臂 AUEC 的 平 均 值 ����,D1 時AUEC為D1時左臂和右臂AUEC的平均值
(b)生物等效性比較應基于根據附錄III計算的AUEC值��,給藥持續時間約等于ED50(治療T和R)。
(i)統計分析需要使用未轉換的數據����,因為治療T和R的AUEC值(根據基線調整的����、未處理的對照部位-校正數據計算)通常為負值�����,盡管有時為正值。正和負數據的存在 �,阻止傳統統計轉換的使用�����。Locke方法[8]可提供未轉換數據的精確置信區間。
(ii)使用來自檢出者的數據�,應使用Locke方法計算���,試驗產品(如AUEC0-24h)反應(4次重復的平均值)與參比產品(的 AUEC(如 AUEC0-24h)反應(4 次重復的平均值)之比的 90%CI����。附錄 V 給出了基于數據的公式和樣例。
試驗與參比 AUEC之比的 90% 置信區間��,不應在80.00%~125.00%區間內�����。
3.10.4
數據提交的格式應按照 FDA 的建議�,以下列格式提交試驗性和關鍵性研究的研究數據 :https://fda.report/media/87599/Topical-DermatologicCorticosteroids-In-Vivo-Bioequivalence-Study-Summary-Tables-and-SAS-Transport-Formatted-Tablesfor-Dataset-Submission.pdf�����。分光光度計原始數據���、基線調整數據�����、基線調整的未處理對照部位校正數據 和 AUEC 數 據 應 安 排 在 單 獨 的 文 件 中 ����。
應提交所有研究數據,包括非檢出者的數據�����。在血管收縮研究評價中未使用的任何數據��,都應附有解釋(如非檢出者�、由于鄰近部位導致的血管收縮效應重疊等)����。隨機化代碼應與研究報告一起提交,說明每個給藥持續時間和對照部位分配的特定皮膚部位����。
四��、附錄
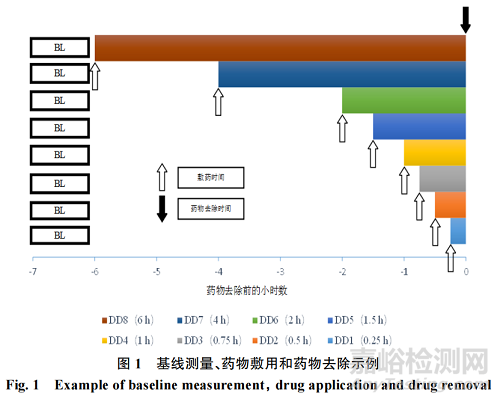
4.1 附錄 I:試驗性研究方案的同步去除交錯敷藥示意圖
上文第“3.8”節提及試驗性研究方案的敷藥和除去方法,此處用圖 1 詳細介紹基線(baseline)測量�、藥物敷用和藥物去除示例�,DD 為給藥持續時間(DD-dose duration)����。上文第“3.9.1”節提及交錯敷藥和同步去除的評估時間段,在此用圖 2 詳細展示�����。圖2中時間零點(0)為去除藥物后15 min內�。

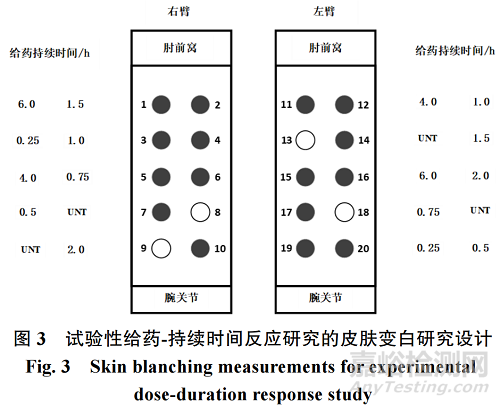
4.2 附錄 II:試驗性給藥-持續時間反應研究的皮膚變白研究設計的示例
上文第“3.9.1(l)”提及兩臂隨機分配給藥部位和未處理部位,在此用圖 3 形象展示���。圖中亮圓為未處理的部位;而暗圓則為不同給藥持續時間的治療部位����;0.25~6.0 h 的給藥持續時間代表皮膚暴露于參比標準品的時間。
4.3 附錄III:AUEC的計算
步驟1:計算每個相應治療部位的基線調整、未處理對照部位校正的量表數據(Ci�,j):
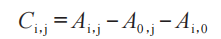
其中i是藥物去除后的第i次測量(h):如���,從0 h到(t 至少24 h)����;j是第j個給藥持續時間:從給藥持續時間DD1到最后給藥持續時間 DDn����;Ai,j是在藥物去除后的時間 i處,第 j個給藥持續時間內����,每個相應治療部位的原始量表數據部位讀數����;A0����,j是最長給藥持續時間���,用藥前 1 h 內的基線(給藥前)讀數���;Ai�,0是在同一臂的藥物去除后的時間i的未處理對照部位讀數的平均值
步驟 2:根據基線調整和未處理對照部位的AUEC 計算����,校正所有受試者的試驗局部皮質類固醇和參比標準品量表數據(Ci,j)�。

其中 t0表示第 1次測量的藥效學反應的時間��,如藥物去除后0.25 h�����;Δti=ti+1-ti��,tlast 表示最后1次測量的藥效反應時間
4.4 附錄IV:EMAX模型
應使用群體模型方法,開發如下所示的簡單Emax模型,因為Emax模型需要考慮受試者之間的變異性�����。FDA不再建議使用幼稚的池(所有受試者都作為1個池)���。
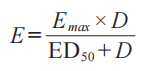
E是敷藥給藥持續時間(D)時的反應(基線調整��、未處理對照部位校正 AUEC)����,Emax是最大反應�����,以及 ED50是發生半數最大反應的持續時間���。
如果上述 Emax模型不能擬合給藥持續時間-反應數據����,則可以使用替代的 sigmoidal 模型�����,并提供理由和適當的模型選擇程序。潛在的替代模型如下:

如果有充分的理由��,其他替代模型也可以接受��。有關群體模型��、模型驗證/確認和 Emax模型的詳細信息,請查閱下列指導原則和出版物�����。群 體 藥 動 學 供 企 業 用 的 指 導 原 則(2022年2月)[6]��;
暴露-反應關系—研究設計�、數據分析和監管應用供企業用的指導原則(2003年4月)[9]���;
Ozdin等[10]重新審視 FDA 1995年《局部皮膚用皮質類固醇生物等效性建立:基于研究的新建議》指導原則�����;
Upton 等體模型����、模擬和基于模型的藥物開發的基本概念:第3部分:藥效學模型方法介紹[11]���。
4.5 附錄V:生物等效性評價的LOCKE法和樣例
表 1 中關鍵性生物等效性數據集(關鍵性研究中受試者的平均 AUEC值)的 90% 置信區間計算如下���。用于計算置信區間的數據是,“檢出者”的平均基線調整值和未處理的對照部位校正AUEC值���。置信區間的計算可通過下列中間量的計算實現:
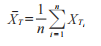

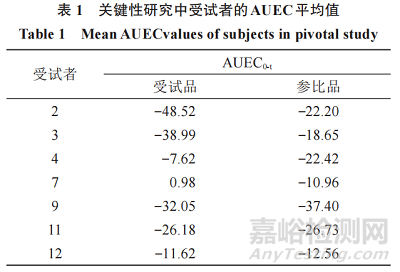
在該例中,這些是XˉT=−23.43����,XˉR=−21.56,σ?TT=323.13�,σ?RR=80.10��,和σ?TR=78.83;對于n=7��,(t 自由度6)為1.943 2�。G=0.093 0<1,則K=6 872.791�。
根據可評價受試者的數據�����,90% 置信區間限值為 53.6% 和 165.9%,不在 80.00%~125.00% 可接受范圍內�。
五���、結語
FDA“皮膚局部用皮質類固醇 :體內生物等效性的供企業用的指導原則草案”對局部用皮質類固醇體內藥效學生物等效性研究提出了許多 具 體 的 建 議 ����,涉 及 許 多 方 面 ��,其 中 包 括 血 管收縮方法的檢定 ��、給藥持續時間-反應模型 、研究設計�����、受試者入選標準和排除標準����、篩選有反應的受試者、密封與非密封給藥�、敷藥和除去方法���、研究日的活動和限制以及數據分析和藥效學模型并輔以圖表和計算說明�����。這些建議對我國這方面的研究和監管有重要的參考價值 ���,并有如下啟示�。
5.1 中國應制定“皮膚局部用皮質類固醇體內藥效學生物等效性研究指導原則”
美國 FDA于 2022 年 10 月發布的“皮膚局部用皮質類固醇:體內生物等效性的供企業用的指導原則草案”是在 1995 年 6 月發布的“皮膚局部用皮質類固醇:體內生物等效性”供企業用的指導原則”基礎上,經歷 20 多年反復修訂而形成的新的版本��,這種研究方法趨于成熟�。雖然中國在“局部給藥局部起效藥物臨床試驗技術指導原則”[12]中,提及“對于含皮質類固醇激素的外用制劑�����,可在藥學對比研究達到高度相似性的基礎上�����,后續采取皮膚變白試驗(skin blanching study)這一體內藥效學方法�,以PD 參數為終點來評估仿制藥與參比制劑的等效性����。”,但還沒有專門針對皮膚局部用皮質類固醇體內藥效學生物等效性研究的指導原則。建議我國藥政管理部門,參考本文介紹的 FDA 指導原則,結合我國實際制定“皮膚局部用皮質類固醇體內藥效學生物等效性研究指導原則”����。
5.2 FDA該指導原則中特別值得關注的建議
FDA在本文介紹的指導原則中有許多建議�,有利于我國這類藥品的研究和監管��,值得我國這類藥品研究和監督管理人員特別關注����。譬如��,操作人員內部和操作人員之間測量值的CV應不超過每例受試者的 15%���;給藥持續時間-反應的 Emax模型���;關鍵性研究通常使用40例或更多檢出者����;受試者的入選和排除標準��;試驗性給藥持續時間-反應研究和關鍵性生物等效性研究��,只有反應者才應納入研究;研究日的活動和限制;試驗與參比AUEC之比的 90%置信區間���,不應在80.00%~125.00%內。