今日頭條
愛科諾RIPK2抑制劑獲批I期臨床����。愛科諾生物自主研發(fā)并擁有全球權(quán)益的RIPK2抑制劑AC-101獲澳大利亞人類臨床研究倫理委員會(HREC)批準(zhǔn),即將啟動I期臨床試驗。臨床前研究顯示,AC-101能有效抑制NOD-RIPK2通路依賴的炎癥因子的釋放����,在炎癥性腸?。↖BD)模型中具有積極的保護(hù)效果�。該新藥擬開發(fā)用于炎癥性腸病的治療�����。
國內(nèi)藥訊
1.藥欣口服難溶性藥物獲批白血病臨床����。深圳藥欣生物基于其新一代無定形固體分散體技術(shù)SpraySol™平臺開發(fā)的小分子藥物HLK-1004獲FDA臨床許可����,擬開展用于治療新診斷的或?qū)韧委熌退幓虿荒褪艿馁M城染色體陽性的慢性髓性白血病(Ph+CML)慢性期或加速期成人患者,以及2歲以上兒童慢性髓性白血病的臨床研究。該公司還計劃盡快啟動HLK-1004的國內(nèi)IND申報工作�。
2.FIC多激酶抑制劑在華獲批眼科臨床�����。Cloudbreak公司1類化藥CBT-001眼用乳液獲國家藥監(jiān)局臨床試驗?zāi)驹S可,擬開發(fā)用于阻止翼狀胬肉生長及減少結(jié)膜充血��。CBT-001是一種強效多激酶抑制劑���,其靶向VEGFRs���、PDGFRs��、FGFRs等靶點���,可以抑制血管生成和纖維化�����。在Ⅱ期臨床中,CBT-001在減少翼狀胬肉血管分布、角膜病變長度和結(jié)膜充血方面表現(xiàn)出較為顯著的療效�,而且藥物總體耐受性良好,且沒有報告嚴(yán)重的藥物反應(yīng)或不良反應(yīng)����。
3.祐和全球首創(chuàng)PD1/CD40雙抗國內(nèi)獲批臨床�。百奧賽圖旗下祐和醫(yī)藥1類生物制品YH008注射用凍干粉獲國家藥監(jiān)局臨床許可��,擬開展評估用于晚期腫瘤受試者治療的I期臨床��。YH008具有PD-1依賴的CD40激動活性,同時又具有兩個靶點的免疫協(xié)同作用�����。去年12月��,YH008已獲FDA批準(zhǔn)開展I期臨床�,評估單藥治療PD-(L)1耐藥的晚期實體瘤和血液瘤患者的安全性和初步療效��。
4.博奧信Siglec-15單抗國內(nèi)報IND�。博奧信生物1類新藥BSI-060T注射液的臨床試驗申請獲CDE受理�����。BSI-060T是博奧信開發(fā)的抗Siglec-15單克隆抗體��,可通過靶向M2巨噬細(xì)胞、S15誘導(dǎo)的骨髓細(xì)胞和S15陽性腫瘤��,來阻斷S15引起的免疫抑制��。2022年12月��,BSI-060T已獲FDA批準(zhǔn)臨床,用于治療膀胱癌�、膽管癌��、結(jié)直腸癌和腎癌等實體瘤患者。Pyxis Oncology公司擁有BSI-060T在大中華區(qū)以外的全球開發(fā)和商業(yè)化授權(quán)����。
5.凡恩世與安斯泰來子公司達(dá)成合作�。凡恩世公司宣布與安斯泰來公司旗下的Xyphos Biosciences公司達(dá)成一項研究合作協(xié)議�����,將利用凡恩世公司的專有技術(shù)平臺PACbodyTM和SPECpairTM評估腫瘤領(lǐng)域中的細(xì)胞療法����。PACbodyTM和SPECpairTM技術(shù)平臺可以構(gòu)建天然IgG結(jié)構(gòu)的雙特異性抗體�,并能利用傳統(tǒng)的單克隆抗體制備工藝來生產(chǎn)。根據(jù)協(xié)議�����,凡恩世將獲得技術(shù)使用費和進(jìn)一步的合作研究支持�。財務(wù)條款細(xì)節(jié)未披露。
6.上海柏全生物完成逾億元PreA輪融資���。上海柏全生物宣布完成逾億元PreA輪融資,本輪融資由凱風(fēng)創(chuàng)投領(lǐng)投��,宏科百世與仙瞳資本跟投�����,天使輪投資方上海生物醫(yī)藥基金追加投資�。柏全生物成立于2020年�����,致力于腫瘤免疫治療新靶點和藥物研發(fā)與生產(chǎn)��。該公司的主要管線針對PD-1/PD-L1抑制劑治療無效的腫瘤為主要適應(yīng)癥,已完成IND相關(guān)的主要研究��。本輪融資將用于推進(jìn)首款產(chǎn)品的臨床前與臨床研究���。
國際藥訊
1.默沙東PCSK9抑制劑IIb期臨床成功�����。默沙東PCSK9抑制劑MK-0616治療高膽固醇血癥患者的IIb期臨床MK-0616-008(NCT05261126)結(jié)果積極。與安慰劑相比,MK-0616治療在第8周時能顯著降低患者的低密度脂蛋白膽固醇(LDL-C)�����;經(jīng)安慰劑調(diào)整后�����,4個劑量組(6mg�、12mg�、18mg和30mg)的LDL-C水平較基線分別下降41.2%、55.7%���、59.1%和60.9%,均具有統(tǒng)計學(xué)顯著性��。MK-0616的耐受性良好��,未出現(xiàn)與治療相關(guān)的嚴(yán)重不良反應(yīng)����。
2.衛(wèi)材Aβ抗體獲FDA優(yōu)先審評���。衛(wèi)材與渤健合作開發(fā)的阿爾茨海默病抗體療法Leqembi(lecanemab)的補充生物制品許可申請(sBLA)獲FDA受理����,尋求將加速批準(zhǔn)轉(zhuǎn)變?yōu)橥耆鷾?zhǔn)。FDA同時授予其優(yōu)先審評資格,預(yù)計今年7月6日前做出回復(fù)�。在Ⅲ期臨床中���,與安慰劑組相比,Leqembi治療組患者第18個月時評估患者認(rèn)知和日常功能的綜合評分CDR-SB的增加速度降低27%���,淀粉樣蛋白沉積水平降低約70%。
3.FGFR3抑制劑治療軟骨發(fā)育不全Ⅱ期臨床積極���。BridgeBio公司口服FGFR3抑制劑infigratinib治療軟骨發(fā)育不全兒童患者的Ⅱ期臨床結(jié)果積極���。infigratinib通過阻斷FGFR3的活性直接靶向軟骨發(fā)育不全的潛在病理生理學(xué)��,從而促進(jìn)軟骨內(nèi)骨形成,讓患兒的生長速率恢復(fù)正常����。結(jié)果顯示����,接受最高劑量治療的患兒在6個月時���,年平均身高生長速度較基線提高3.03厘米/年(p=0.0022)���,藥物總體耐受性良好�����。
4.阿斯利康/第一三共ADC實體瘤Ⅱ期臨床積極��。阿斯利康與第一三共開發(fā)的HER2-ADC新藥Enhertu(trastuzumab deruxtecan)在治療HER2陽性、轉(zhuǎn)移性實體瘤經(jīng)治患者的Ⅱ期臨床(DESTINY-PanTumor02)最新結(jié)果積極��。入組患者癌癥種類包含膽道癌��、膀胱癌���、宮頸癌、子宮內(nèi)膜癌�、卵巢癌�����、胰腺癌和罕見腫瘤。分析顯示����,Enhertu達(dá)成客觀緩解率和緩解持續(xù)時間這兩項療效終點���。研究中�����,藥物的安全性與以往試驗一致。
5.Theravance暫停吸入型JAK抑制劑開發(fā)�。Theravance公司在2022年財務(wù)報告中透露�����,公司將優(yōu)先分配資源給去甲腎上腺素再攝取抑制劑ampreloxetine的III期CYPRESS研究以及完成M3受體拮抗劑Yupelri(revefenacin)與噻托溴銨相比治療重度慢性阻塞性肺疾病(COPD)的IV期PIFR-2研究����,暫停吸入型JAK抑制劑TD-0903開發(fā)計劃���。TD-0903擬開發(fā)用于治療急��、慢性肺部炎癥、纖維化疾病��,目前處于II期階段�。受此影響,Theravance 的員工總數(shù)將減少約17%���,裁員計劃將于2023年3月底前完成����。
6.Incyte終止帕薩利司一項聯(lián)合用藥III期研究。Incyte公司宣布將終止PI3Kδ抑制劑帕薩利司(Parsaclisib)聯(lián)合蘆可替尼治療骨髓纖維化的III期LIMBER-304研究。該項試驗在對蘆可替尼反應(yīng)不佳的骨髓纖維化患者中評價Parsaclisib聯(lián)合蘆可替尼治療的效果。獨立數(shù)據(jù)監(jiān)測委員會(IDMC)評估的中期分析表明�����,該研究不太可能達(dá)到意向治療患者群體的主要終點�����。信達(dá)生物擁有parsaclisib在大中華區(qū)的開發(fā)和商業(yè)化權(quán)利�。
醫(yī)藥熱點
1.財政斥2000億元支持地方防疫等工作。3月5日���,十四屆全國人大一次會議審查《關(guān)于2022年中央和地方預(yù)算執(zhí)行情況與2023年中央和地方預(yù)算草案的報告》?����!秷蟾妗穼?023年主要收支政策作出安排�����,明確支持提高醫(yī)療衛(wèi)生服務(wù)能力���?�!秷蟾妗诽岢觯ㄟ^一般性轉(zhuǎn)移支付安排財力補助資金1700億元�����、使用2022年權(quán)責(zé)發(fā)生制結(jié)轉(zhuǎn)資金300億元���,支持地方做好疫情防控等工作����,重點向縣級財政傾斜�。
2.海南省醫(yī)改研究智庫成立。日前�,海南省醫(yī)改研究智庫在?���?谑谐闪?��,37名省內(nèi)外專家被聘為首批海南省醫(yī)改研究智庫特約研究員��。海南省醫(yī)改研究智庫將對海南省醫(yī)改進(jìn)行整體性�、系統(tǒng)性�、專業(yè)性的研究,為海南各級衛(wèi)生健康行政部門、企事業(yè)單位及社會各界提供醫(yī)改政策咨詢和服務(wù),以前瞻性的醫(yī)改研究成果和專業(yè)的服務(wù)��,深化海南醫(yī)療����、醫(yī)保、醫(yī)藥聯(lián)動改革,持續(xù)推進(jìn)解決人民群眾看病難�����、看病貴等問題�。
3.強生中國骨科負(fù)責(zé)人離任。強生中國日前宣布�����,強生醫(yī)療科技中國骨科負(fù)責(zé)人陳敏將于3月12日正式離任�����,現(xiàn)任強生脊柱及PCMFT事業(yè)部副總裁韓偉將擔(dān)任強生中國骨科事業(yè)部總經(jīng)理,于2023年3月1日生效�����。資料顯示����,韓偉由校招加入強生醫(yī)療,從一線銷售開始����,先后擔(dān)任Cordis Endovascular和ASP事業(yè)部總監(jiān)����,并于2016至2018年在美國參加全球發(fā)展計劃(IDP)���,擔(dān)任BW全球戰(zhàn)略市場部總監(jiān)。
4.英國重啟“熱線聊天”志愿項目�。英國《每日郵報》5日報道稱���,英國正在重啟疫情期間的“熱線聊天”志愿項目�,醫(yī)生將為需要被傾聽或聊天的患者“轉(zhuǎn)接熱線電話”��。目前�����,該項目已有超過1000名志愿者報名參加。研究顯示���,孤獨會對健康造成負(fù)面影響,相當(dāng)于肥胖或每天吸15支煙�,此外���,孤獨還會增加認(rèn)知能力衰退的風(fēng)險。
評審動態(tài)
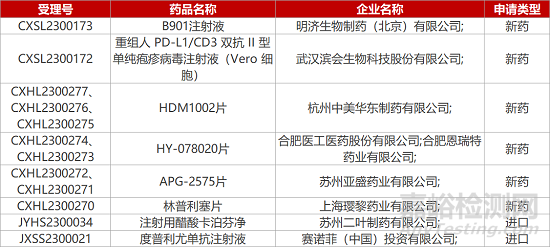
1. CDE新藥受理情況(03月07日)
2. FDA新藥獲批情況(北美03月04日)