生物植入物主要用于醫學或臨床治療,旨在通過整合人體、材料特性和生物植入物的完整性來固定、支撐、再生或改善人體組織的功能。生物植入物主要有多孔骨植入物、假體、可穿戴生物傳感器和藥物輸送系統等。隨著生物材料領域的研究和發展,各種生物植入物得到開發,正確選擇生物材料、制造方法、表面處理和生物學評估是生物植入物應用面臨的重要挑戰。
中國工程院院刊《Engineering》2020年第11期刊發法國國家技術科學院(NATF)呂堅院士研究團隊的《使用2D、3D和4D增材制造材料開發生物植入物》一文。文章指出,增材制造技術發展迅速,在生物醫學應用中顯示出巨大潛力。文章概述了用于生物植入物的2D、3D 增材制造材料。此外,文章在先前開發的4D打印陶瓷前驅體及陶瓷材料的基礎上,受太極思想的啟發,提出了一種簡單而新穎的軟硬集成4D增材制造概念,以應用于人體系統中復雜且動態的生物結構。文章認為,多材料打印技術的發展,使人們未來可以使用2D、3D、4D AM材料開發生物植入物和軟硬集成生物結構。
一、引言
生物植入物主要用于醫學或臨床治療,如多孔骨植入物、假體、可穿戴生物傳感器和藥物輸送系統。通常情況下它們會被植入人體超過30天。它們旨在通過整合人體、材料特性和生物植入物的完整性來固定、支撐、再生或改善人體組織的功能。近年來,由于人口老齡化和醫療領域供體器官的短缺,人類對生物植入物的需求已大大增加。隨著生物材料領域的研究和發展,各種生物植入物,如腦/神經植入物、骨/軟骨植入物、牙科植入物和其他結構植入物已經得到開發。正確選擇生物材料、制造方法、表面處理和生物學評估是生物植入物應用所面臨的主要挑戰。
根據植入物中細胞成分數量的差異,將植入物分為生物植入物、生物標記植入物和生物功能植入物。
生物植入物是以自然生物材料(如細胞蛋白)為打印材料,通過生物打印制備得到的。它們通常包含兩個關鍵組成部分:包含活細胞的生物打印過程和可生物降解的支架/基質材料(如水凝膠)。迄今為止,盡管生物打印已被公認為一種強大的潛在制造技術,但通過該技術制備的生物植入物仍不能用于人體。
生物標記植入物是以細胞成分和不可生物降解的生物惰性材料為原料。生物惰性材料包括不銹鋼(SS, 316L)、鉭、金、鈷-鉻(Co-Cr)合金、鈦(Ti)和鎳鈦合金,它們廣泛用于制備生物標記植入物。
生物功能植入物是指經過表面處理的植入物。通過適當的表面處理,植入物在植入后可產生生物活性表面,從而有利于細胞附著和增殖。細胞黏附生物材料并且在其表面良好增殖,這是組織工程能夠成功的關鍵前提。
與減材制造不同,增材制造(AM)技術是將材料逐層打印到基板上,它為制備具有復雜幾何形狀和有定制要求的生物植入物提供了更好的解決方法。最近,兩篇有關組織/器官3D生物打印的論文發表于Science。基于懸浮水凝膠支撐的打印環境,Lee等提出了一種多尺度人類心臟組織的打印方法。Grigoryan等以光聚合水凝膠為原料,打印制備了肺泡模型的血管內和多血管結構,該模型還被用于嚙齒動物的慢性肝損傷的治療研究。目前,熔融沉積成型(FDM)、選擇性激光熔化(SLM)、立體光刻(SLA)和其他增材制造技術已成功用于制造生物植入物,包括皮質骨、顱骨、軟骨,以及手術工具。但是,目前的打印方法仍存在一些缺點,比如需要后處理、高昂的成本以及有限的可打印材料。因此,必須開發新的打印方法和材料來克服這些局限性。
本文綜述了用于生物植入物的二維(2D)和三維(3D)AM材料。此外,采用新型陶瓷墨水作為四維(4D) AM材料,成功制備了硬質和軟質生物植入物,并實現了在一個模型中將軟質和硬質部分組合在一起。在制備由多種機械模塊組合而成的不同部分的生物植入物(如膝關節和椎骨植入物)的過程中,這類新型陶瓷墨水顯示出巨大的潛力。
二、用于生物植入物的2D AM材料
2D AM是一種通過涂層或其他表面處理技術將材料施加到物體表面的技術。如圖1 所示,2D AM材料被廣泛應用于生物醫學領域。
腐蝕性能、出色的機械性能和生物相容性是生物植入物能夠在人體內部流體環境中運行的重要前提。表面的化學和物理形貌對生物植入物的性能起著至關重要的作用。各種涂層和表面處理方法,包括等離子噴涂、濺射涂層和離子束輔助沉積等,已被用于優化生物材料(如生物陶瓷、生物玻璃、生物聚合物和金屬合金)的機械性能、生物功能性和生物相容性,從而提高生物植入物或其他醫療設備的性能。可生物降解的鎂(Mg)和鈦(Ti)合金是典型的生物植入物材料,這得益于它們長期的結構穩定性和機械耐久性。近年來,上述金屬合金生物材料上的涂層已成為許多研究的主題,包括鎂合金(AZ91)表面上的脈沖電勢磷酸鈣涂層和鎂-鈣(Mg-Ca)合金表面上的羥基磷灰石(HAp)超薄涂層。在模擬體液內部環境的過程中,兩種涂層材料的性能均優于未涂層的材料。另外,通過磁控濺射方法在商業純度(CP)-Ti基板上制備Ti合金膜,可以增強其耐腐蝕性。
研究表明,生物植入物中的鎂可以促進成骨細胞分化并加快大鼠骨折愈合。據報道,已有研究采用磁控濺射方法開發了超納米級的雙相鎂合金,該合金在環境溫度下表現出接近理想的強度。作為可生物降解植入物的涂層,這種超納米尺寸的鎂合金具有很大的制造潛力,可用于改善植入物的耐磨性和成骨誘導分化能力。
天然和合成聚合物被廣泛用作制造再生醫學和組織工程領域的支架或生物植入物。聚合物涂層還可以改善生物植入物的生物相容性和生物功能性。植入物的聚合物涂層已經取得了巨大的進步,例如,涂有聚合物的支架可以緩慢釋放抗動脈狹窄藥物。此外,據報道,可生物降解的彈性體聚氨酯能夠用作基于鎂的可降解血管支架的藥物洗脫涂層。
除了在生物植入物方面的性能外,在組織工程和細胞治療領域,涂層也具有作為智能微型機器人的巨大潛力。據報道,由光刻膠SU-8制成并涂有鎳(Ni)和Ti的多孔微型機器人可以在外部磁場下實現運動控制。使用這種微型機器人,可以在外部梯度磁場下成功實現體內靶向細胞的遞送。研究還發現,帶有Ni涂層的磁驅動微掃描器具有醫學診斷和治療的潛力。
圖1 生物醫學應用中的2D AM材料。(a)有助于成骨分化的植入物衍生的Mg2+擴散示意圖;(b)超納米尺寸的雙相玻璃晶體結構;(c)在模擬的人體環境中,有各種涂層的支架上腐蝕區域的掃描電子顯微鏡圖像;(d)包括Ni/Ti沉積在內的微型機器人的制造過程。DRG:背根神經節;CGRP:降鈣素基因相關肽;TRPM7:瞬時受體電位通道M型7;MAGT1:鎂轉運蛋白亞型1;CALCRL:降鈣素受體樣受體;RAMP1:受體活性修飾蛋白1;PDSC:骨膜來源的干細胞;cAMP:抗菌微生物肽;CREB:cAMP調節的增強子B。(a)~(d)經作者許可轉自參考文獻。
三、用于生物植入物的3D AM材料
盡管研究已經報道了多種生物材料,但并非所有材料都可用于3D打印制備生物植入物。首先,用于制備生物植入物的材料應具有良好的生物相容性和較低的毒性。細胞應該較易黏附在材料表面并順利增殖。由于它們將長期保留在人體中,所以材料不應釋放有毒元素,并應具有適當的降解速度和耐磨性。為了滿足人體中不同位置(如骨骼、軟骨、血管、關節和其他區域)的要求,還應考慮應用環境。對于植入物來說,組織和植入物之間的剛度不匹配會影響植入物使用過程中的負載分擔。承重植入物(如骨植入物)的材料應具備較高的機械強度。因此,金屬和陶瓷是承重植入物的理想選擇。高分子材料具有適當的抗張強度和類似于宿主組織的彈性模量,也是可選擇的植入物材料。
為了通過3D打印方法制造植入物,還必須考慮材料的化學和物理特性。下面討論并介紹幾種已用于生物植入物或潛在的植入物材料。
(一)高分子
經常用于3D打印制備生物支架的高分子包括聚醚醚酮(PEEK)、聚己內酯(PCL)、聚乙烯醇(PVA)和聚L-乳酸(PLLA)。
PEEK是一種具有良好機械性能的熱塑性生物材料,已獲得美國食品和藥物管理局(FDA)的批準,可用于人造骨骼植入物,尤其是位于人體承重部位的植入物。 PEEK的楊氏模量和拉伸強度分別為3.3 GPa和110 MPa,與膠原蛋白的相應值3.75 GPa和100 MPa十分接近。由于與天然膠原蛋白的機械性能接近,因此PEEK是替代人造骨骼植入物中膠原蛋白的合適候選物。PEEK的玻璃化轉變溫度和熔融溫度分別為143 ℃和343 ℃,所以可加工性是PEEK所面臨的一個重大挑戰。在顱頜面(CMF)手術中,利用FDM技術已經制造了針對患者的植入物,其打印床溫度和打印噴頭溫度分別為100 ℃和400 ℃。Haleem和Javaid綜述了3D打印 PEEK在牙科植入物中的應用前景。Zhang等開發了一種基于FDM技術制備具有波浪形彈性結構的肋軟骨假體的新方法。
PCL具有良好的生物相容性和緩慢的生物降解性能,已經獲得FDA的批準,是一種常被用作3D打印骨骼支架的熱塑性聚合物。它具備較低的熔點溫度(60 ℃),即使是臺式FDM也可以制備支架。Zamani 等通過FDM技術制備了具有梯度機械性能的PCL 支架,并且發現其可潛在應用于下頜骨植入物。但是, PCL材料缺乏骨誘導性,因此必須在基質中加入功能化的礦物添加劑,包括磷酸三鈣(TCP)、HAp晶體、脫細胞骨基質(DCB)和人體內的微量元素[如鍶(Sr)、鎂、鋅(Zn)、銀(Ag)和硅(Si)]。PCL支架也可以用于隆鼻手術的臨床應用。
聚乳酸(PLA)是一種半結晶聚合物,其熔融和玻璃化轉變溫度分別為174 ℃和57 ℃。PLA有兩種不同的立體異構體,即PLLA和聚D-丙交酯(PLDA)。PLLA 在人體中的降解速度比PLDA慢得多,因此PLLA通常被用于整形外科植入物材料。PLA已被FDA批準用作人類生物醫學材料,并且其良好的生物相容性和較低的毒性使之在骨科和牙科領域的固定裝置(如螺釘、大頭針、縫合線)上的應用前景廣闊。然而,它也有與PCL類似的問題,即缺乏機械強度和功能性,限制了它的進一步應用。
除上述聚合物外,聚甲基丙烯酸甲酯(PMMA)、 PVA和聚(乳酸-乙醇酸共聚物)(PLGA)被廣泛用于 3D打印的植入物。PMMA在顱骨成形術中的使用可以追溯到20世紀40年代。Petersmann等通過FDM技術使用PMMA制備了顱骨植入物。PVA也顯示出極好的軟骨修復潛力。
(二)陶瓷
陶瓷是制備骨植入物的首選材料,因為天然骨是由陶瓷(HAp,含量約占骨濕重的80%)和膠原蛋白組成。理想的生物陶瓷不僅應具有生物相容性,而且還應具有骨傳導性和骨誘導性,并且在使用過程中不會釋放有毒元素。
最初,生物惰性生物陶瓷以氧化鋯(ZrO2)和氧化鋁(Al2O3)為代表,用于生產全髖關節置換假體的股骨頭。后來,具有生物活性的陶瓷材料被開發出來,它們能夠與宿主骨組織形成牢固的化學作用結合力,并且不會引發炎癥。Ca-P基陶瓷,包括HAp、 TCP和生物玻璃,是眾所周知的骨替代材料。與 ZrO2和Al2O3相比,這些生物活性陶瓷的機械強度明顯較低,但顯示出更好的生物響應性、蛋白質產生能力和細胞黏附性(骨傳導)。Chen等綜述了2019年之前關于陶瓷的3D打印技術,主要包括基于漿料、粉末和本體固體的方法。
(三)金屬
金屬或其合金材料的3D打印常常通過SLM或電子束熔化(EBM)來實現。以下小節介紹了幾種用于生物植入物的常見金屬和合金(Ti基、SS和Co基)以及可生物降解的金屬(鎂基、鋅基和鐵基)。
1. 鈦基合金
Ti合金由于具有良好的生物相容性、低模量和耐腐蝕性而被用作生物材料。Ti-6Al-4V用于鎖骨植入物和下頜骨植入物的制造、足部截骨術(如帶凸緣的髖臼杯)以及其他病灶位置,如牙齒和髖關節植入物。但是,鋁(Al)和釩(V)元素的釋放會導致阿爾茨海默癥、骨軟化癥和其他神經系統疾病。目前,沒有釩摻雜的Ti-6Al-7Nb和Ti-5Al-2.5Fe已被制造出來并應用于股骨假體。為了改善Ti合金的耐磨性,通常需要在Ti合金中進行表面改性,并且添加難熔金屬元素。
2. 不銹鋼
奧氏體316L SS合金[含2%~3%的鉬(Mo)]是制造體內固定裝置(支架、骨板和人工關節)最常用的植入材料。因為316L SS不能促進新的組織生長,所以Hao等提出了一種包含316L SS和HAp生物陶瓷的組合材料,用于通過SLM技術制造承重和生物活性復合材料植入物。317L SS合金(含3%~4%的Mo)在點蝕和總體耐蝕性方面優于316L。為了減少骨植入物的細菌感染,Chai等研究了317L SS-Cu在體外和體內的生物相容性和抗菌活性。局部腐蝕效應會導致24% 的植入物失效,這是影響SS合金用作植入物材料性能的主要問題。可以利用表面改性、涂層和表面紋理改性(在納米級)等方法來增強SS的耐腐蝕性。
3. 鈷基合金
由Co、Cr、Ni和Mo組成的Co-Cr合金是骨植入物常用的生物材料。與SS相比,Co基合金具有更好的生物相容性、耐磨性、耐蝕性和機械強度。Co-Cr合金有兩種基本類型:Co-Cr-Mo合金和Co-Ni-Cr-Mo合金。Co-Cr-Mo合金已被用于牙科植入物和人工關節,其中合金元素含量為27%~30%的Co、2.5%的Ni和5%~7% 的Mo。Co-Ni-Cr-Mo合金已被用于重載關節(髖關節和膝關節),由19%~21%的Cr、33%~37%的Ni 和9%~11%的Mo組成。Xiang等通過EBM方法制造了具有各向異性組織和力學性能的Co-Cr-Mo合金。Co基合金的主要問題之一是生物腐蝕,因為它在與人體蛋白質或細胞結合的過程中會釋放帶正電荷的金屬離子。
4. 鎂基合金
純鎂的密度(1.74 g·cm–3)與天然骨骼密度(1.8~2.1 g·cm–3)相似。但是,它在人體內植入物的應用方面受限于鎂金屬快速的腐蝕性,該腐蝕會導致植入物的快速降解。如果研究人員可以控制鎂的腐蝕速率,則它可能是骨植入物的合適選擇,因為其彈性模量(45 GPa)與皮質骨相似,這將有效避免應力屏蔽效果。鎂合金(Mg-Zn基、Mg-Ca基、Mg-Si基和 Mg-Sr基合金)提供了控制純Mg腐蝕的良好解決方案,并且在組織工程、骨科和心血管領域顯示出巨大潛力。在生物植入物中,Al和稀土元素應避免與Mg形成合金,因為這兩種成分雖然可以提高機械強度,但它們分別會導致神經毒性和肝毒性。此外,在鎂合金的研究中,氫氣的生成是一個普遍存在的挑戰。作為替代材料,鎂玻璃可以用作植入物而不會形成氫氣。
5. 鋅基合金
由于具有良好的生物降解性和生物相容性,鋅基合金作為植入物材料具有巨大潛力。2013年,Bowen 等報道鋅是制造支架的優良候選材料。純鋅的鑄造極限抗拉強度為20 MPa,鍛造極限抗拉強度為120 MPa。但是,這不足以使其用于支架(血管支架至少需要300 MPa)。因此,金屬鋅需要與其他金屬結合形成適用于生物醫學的合金。一些文獻已經綜述了Zn-Mg、 Zn-Ca/Sr、Zn-Al、Zn-Li、Zn-Ag、Zn-Cu和Zn-Mn等合金體系。Zn-Cu合金在顱頜面部骨植入物中顯示出潛在的應用前景。Zn-P的合金界面為鋅植入物提供了關鍵的可控的生物相容性,并且可以作為具有前景的、化學性質穩定的涂層材料應用于其他生物醫學領域。
6. 鐵基合金
鐵及其合金不會促進氫氣的釋放,并且比鎂基合金具有更好的機械性能,是另一種可生物降解的金屬,可以用作心血管支架或骨植入物(因為其具有低溶血率和出色的抗凝特性)。純鐵的彈性模量(211.4 GPa)高于純鎂(41 GPa)或316L SS(190 GPa)。在臨床應用中,錳、碳(C)、硅和鈀(Pd)元素通常與鐵合金化,以提高純鐵材料的降解速率(在成骨環境中為0.16 mm·a–1)并降低其在臨床應用中的磁化率。當為鐵基合金設計開孔結構時,它們可以顯示出接近天然骨骼的機械性能。Li等通過直接金屬打印制備了具備打印有序多孔結構的鐵支架,并研究了它們的生物降解行為和機械性能。Hong 等通過3D打印制造了Fe-Mn和Fe-Mn-Ca基結構,發現添加鈣可以提高鐵的降解率。通常情況下,需要對鐵進行改性以改善表面生物活性,從而刺激新骨的形成。Yang等提出了一種基于水熱過程的HAp涂層方法來改進3D打印鐵支架,并展示了其在骨組織工程中的潛在應用。
7. 塊狀金屬玻璃
塊狀金屬玻璃(BMG)是一種強度約為2 GPa、彈性約為2%、楊氏模量約為50~100 GPa的金屬材料。由于獨特的無序原子結構,大塊金屬玻璃具有較高的耐磨性和耐腐蝕性。因此,塊狀金屬玻璃可作為一種新型植入物材料,其生物相容性優于結晶體。Zr44Ti11Cu10- Ni10Be25塊狀金屬玻璃表現出更好的細胞生長和附著支撐能力。具有微/納米圖案表面的Pt57.5Cu14.7Ni5.3P22.5 塊狀金屬玻璃顯示出增強的血管生成能力。
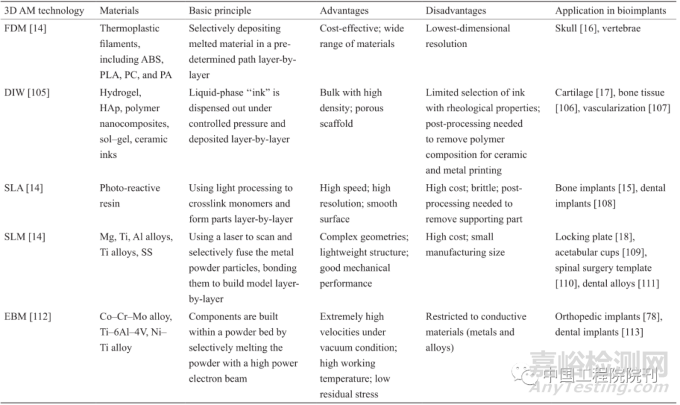
四、3D AM技術在生物植入中的應用
表1 總結了幾種常用于生物植入物制造的具有代表性的3D AM技術,以及它們的優點、局限性和當前的應用情況。
表1 幾種具有代表性的用于制造生物植入物的3D AM技術
1. 熔融沉積成型
FDM是一種常見的AM工藝,在此工藝中,聚合物在熔融和擠出后形成細絲。通常使用熱塑性聚合物,如聚碳酸酯(PC)、聚丙烯腈-丁二烯-苯乙烯(ABS)、聚己內酯、聚酰胺(PA)和聚乳酸(PLA)。由于聚氨酯具有良好的柔韌性和生物相容性,Zeng等利用FDM技術制備了聚氨酯人造耳廓。本實驗為實現耳廓重建以及減輕其他軟骨缺損提供了一條有效的途徑。Gronet等為兩名患者制作了丙烯酸植入物用以修復大面積或復雜顱骨缺損。Tan等為患者制備了個性化的丙烯酸顱骨植入物。該方法制備植入物的優點在于不需要化學后處理和低成本,而主要限制是產品的機械性能較差。
2. 直接墨水書寫
直接墨水書寫(DIW)是一種AM工藝,在該工藝中,材料的懸浮液或熔體以絲狀形式從機器中被擠出。DIW的材料來源豐富,包括水凝膠、陶瓷/金屬粉末混合聚合物的懸浮液以及熱塑性聚合物熔體。最近,一種基于熔體靜電紡絲的DIW方法被開發出來,該方法由于熔體在高壓電場下的拉伸而獲得較高的打印精度。與FDM類似,打印精度受壓力、工作臺移動速度和打印噴嘴直徑等因素的影響。對于陶瓷和金屬部件,需要進行后處理,以通過燒結或其他方法去除打印墨水中的聚合物成分。DIW方法已被應用于開發生物植入物,包括軟骨、骨組織和血管。
3. 立體平版印刷
SLA是最早的AM方法之一,于1986年發展起來。它使用紫外線(UV)在一層薄薄的光敏樹脂或單體溶液上引發聚合。單體通常含有丙烯酸或環氧基基團,可通過聚合反應形成長鏈聚合物。利用SLA方法已經開發出了骨科和牙科植入物。為了制備陶瓷基植入物,可以將陶瓷粉末分散在光敏樹脂中,然后通過后續的燒結處理去除聚合物。Winder和Bibb總結了SLA在口腔頜面修復術中的潛在應用,包括耳鼻修復、阻塞器和手術支架。后處理技術包括拋光、噴漆和打磨。SLA的優點是可以生產10 µm的高精度植入物,但其缺點是成本高和材料資源有限。
4. 選擇性激光熔化
在SLM過程中,激光將散落在床層中的粉末熔合在每一層的特定位置,以形成所設計的結構。對于純金屬粉末的SLM的加工,通常選用對金屬有高吸收性的激光束(一般為摻釹釔鋁石榴石,1.064 µm)或者短波長的光纖激光器(1.09 µm)。研究人員使用SLM技術為患者制造了第一個定制化的Ti-6Al-4V頜骨植入物。SLM的優點包括可使用材料的范圍廣泛,以及未使用顆粒的可回收。其缺點是打印精度取決于顆粒大小,并且打印環境為惰性氣體環境以防止顆粒氧化。SLM技術在生物植入物中的應用包括開發固定鋼板、髖臼杯、脊柱手術模板和牙科合金。
5. 電子束熔化
瑞典Arcam AB公司于1997年開發的EBM是一種基于粉末床的AM技術。它的處理過程與SLM類似。然而,EBM的熱源是電子束,而不是激光束。此外, EBM只用于制備金屬和合金,而SLM用于制備聚合物、金屬和陶瓷。EBM可以在真空條件下以極高的打印速度(最高可達105 m·s–1)工作。據報道,EBM可以制造Co-Cr-Mo合金、Ti-6Al-4V合金和Ni-Ti合金,用于骨科和牙科植入物。EBM一個顯著的優點是它所制造的部件的殘余應力水平比SLM低得多。
6. 3D 生物打印
與其他3D打印技術不同,3D生物打印使用生物墨水作為打印材料。生物墨水由生物材料、生物化學因子和活細胞組成。3D生物打印的核心挑戰是基于打印結構賦予其生物功能。根據工作原理的不同,3D生物打印方法可分為噴墨生物打印、微擠壓生物打印和激光輔助生物打印。理想的生物墨水對生物打印很重要,它應該滿足適當的機械強度、可控的凝膠過程、生物相容性等要求。研究人員可以閱讀一些關于3D生物打印的生物墨水相關的綜述。Kang等發明了一種集成組織-器官打印機系統,用于下頜骨、顱骨、耳軟骨和骨骼肌的潛在重建。Lee等提出了一種新的3D生物打印方法,以懸浮水凝膠的自由可逆包埋為支撐打印介質,并對人體心臟進行了不同尺度的打印。Grigoryan等基于SLA方法,使用光聚合水凝膠建立了血管內和多血管結構。3D生物打印技術雖然還沒有被真正應用于臨床,但已經顯示出蓬勃的發展前景。
7. 用于生物植入物的4D AM材料
在4D打印中,3D打印的材料自主且可編程地改變其結構或功能,以響應環境刺激,諸如應力、光、液體、溫度變化、磁場、氣體壓力、嵌入式電路或這些刺激的組合。2014年,通過將一根由多種材料制得的絲線折疊成字母“MIT”,首次展示了4D打印過程。到目前為止,已經開發了多種材料用于4D AM技術,包括聚合物、金屬和陶瓷。4D AM材料的變形能力可適用于動態而多樣的人體環境,如可用于藥物輸送和支架導入。然而,變形材料的響應速度和機械強度通常是實際應用中的關鍵制約因素。
Gladman等報道了一種由水凝膠復合材料制成的仿生4D打印系統,在該系統中,所嵌入的非溶脹纖維素纖維的取向,被精確地設計布局,以實現各向異性的溶脹行為。利用該系統,該研究設計并實現了具有混合高斯曲率的復雜形狀的整體結構。
另一種應用廣泛的 4D AM聚合物是形狀記憶聚合物(SMP)及其復合材料,它們具有變形大、多種刺激響應、生物相容性好、重量輕、成本低等優點。Ge等利用多材料打印技術開發了可打印活性復合材料。在彈性體基質中打印的SMP纖維可以驅動復合材料的變形行為,進而實現對折紙結構的熱-機械編程控制。Ding等設計了一種直接4D打印方法,將編程步驟集成到3D打印的過程中,制備出永久性編程形狀。Lin等將磁粉引入SMP基質中,實現了對4d打印的生物醫學設備的遠程控制。Huang等提出了一種由水凝膠和SMP組成的新型4D AM聚合物,該聚合物的超快數碼打印技術通過避開垂直方向的逐層打印和平面方向的逐線打印,克服了AM在速度上的限制。此外,關于3D打印形狀記憶合金(SMA)的一些工作,展示了開發4D AM金屬材料的潛力,包括使用黏結劑噴射打印方法的NiMn-Ga SMA和使用SLM方法的NiTi合金。在這些研究中,3D打印的SMA呈現出由溫度變化導致的馬氏體相變所產生的形狀記憶行為。
4D AM技術是隨著相關的4D AM材料的變形能力而發展起來的。各種材料和技術為設計和制造4D智能結構材料(如軟質機器人、受控夾爪、可編程形狀變化圖案等)提供了巨大的可能性。熱刺激是4D打印最常見和最容易獲得的刺激,已有大量熱響應4D材料被報道,包括水凝膠、SMA 和SMP。然而,相對較慢的響應速度限制了熱驅動4D打印技術的廣泛應用。
光驅動4D技術因其響應速度快、無線控制、精確聚焦和可持續發展等優點而備受關注。石墨烯和碳納米管基復合材料、液晶彈性體復合材料、SMP和水凝膠通常用于光驅動4D系統。一種光敏打印微型游泳機器人已被報道。濕度也可被用來驅動4D打印致動器的變形,Mao 等展示了一種在濕度刺激下形成的親水/疏水雙層膜,該膜在軟致動器中具有潛在的應用前景。磁場是 4D材料開發的另一個重要策略,原因是它們的精細控制和對生物體良好的生物相容性滿足了其在生物醫學和治療方面應用的前提條件。利用DIW可打印4D磁性蝶形結構和4D花狀磁致驅動器。各種受磁場控制的仿生4D結構,包括螺旋藻細胞、毛毛蟲、海星和水母等均已有報道。除了這些技術外,應力驅動、電驅動和氣體驅動等4D打印技術也有所研究。這些4D驅動技術最近取得了很大進步,然而,大多數現有的智能4D結構只對一個刺激做出響應,這限制了它們與環境的交互能力以及它們在多種環境刺激下的適應性。多種刺激響應型材料和技術的發展促進了新一代4D打印結構的發展,包括光熱雙響應水凝膠、電熱和電化學驅動材料、磁光/熱雙刺激驅動器、溫度-pH敏感熒光雙層驅動器和濕度-溫度-光三重響應水凝膠等。利用FDM技術可打印一種基于SMP和熱變色顏料的仿生形狀-顏色雙響應型4D復合材料。與此同時,4D AM技術仍然存在一些有待解決的問題,如光的波長限制和生物毒性、反應活性以及磁場的頻率控制等。
首套陶瓷4D打印系統是由我們團隊先前開發的。在這個系統中,彈性陶瓷前驅體經歷打印、變形,之后轉變成硬質陶瓷結構,如圖2所示。通過釋放可拉伸至超過200%應變長度的預應變陶瓷前驅體中儲存的彈性能,可實現陶瓷材料的變形。此外,在4D打印的彈性體衍生陶瓷(EDC)中實現了強度-尺度的協同效應。用這種方法可以打印從200 µm到幾十厘米的EDC多級結構,且該EDC結構在密度為1.6 g·cm–3時的抗壓強度可達547 MPa。
圖2 陶瓷4D打印系統。(a)DIW-變形-熱處理方法;(b)所打印的陶瓷前驅體微網格結構和兩種相應的EDC(從左到右);(c)所打印的陶瓷前驅體可拉伸至200%應變長度;(d)實現了強度-尺度協同效應。比例尺為1 cm。NC:納米復合材料。經作者許可,引自參考文獻
與其他4D AM聚合物和金屬材料相比,上述陶瓷 4D AM系統在高溫結構應用方面具備優勢,因為聚合物衍生陶瓷具有顯著的熱穩定性、化學穩定性和機械穩定性。陶瓷前驅體的DIW和熱處理過程比其他高熔點材料的4D AM系統更具成本效益,因為它在3D打印過程中不需要昂貴的激光能量,也不需要燒結高熔點材料的粉末以進行后處理。此外,墨水材料的開放式原料系統使得陶瓷4D AM系統可以擴展到多種材料和變形系統。目前陶瓷4D AM系統的缺點包括變形控制精度不高,因為變形系統依賴于自制的雙軸拉伸裝置。隨著新的變形機制和高精度加工技術的引入,變形編程控制的精度有望得到提高。
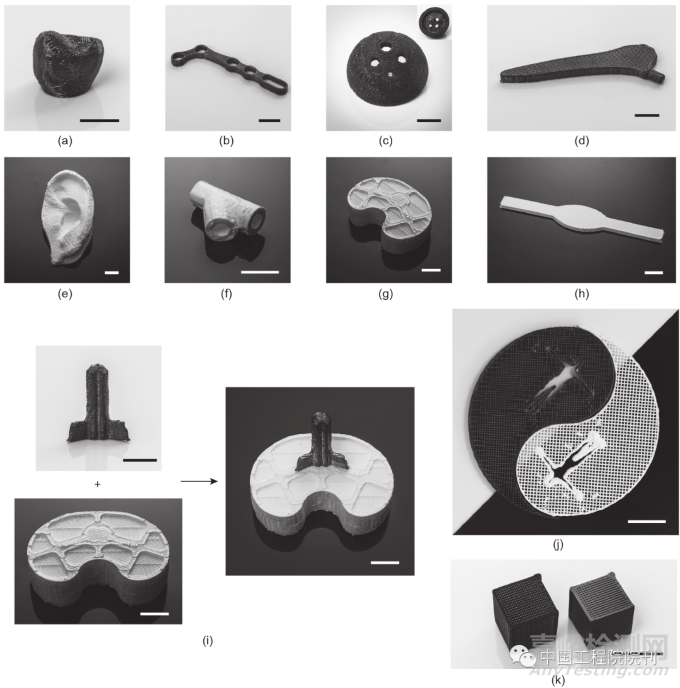
上述陶瓷4D打印的工作有望推動生物植入物AM領域的創新。利用陶瓷和陶瓷前驅體的可打印性,可以期待用陶瓷材料打印的硬質生物植入物,包括牙冠、鎖定板、髖臼杯和骨板[圖3(a)~(d)],以及用陶瓷前驅體材料打印的軟質生物植入物[圖3(e)~(h)],包括耳朵、氣管、半月板和韌帶[圖3(e)~(h)]。此外,因為用于打印陶瓷前驅體和陶瓷的“陶瓷墨水”可以將這兩種材料打印的部分黏接融合在一起,所以可以打印出同時具有軟質和硬質部分的生物植入物,從而形成同源的三明治結構[圖3(i)]。用于打印的墨水是由液體 PDMS(SE1700 clear,美國道康寧公司)與質量分數為 10%的ZrO2納米顆粒(中國通力微納科技有限公司)混合制成。陶瓷前驅體的3D打印是由基于DIW的3D打印機實現的。墨水沉積后,將形成的結構在150 ℃下后處理固化30 min。在氬氣(Ar)氣氛下,將陶瓷前驅體在 1300 ℃下加熱1 h可制得陶瓷。
圖3 用4D打印陶瓷前驅體/陶瓷材料開發的代表性生物植入物。所打印的由硬質陶瓷制成的牙冠(a)、鎖定板(b)、髖臼杯(c)和骨板(d)。所打印的由軟質陶瓷前驅體制成的外耳(e)、氣管(f)、半月板(g)和韌帶(h)。(i)以可打印的“陶瓷墨水”作為黏接劑,將打印的軟質和硬質生物植入物黏接融合在一起。(j)用白色/黑色陶瓷前驅體/陶瓷材料打印的太極陰陽符號,展示了人體內軟硬集成的生物結構。(k)所打印的未拋光(左)和拋光(右)的陶瓷網格結構的比較。比例尺為1 cm
此外,這些打印陶瓷可以達到34~547 MPa的抗壓強度和200%的拉伸應變。據相關報道,肌腱/ 韌帶和關節軟骨的極限拉伸應變分別為10%~15%和 60%~120%,而皮質骨組織和牙齒組織的壓縮強度分別為88~164 MPa和295 MPa。所有這些參數都在該材料的力學性能范圍內,這表明它在多種組織,特別是軟硬集成的生物植入物方面具有潛在的應用前景。
與太極中陰陽兩大基本元素之間剛柔并濟的哲學關系類似,人體中軟質和硬質的生物結構融為一體并一同發揮功能,從而以軟硬集成生物成分的形式實現全面平衡,如膝關節和脊椎(圖4)。圖3(j)為用白色/黑色陶瓷前驅體/陶瓷材料打印的太極陰陽符號,展示了人體內軟硬集成的生物結構。基于AM技術的軟硬集成結構材料將被廣泛應用于多種領域,包括仿生的超韌或具有優異性能的材料,以及驅動器。
圖4人體內軟質和硬質的生物結構融為一體并一同發揮功能,形成類似于太極陰陽剛柔并濟的全面平衡
打印結構的后處理可以獲得良好的機械性能或生物相容性。例如,對Ti合金中的3D打印部件進行表面機械納米化處理,可以在金屬表面上引入納米結構層,并極大地提高打印結構的抗疲勞強度。此外,通過拋光技術,可以制備出平均表面粗糙度(Ra)可達0.06 µm的打印陶瓷結構[圖3(k)]。
五、結論
目前有望將這種通過4D打印陶瓷前驅體/陶瓷材料實現的軟硬集成4D AM概念擴展到其他二元和多組元體系。在多材料打印和局部陶瓷化等其他技術的輔助下,可以制造出更多種具有功能梯度界面的軟硬集成結構。2D/3D/4D AM材料的組合可以為人體內復雜且動態的生物環境中生物植入物的開發帶來更多創新。
在未來的研究中,多材料打印將不僅包括打印主體材料之間的組合,還包括打印支撐材料和打印介質材料之間的組合。隨著不同模量材料的墨水系統的開發,仿生超韌雜化材料系統的AM將會被應用于結構材料,以克服強度和韌性不可兼得的普遍矛盾。多維度AM將推動打印維度從2D/3D/4D增加到更高維度,并促使打印策略從逐點/逐線/逐面/逐體的AM轉變到擁有更高維度基本元素的AM,從而實現高水平的結構自由度和打印效率。此外,減材制造等其他制造策略的引入,以及與適用于不同功能應用場景的打印材料的預編程、實時處理或后處理的集成,將為AM材料和技術的學術研究和工業應用提供廣闊的發展機會。
注:本文內容呈現略有調整,若需可查看原文。
改編原文:
Guo Liu, Yunhu He, Pengchao Liu, Zhou Chen, Xuliang Chen, Lei Wan, Ying Li, Jian Lu.Development of Bioimplants with 2D, 3D, and 4D Additive Manufacturing Materials[J].Engineering,2020,6(11):1232-1243.
作者介紹
呂堅,法國國家技術科學院(NATF)院士。
長期從事納米材料與先進材料的制備和力學性能、實驗力學、材料表面工程和仿真模擬、仿真模擬設計等研究。
本文選自中國工程院院刊《Engineering》2020年第11期
作者:劉果,何云虎,劉朋超,陳舟,陳緒梁,萬鐳,李瑩,呂堅
來源:Development of Bioimplants with 2D, 3D, and 4D Additive Manufacturing Materials[J].Engineering,2020,6(11):1232-1243.