1 研究背景
2015年2月,美國FDA批準(zhǔn)新型復(fù)方降糖藥物Glyxambi(恩格列凈/利格列汀)的上市申請,用于2型糖尿病成年患者的輔助治療。該藥也是目前美國唯一的一款SGLT2抑制劑(恩格列凈[empagliflozin],勃林格殷格翰)和DPP-4抑制劑(利格列汀[linagliptin],禮來)的復(fù)方藥物。
恩格列凈利格列汀片含有兩種活性成分:恩格列凈和利格列汀(Empagliflozin/Linagliptin)。
恩格列凈化學(xué)結(jié)構(gòu)如下:
利格列汀化學(xué)結(jié)構(gòu)如下:
為了解該復(fù)方制劑的降解途徑,確定處方中的降解產(chǎn)物歸屬;同時,驗(yàn)證有關(guān)物質(zhì)分析方法的專屬性,對該復(fù)方制劑進(jìn)行強(qiáng)制降解試驗(yàn)設(shè)計。
2 破壞試驗(yàn)前提
(1)處方工藝初步確定;(2)分析方法專屬性和靈敏度初步確定。
3 破壞樣品
需要同時對API(恩格列凈、利格列汀)、空白輔料、單方制劑(恩格列凈+空白輔料;利格列汀+空白輔料;可以按照復(fù)方制劑的工藝制備成片劑)和復(fù)方制劑(恩格列凈利格列汀片)四個層次六個平行進(jìn)行強(qiáng)制降解試驗(yàn),其目的為明確歸屬降解產(chǎn)物的歸屬途徑。
4 破壞條件
破壞條件的設(shè)計應(yīng)考慮藥物的生產(chǎn)、儲存、流通、使用等。
可采用較強(qiáng)的破壞強(qiáng)度(雜質(zhì)增加5%-10%),評估方法的檢測能力(專屬性得經(jīng)得起考驗(yàn),雜質(zhì)能基本覆蓋)。
藥物在研發(fā)、生產(chǎn)、使用過程中,如藥物溶出實(shí)驗(yàn)、工藝過程、服用過程均可能會接觸到酸、堿,故需進(jìn)行液體的酸、堿破壞;
藥物的檢測過程,均需配制成溶解狀態(tài)進(jìn)行,故需進(jìn)行溶液狀態(tài)的高溫、光照破壞,為供試品溶液配制方式提供基礎(chǔ)數(shù)據(jù)(是否需要避光、環(huán)境溫度是否需要控制等);
固體破壞是模擬大部分藥物的儲存條件,類似于影響因素實(shí)驗(yàn)(比加速試驗(yàn)更苛刻,所以也要考慮加速試驗(yàn)或長期試驗(yàn)條件下是否正式存在,如果有,則要重點(diǎn)研究)。
基于以上考慮涉及該復(fù)方制劑強(qiáng)制降解破壞條件如下:
上表待分析樣品采用相同的前處理?xiàng)l件:
稀釋劑為磷酸鹽溶液[取無水磷酸二氫鉀2.0g,加水1000ml使溶解,并用磷酸調(diào)節(jié)PH值至2.5±0.1]-乙腈(70:30);
整投法(常規(guī)操作為20片至于200ml量瓶,強(qiáng)制降解試驗(yàn)調(diào)整為2片至于20ml量瓶);
供試品溶液濃度分別為1mg/ml(恩格列凈)、0.5mg/ml(利格列汀);
超聲15min,再室溫振搖30min;
離心取上清液。
5 試驗(yàn)要求
以未破壞供試品溶液為對照計算破壞樣品的活性成分含量;扣除空白溶劑、空白輔料和另一成分及歸屬雜質(zhì)后,以面積歸一化法計算各活性成分的雜質(zhì)增加量。
要求:
(1)空白溶劑和各破壞空白輔料色譜圖中不得干擾恩格列凈、利格列汀及其已知雜質(zhì)測定;
(2)各降解條件下主成分與相鄰雜質(zhì)峰之間的分離度不得低于1.5;
(3)各降解條件下主成分色譜峰在210~400nm波長范圍內(nèi)純度因子不得低于980;
(4)物料守恒(恩格列凈和利格列汀含量下降值與其雜質(zhì)增加量的差值)保持在5%以內(nèi)。
6 試驗(yàn)結(jié)果(以酸破壞為例)
(1)典型色譜圖
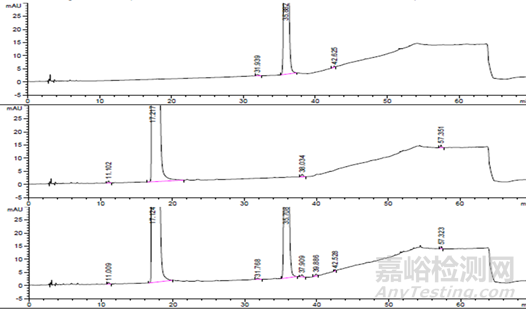
未破壞典型色譜圖
【1】 恩格列凈單方制劑未破壞樣品;
【2】 利格列汀片單方制劑未破壞樣品;
【3】 恩格列凈利格列汀復(fù)方制劑未破壞樣品
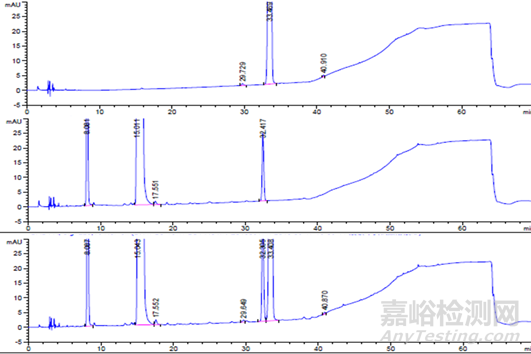
酸破壞典型色譜圖:
【4】 恩格列凈單方制劑酸破壞樣品;
【5】 利格列汀片單方制劑酸破壞樣品;
【6】 恩格列凈利格列汀復(fù)方制劑酸破壞樣品
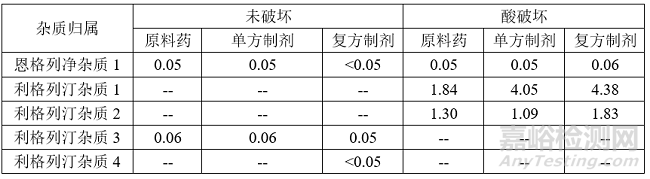
(2)主要降解雜質(zhì)歸屬
(3)方法專屬性考察注:上表復(fù)方制劑雜質(zhì)含量計算方式通過各原料和單方制劑降解雜質(zhì)歸屬后扣除另一主成分及另一成分降解雜質(zhì)后進(jìn)行面積歸一化。
(4)物料守恒(以酸破壞為例)
7 分析與討論(以酸破壞為例)
① 單一原料藥與單方制劑或復(fù)方制劑相同破壞條件下產(chǎn)生雜質(zhì)譜一致,但破壞程度存在差異,制劑降解趨勢比原料藥明顯(不是好消息,說明制劑工藝并未增加活性成分的穩(wěn)定性;但也可能是個無可奈何的消息,畢竟對于5mg/10mg的有效劑量,不可能直接服用原料藥,制劑的意義也要考慮賦型和服用方便);
② 各破壞條件下恩格列凈均未產(chǎn)生大于報告限度的雜質(zhì),恩格列凈性質(zhì)穩(wěn)定。因利格列汀在相同破壞條件下,可得到適當(dāng)?shù)慕到怆s質(zhì),故暫未設(shè)計針對恩格列凈的復(fù)合破壞條件;
③ 酸破壞條件下復(fù)方制劑中利格列汀可得到適當(dāng)?shù)慕到怆s質(zhì),在此條件下可降解雜質(zhì)達(dá)到6%,可作為本方法專屬性考察的主要強(qiáng)制降解條件;
④ 酸破壞條件下雜質(zhì)增加值與含量下降值差值不大于5.0%,滿足物料守恒要求,恩格列凈與相鄰雜質(zhì)峰之間分離度均大于1.5,且DAD檢測器掃描各強(qiáng)制降解溶液的峰純度均大于990;
⑤ 復(fù)方制劑利格列汀酸條件下的主要降解雜質(zhì),在加速長期穩(wěn)定性試驗(yàn)中均未檢出,故僅作為未知雜質(zhì)進(jìn)行研究(但作為口服固體制劑,考慮胃生理環(huán)境,仍建議進(jìn)行雜質(zhì)結(jié)構(gòu)鑒定,并對其進(jìn)行安全性評價)。
結(jié)論:在酸破壞條件下,復(fù)方制劑中的活性成分恩格列凈性質(zhì)穩(wěn)定,未發(fā)生明顯變化;利格列汀可產(chǎn)生明顯降解。有關(guān)物質(zhì)分析方法在酸破壞條件下能滿足質(zhì)量守恒的要求,主峰與相鄰峰之間分離度滿足要求,且峰純度均不低于980,顯示出良好的專屬性。