您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-11-15 10:55
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
國內藥訊
1.和黃VEGFR抑制劑胃癌Ⅲ期臨床積極。和黃醫藥VEGFR抑制劑呋喹替尼聯合紫杉醇二線治療晚期胃癌或胃食管結合部腺癌(GEJ)的中國Ⅲ期臨床FRUTIGA結果積極。與紫杉醇單藥相比,呋喹替尼聯合治療顯著改善患者的無進展生存期(PFS);但另一個主要終點總生存期(OS)未獲得統計學意義的改善。呋喹替尼的安全性與既往研究一致。詳細結果將在學術會議上發布。
2.康方PD-1/VEGF雙抗擬納入突破性療法。康方生物PD-1/VEGF雙抗AK112獲CDE擬納入突破性療法,聯合多西他賽治療既往PD-1/L1抑制劑和含鉑化療治療失敗的局部晚期或轉移性非小細胞肺癌。2022年9月和10月,AK112一線治療PD-L1表達陽性的局部晚期或轉移性非小細胞肺癌、聯合化療治療經表皮生長因子受體(EGFR)酪氨酸激酶抑制劑(TKI)耐藥的EGFR突變的局部晚期或轉移性非鱗非小細胞肺癌已被CDE納入突破性治療品種名單。
3.禮新GPRC5D靶向ADC獲批臨床。禮新藥業1類生物藥注射用LM-305獲國家藥監局臨床試驗默示許可,擬用于多發性骨髓瘤及其他漿細胞疾病的治療。LM-305是全球首個進入臨床開發階段的靶向GPRC5D抗體偶聯藥物,已于今年7月獲FDA臨床許可,開展評估用于治療多發性骨髓瘤的安全性、耐受性、藥代動力學和初步抗腫瘤活性的臨床研究。
4.北京爍星納米多抗國內報IND。北京爍星生物1類生物制品"SM3321注射液"臨床試驗申請獲CDE受理(受理號:CXSL2200572)。SM3321是該公司納米抗體發現平臺開發的首個創新藥物,也是全球首個腫瘤雙靶點及CD16A激動劑介導的納米多抗藥物。今年5月,SM3321已在美國獲FDA臨床許可,擬開發用于急性髓系白血病的治療。
5.邦耀生物完成數億元B輪融資。邦耀生物宣布完成逾2億元人民幣B輪融資。本輪融資由上海自貿區基金領投,東方富海、天士力資本、貝達基金、歌斐資產等跟投。此輪融資將用于推進細胞和基因藥物的轉化及落地。該公司擬用于治療輸血依賴型β-地中海貧血的項目(BRL-101自體造血干祖細胞注射液)已于今年8月獲批進入Ⅰ/Ⅱ期臨床;非病毒PD1定點整合CAR-T項目(BRL-201,靶向CD19非病毒PD1定點整合CAR-T細胞注射液)預計年內獲得IND批準。
國際藥訊
1.度普利尤單抗治療結節性癢診獲歐盟支持上市。歐洲藥品管理局(EMA)人用藥品委員會(CHMP)推薦批準賽諾菲與再生元共同開發的度普利尤單抗(Dupixent)新適應癥,用于治療中重度結節性癢疹成人患者。在兩項Ⅲ期試驗(PRIME和PRIME2)中,Dupixent與安慰劑相比,均達到主要和關鍵次要終點,顯著改善患者的瘙癢和皮膚損傷等癥狀。Dupixent也是全球首款用于結節性癢疹的治療藥物,FDA已于今年9月批準Dupixent用于該適應癥。
2.實體瘤創新TCR療法早期臨床數據積極。Adaptimmune公司靶向MAGE-A4的TCR細胞療法ADP-A2M4CD8用于治療多種實體瘤的Ⅰ期劑量遞增試驗SURPASS最新結果積極。在ESMO大會上報告的12周數據顯示,單劑ADP-A2M4CD8在接受過多種前期治療的晚期卵巢癌、尿路上皮癌和頭頸癌患者中達到44%的客觀緩解率(ORR)。最新數據顯示,ADP-A2M4CD8單次治療后,在上述3種患者中的ORR提升至52%,中位緩解期延長至約20周。值得一提的是,該療法最近已獲得FDA授予用于鉑耐藥卵巢癌的再生醫學高級療法認定。
3.galectin-3抑制劑重癥肝硬化早期臨床積極。Galecto公司小分子galectin-3抑制劑GB1211用于治療肝硬化的Ⅰb/Ⅱa期臨床結果積極。12周治療后,患者多種肝酶的水平顯著降低:ALT(p<0.0005)、AST(p<0.005)、GGT(p<0.05),ALP(p<0.09);生化肝功能標志物、靶點作用標志物、細胞凋亡和纖維化標志物均顯著改善。GB1211在Child-Pugh B級的失代償期肝硬化患者中表現出良好的耐受性。
4.Veru重癥新冠口服藥遭FDA專家委員會反對。FDA肺部-過敏藥物專家咨詢委員會(PADAC)以8:5的投票結果反對Veru公司重癥新冠口服藥Sabizabulin上市。Sabizabulin是一款小分子雙吲哚新型微管蛋白抑制劑,此前已在III期臨床中獲得積極結果,將患者的死亡風險相對降低55%(死亡率:45%vs20%,p=0.0029),且口服用藥耐受性良好。FDA認為Sabizabulin的安全性和有效性數據有限;需要在同一人群中再進行一項隨機對照臨床試驗。
5.Breye公司融資推進視網膜血管疾病療法開發。致力于開發創新口服療法用于視網膜血管疾病的Breye公司宣布獲得由諾和諾德和Sound Bioventures領投的400萬歐元種子輪融資。該公司主打化合物danegaptide是一款口服小分子藥物,通過靶向細胞間的間隙連接(gap junction)來維持血管結構的完整性,防止視力喪失。這款藥物已在用于治療心肌梗塞的臨床試驗中表現出良好的安全性。獲得的資金將用于推動danegaptide進入Ⅰb期臨床。
6.阿斯利康2022年Q3業績出爐。11月10日,阿斯利康公布Q3財報,2022前三季度公司總收入331億美元,同比增長37%。其中,腫瘤業務115億美元,同比增長24%;心血管、腎臟及代謝業務69億美元,同比增長19%;罕見病業務達到52億美元,同比增長10%。前三季度,阿斯利康中國區收入45.97億美元。具體產品方面,Tagrisso(奧希替尼)營收達到41.02億美元(+16%);Imfinzi(度伐利尤單抗)20.31億美元(+19%)、Lynparza(奧拉帕利)19.49億美元(+19%)、Calquence(阿卡替尼)14.69億美元(+77%)。
醫藥熱點
1.醫學博士出任北京市委書記。11月13日消息,中共中央決定:蔡奇同志不再兼任北京市委書記、常委、委員職務,尹力同志兼任北京市委委員、常委、書記。尹力同志不再兼任福建省委書記、常委、委員職務,周祖翼同志任福建省委委員、常委、書記。根據公開信息,尹力,男,漢族,1962年8月生,山東臨邑人,1983年6月加入中國共產黨,1987年9月參加工作,俄羅斯醫學科學院衛生經濟與衛生事業管理專業畢業,研究生學歷,醫學博士。
2.國際泌尿外科學會首迎中國籍主席。13日,浙江大學醫學院附屬第一醫院泌尿外科主任謝立平出任國際泌尿外科學會主席,這是該學會成立一百多年來,迎來的第一位中國籍負責人。謝立平在就職儀式上發表演講,他表示將竭盡全力積極履行主席的職責,希望將世界各地的泌尿科醫生匯聚在一起,互相學習,促進國際泌尿外科學會的進一步發展,建立國際泌尿科醫師命運共同體,共享未來。
3.金冬雁稱香港已達到0+0開放標準。香港大學生物醫學學院病毒學界金冬雁教授日前在鳳凰網撰文,提出近期香港疫情平穩,“已達到0+0開放標準!”。從9月26日起,香港實施0+3政策,即撤銷對入境人員的強制檢疫要求,只需3天醫學觀察的入境管理措施。金教授表示,0+3政策沒有帶來不可承受的新冠傳染風險,也沒有引起感染人數大幅上升;新冠毒株BA.5進一步減弱,香港已具備較強的由接種疫苗及自然感染所獲得的混合型群體免疫等條件。無論是新冠死亡率、變種的出現或對長新冠的擔心,都不足以拖慢香港邁向0+0的步伐。
評審動態
2. FDA新藥獲批情況(北美11月10日)
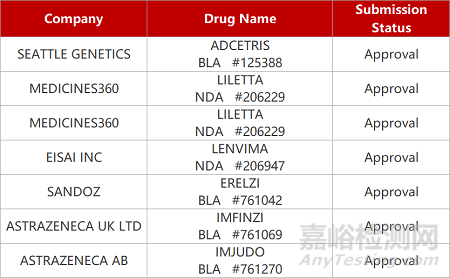

來源:藥研發


