您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-08-19 23:36
近年來,人工智能(Arti?cial Intelligence,AI)在醫療器械方面的應用快速發展,我國已批準肺炎CT影像分診、糖尿病視網膜病變眼底圖像篩查、肺結節CT影像檢測、心電圖分析診斷、顱內出血CT影像分診等方面的人工智能注冊證近三十款。
在心電信號方面,有更多研究將人工智能技術應用于心電圖分析診斷。《柳葉刀》曾報道了使用卷積神經網絡算法的人工智能心電圖儀,產品對180922名患者的649931份心電圖進行房顫分析,其靈敏度為79.0%,特異性為79.5%,總體準確率為79.4%。國內也有AI心電產品對13949份心律失常臨床進行分析,診斷17類心律失常事件的綜合靈敏性、特異性和準確率分別為98.08%、99.84%和 99.84%。我國2018年心血管病現患人數約3.30億。2020年心血管病住院患者院內病死率約是全因住院病死率的2倍。心血管病高患病率和高致死率預示著心電圖診斷龐大的市場,人工智能心電產品值得更多的投入與研究。
01心電產品國內上市情況及發展趨勢
據不完全統計,截止2022年3月13日,國內已注冊心電產品(不含監護儀)約 558 個,包括心電電極 96個、心電圖機170個、動態心電記錄儀165個、心電軟件73個、單導心電產品30個,具體分布圖見圖 1。
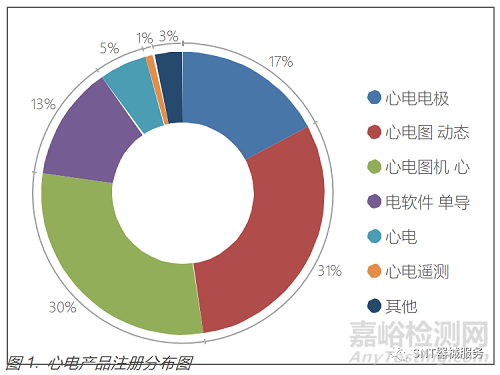
心電產品(不包括心電電極)主要分布在廣東、北京、江蘇、上海、浙江、湖南等醫療器械大省(市)(見圖 2)。進 口心電產品約79個,心電電極 32 個。從企業申報注冊產品看,心電產品的發展趨勢為可穿戴(使用方便、舒適),微 型化(產品便攜、體積小、重量輕),家用化(在日常生活中與智能手機聯合使用,智能化(通過云計算、大數據、人工智能等技術進行篩查、自動分析)。

心電生產廠家數量繁多、產品設計各有特點,心電數據 存儲格式多樣、記錄時間長短不一、采樣率因廠家而異、標注方式方法不盡相同,為心電數據庫的建立帶來巨大的挑戰。國內已上市三款AI心電產品(國械注準 20203070658、 國械注準 20203210080、國械注準 20213070059),部分企業也在陸續申報注冊。AI心電產品注冊過程還需要時刻關注法規變化。
02產品監管信息要求
根據《人工智能醫用軟件產品分類界定指導原則》,人工智能心電軟件產品用于心律失常、心肌梗死、心室肥大等疾病的輔助診斷,應屬于第三類醫療器械,需向國家藥監局申報注冊。產品名稱應為通用名稱,采用人工智能技術的產品宜使用輔助決策、輔助診斷、輔助檢測、輔助分析等詞語,建議命名為心電圖輔助決策軟件、動態心電圖輔助決策軟件、動態心電圖輔助分析軟件等。
注冊證結構組成包括物理組成(如光盤、網絡下載)和邏輯組成,功能模塊需相應體現人工智能(如深度學習)字樣,如深度學習心電分析模塊。對于適用范圍,需要體現心電數據類型,如靜態心電圖、動態心電圖、單導心電圖;使用人群,如成人、小兒、新生兒;核心臨床功能,如心律失常、心肌缺血、ST-T異常分析;使用限制,如專業醫生使用、分析結果僅作為診斷參考、分析結果不能單獨用作臨床診療決策依據等。
03產品性能研究
人工智能心電軟件的產品技術要求基本思路可按照常規心電分析軟件的指標進行編寫,表 1 按《醫療器械軟件注冊審查指導原則》的模板列舉人工智能心電分析軟件性能指標的基本實例。建議在此基礎上增加對人工智能算法準確性以及網絡安全方面的指標。
現階段,我國人工智能醫療器械標準化技術歸口單位正在起草《人工智能醫療器械質量要求和評價》系列標準,現已完成術語、數據集通用要求、數據標注通用要求共3部分人工智能醫療器械標準的制定工作,生產企業可持續關注標準的發布實施。對于人工智能心電軟件產品,有條件的企業,可制定相應的團體標準,以明確產品性能指標和算法性能測試方法。

04軟件研究資料要求
軟件研究資料包括基本的醫療器械軟件研究資料(醫療器械軟件描述文檔)、網絡安全研究報告(網絡安全描述文檔)、云計算服務研究資料。核心功能需明確人工智能 算法的算法名稱、類型(公認成熟、全新算法)、臨床功能 以及算法的出處(如文獻)。
人工智能心電軟件所涉及的算法一般包括心電波形處理、QRS 檢測、AI 心搏分類算法等。算法研究資料的要求見《人工智能醫療器械注冊審查指導原則》第六章,人工智能心電算法建議以算法為單位提交算法研究資料。現有應用廣泛、權威的心電數據庫包括 MIT- BIH、AHA、NST、CU、CES 數據庫等,該類數據庫也是心 電標準YY0782-2010和YY0885-2013中引用的用于驗證性能的數據庫。以上公開數據庫,經必要評估或必要處理后,能用于AI心電軟件的,可用于算法性能評估。對于軟件確認測試的數據庫,需要使用國內人群的心電數據,如國內第三 方數據庫作為測評數據庫。企業有必要說明測評數據庫的充分性、適宜性和有效性。
05臨床評價要求
輔助分析和診斷功能的心電圖機、自動分析診斷功能的動態心電圖記錄儀,均不屬于免于臨床評價醫療器械目錄的產品,需要提交臨床評價資料。對于自動分析診斷功能的心電圖,可在驗證標準數據庫的基礎上,提供算法驗證的研究資料,重點關注心電數據的來源,數據收集應考慮數據來源的合規性和多樣性、目標疾病流行病學特征(與申報的適用范圍匹配)、數據質量控制要求。
申報人工智能產品的,企業有必要說明AI算法與原有自動分析診斷算法的區別。如原有自動分析算法是基于臨床試驗或有足夠的臨床文獻 / 使用數據,可考慮通過同品種醫療器械的方式,與原有分析診斷功能的心電圖設備進行臨床評價。對于算法的差異,可通過自建數據庫的方式驗證算法的準確性,以證明產品的算法是可靠的、有效的。如AI算法是全新算法,或者申報企業未有上市的自動分析診斷設備,有必要開展臨床試驗,臨床試驗可考慮回顧性研究。
06小結
心電產品發展迅速,應用廣泛,監管部門有必要發布有關人工智能心電方面的標準、審評要點、指導原則,為審評和注冊申報提供指導;審評部門需跟蹤 FDA、歐盟、日本等國家有關人工智能心電的政策動態及人工智能心電產品獲批情況,及時更新審評關注點,加強專業水平的提高。
人工智能心電生產廠家在申報人工智能心電分析軟件產品時,生產企業要定位好產品的適用范圍,制定好符合產品特點的性能指標,并提供包括數據庫建立、算法驗證等方面的研究資料,基于人工智能算法的成熟度以及國內人工智能心電產品注冊現狀選擇合理的評價路徑,在保證安全性、有效性的前提下,縮短注冊周期,早日獲批上市。

來源:廣東省藥監局審評認證中


