您當(dāng)前的位置:檢測(cè)資訊 > 科研開(kāi)發(fā)
嘉峪檢測(cè)網(wǎng) 2022-06-10 11:32
更多醫(yī)藥技術(shù)資訊,請(qǐng)點(diǎn)擊醫(yī)藥專欄:http://drug.anytesting.com/ 歡迎關(guān)注文末微信公眾號(hào):藥研檢測(cè)drugtest
今日頭條
甘萊FXR激動(dòng)劑獲批膽管炎臨床。歌禮旗下甘萊制藥FXR激動(dòng)劑ASC42獲FDA批準(zhǔn),即將開(kāi)展一項(xiàng)用于治療原發(fā)性膽汁性膽管炎的關(guān)鍵性藥物-藥物相互作用(DDI)研究,以支持后續(xù)在中國(guó)、美國(guó)和歐盟開(kāi)展III期臨床。I期臨床數(shù)據(jù)顯示,ASC42(15mg)治療14天后,受試者的低密度脂蛋白膽固醇維持在正常水平且未觀察到出現(xiàn)瘙癢癥狀;而且FXR靶向激活的生物標(biāo)志物FGF19增幅高達(dá)1,780%。
國(guó)內(nèi)藥訊
1.復(fù)宏漢霖PD-1肺癌III期臨床積極。復(fù)宏漢霖PD-1斯魯利單抗(漢斯?fàn)?reg;)在ASCO2022年會(huì)上公布一線治療廣泛期小細(xì)胞肺癌(ES-SCLC)的國(guó)際III期臨床(ASTRUM-005)研究成果。中位隨訪為12.3個(gè)月,斯魯利單抗組和安慰劑組的中位OS分別為15.4個(gè)月(95% CI 13.3–NE)和10.9個(gè)月(95% CI 10.0–14.3),風(fēng)險(xiǎn)比(HR)為0.63(95% CI 0.49–0.82,p<0.001);兩組兩年總生存率分別為43.1%和7.9%,IRRC評(píng)估的中位PFS分別為5.7和4.3個(gè)月(HR 0.48,95% CI 0.38–0.59)。
2.綠葉抗抑郁新藥Ⅲ期臨床積極。綠葉制藥三重再攝取抑制劑新藥LY03005在APA2022年會(huì)上發(fā)布用于治療抑郁癥的Ⅲ期研究成果。數(shù)據(jù)顯示,LY03005(80mg、160mg)兩個(gè)劑量組8周末的MADRS(蒙哥馬利-艾斯伯格抑郁量表)總分較基線的變化值均優(yōu)于安慰劑組,兩組較安慰劑組的LSM差值分別為-5.46和-5.06,均具有統(tǒng)計(jì)學(xué)意義。LY03005組的HAM-D17評(píng)分、MADRS有效率(79.9%和73.9%)和MADRS緩解率(51.6%和52.2%)均顯著優(yōu)于安慰劑組。此外,LY03005耐受良好,不影響性功能。
3.嘉葆藥銀抗腫瘤新藥獲批臨床。上海嘉葆藥銀公司小分子1類新藥JDB383片獲CDE臨床試驗(yàn)?zāi)驹S可,擬用于腱鞘巨細(xì)胞瘤的治療。JDB383是一款集落刺激因子(CSF1R)抑制劑,CSF1(二聚體糖蛋白)主要存在于骨髓腔內(nèi),負(fù)責(zé)巨噬細(xì)胞的生長(zhǎng)、增殖和分化等細(xì)胞過(guò)程。JDB383經(jīng)臨床前人源化PDX模型驗(yàn)證藥效顯著,并呈劑量依賴性增長(zhǎng)。
4.復(fù)旦張江抗體偶聯(lián)劑報(bào)IND。上海復(fù)旦張江注射用FDA022抗體偶聯(lián)劑的臨床試驗(yàn)申請(qǐng)獲CDE受理。注射用FDA022抗體偶聯(lián)劑是由針對(duì)人表皮生長(zhǎng)因子受體2(HER2)靶點(diǎn)的單抗與BB05偶聯(lián)組成。該藥物通過(guò)與HER2表達(dá)的腫瘤細(xì)胞結(jié)合并內(nèi)吞,在溶酶體內(nèi)通過(guò)蛋白酶剪切定向釋放小分子細(xì)胞毒藥物,殺傷腫瘤細(xì)胞。該藥物擬開(kāi)發(fā)用于治療HER2陽(yáng)性的乳腺癌、胃癌、肺癌和結(jié)直腸癌等晚期實(shí)體瘤。
5.百暨基因CLL-1 CAR-T報(bào)IND。百暨基因自體抗CLL-1嵌合抗原受體T細(xì)胞注射液的臨床試驗(yàn)申請(qǐng)獲CDE受理。CLL-1是極具藥物開(kāi)發(fā)潛力的靶點(diǎn)之一,它通常高表達(dá)在兒童急性髓系白血病(AML)細(xì)胞和白血病干細(xì)胞LSCs上。ASCO2021年會(huì)上的一項(xiàng)臨床數(shù)據(jù)顯示,該新藥在AML患者中達(dá)到82%的緩解率(ORR),完全緩解率(CR)達(dá)到73%。臨床中,患者僅有1-2級(jí)細(xì)胞因子釋放綜合征,沒(méi)有明顯的神經(jīng)毒性綜合癥。
6.普眾發(fā)現(xiàn)CDH6-ADC海外授權(quán)。昂闊醫(yī)藥與普眾發(fā)現(xiàn)就后者臨床前期的CDH6靶向抗體藥物偶聯(lián)物(ADC)AMT-707(CUSP06)達(dá)成合作許可協(xié)議。在臨床前研究中,CUSP06已在幾種CDH6高表達(dá)和低表達(dá)的體內(nèi)癌癥模型中顯示出良好的抗腫瘤活性。根據(jù)協(xié)議,普眾發(fā)現(xiàn)將獲得預(yù)付款,開(kāi)發(fā)、注冊(cè)和銷售里程碑潛在付款以及分級(jí)特許權(quán)使用費(fèi);昂闊醫(yī)藥獲得在大中華區(qū)以外的全球范圍內(nèi)獨(dú)家開(kāi)發(fā)和商業(yè)化CUSP06的權(quán)利。
國(guó)際藥訊
1.全球首個(gè)CD20/CD3雙抗獲批上市。歐盟委員會(huì)有條件批準(zhǔn)羅氏CD20/CD3 T細(xì)胞銜接雙特異性抗體Lunsumio(mosunetuzumab)上市,用于治療至少兩種前期系統(tǒng)治療的復(fù)發(fā)/難治性濾泡性淋巴瘤。這是全球首個(gè)CD20/CD3雙抗獲批上市,為這類患者提供一種無(wú)化療、現(xiàn)貨型的新免疫治療選擇。在一項(xiàng)Ⅰ/Ⅱ期臨床GO2978中,中位隨訪為18.3個(gè)月時(shí),中位緩解持續(xù)時(shí)間為22.8個(gè)月,完全緩解率為60%,客觀緩解率為80%。
2.Veru新冠口服藥向FDA報(bào)EUA。Veru公司宣布,已向FDA提交口服微管蛋白抑制劑sabizabulin(bisindole)的緊急使用授權(quán)申請(qǐng)(EUA),用于治療中重度新冠住院患者。今年4月,Sabizabulin已在III期臨床中獲得積極結(jié)果,將患者的死亡風(fēng)險(xiǎn)相對(duì)降低55%(死亡率:45%vs20%,p=0.0029);而且口服Sabizabulin的耐受性良好。除新冠外,該藥還被開(kāi)發(fā)用于治療去勢(shì)抵抗前列腺癌、三陰性乳腺癌等。
3.羅氟司特泡沫劑脂溢性皮炎III期臨床成功。Arcutis公司羅氟司特外用泡沫配方ARQ-154用于治療中重度脂溢性皮炎的關(guān)鍵III期STRATUM研究達(dá)主要終點(diǎn)。與接受空白基質(zhì)治療相比,ARQ-154治療達(dá)到IGA評(píng)分(皮膚癥狀“全部清除”或“幾乎全部清除”以及較基線至少提高2級(jí))的患者比例顯著更高(80.1%vs59.2%,P<0.0001)。在包括瘙癢、脫屑和發(fā)紅(紅斑)等關(guān)鍵次要終點(diǎn)也具有顯著改善。ARQ-154總體耐受性良好。
4.FIC干眼癥療法Ⅲ期臨床成功。Aldeyra公司潛在“first-in-class”的小分子RASP抑制劑reproxalap,在治療干眼癥的Ⅲ期臨床試驗(yàn)TRANQUILITY-2中達(dá)到主要終點(diǎn)。reproxalap旨在通過(guò)降低RASP(促炎性活性醛類物質(zhì))水平以達(dá)到抑制炎癥緩解癥狀的作用。試驗(yàn)結(jié)果顯示,接受一天給藥后,reproxalap在Schirmer測(cè)試結(jié)果和≥10mm Schirmer測(cè)試應(yīng)答者比例上均顯著優(yōu)于載體。Aldeyra計(jì)劃在近期向FDA遞交新藥申請(qǐng)。
5.現(xiàn)貨型CAR-T淋巴瘤臨床積極。Precision BioSciences公司基于ARCUS基因編輯的同種異體CAR-T療法PBCAR0191,在治療彌漫性大B細(xì)胞淋巴瘤((DLBCL)經(jīng)治患者的臨床試驗(yàn)中獲積極結(jié)果。最新數(shù)據(jù)顯示,在11例接受自體CAR-T治療后復(fù)發(fā)的患者中,該藥達(dá)到100%的客觀緩解率和73%的完全緩解率。在可評(píng)估緩解持續(xù)時(shí)間的6例患者中,3例患者的緩解持續(xù)時(shí)間超過(guò)6個(gè)月。
6.APOL1靶向療法獲FDA突破性療法認(rèn)定。FDA授予Vertex公司APOL1抑制劑inaxaplin(VX-147)突破性療法認(rèn)定,用于治療APOL1介導(dǎo)的局灶節(jié)段性腎小球硬化患者。在一項(xiàng)Ⅱ期臨床中,inaxaplin聯(lián)合標(biāo)準(zhǔn)治療顯著降低患者的尿蛋白/肌酐比值,治療13周后平均降幅為47.6%(95% CI:-60.0%,-31.3%)。歐盟藥品管理局也于近期授予該療法PRIME藥品認(rèn)定,用于治療APOL1介導(dǎo)的慢性腎病。
醫(yī)藥熱點(diǎn)
1.美國(guó)新冠再感染病例數(shù)超160萬(wàn)。美國(guó)廣播公司8日?qǐng)?bào)道,根據(jù)對(duì)美國(guó)多州提供數(shù)據(jù)的分析和匯編,全美24個(gè)州已報(bào)告了160多萬(wàn)例新冠再感染病例。其中,紐約州、緬因州和加利福尼亞州分別報(bào)告了超過(guò)20萬(wàn)例新冠再感染病例。數(shù)據(jù)統(tǒng)計(jì)還顯示,越來(lái)越多的人二次感染新冠病毒,有些人是三次、四次感染,有人甚至五次感染新冠病毒。
2.復(fù)旦大學(xué)位列香港認(rèn)可醫(yī)學(xué)資格名單。6月8日,香港特區(qū)政府衛(wèi)生署署長(zhǎng)根據(jù)《醫(yī)生注冊(cè)條例》公布第二批涵蓋23項(xiàng)獲特別注冊(cè)委員會(huì)(委員會(huì))認(rèn)可醫(yī)學(xué)資格的名單,當(dāng)中包括上海復(fù)旦大學(xué),是首次有內(nèi)地大學(xué)列入名單之中。復(fù)旦大學(xué)獲批的相關(guān)醫(yī)學(xué)資格是內(nèi)外全科醫(yī)學(xué)士的6年制醫(yī)學(xué)課程。第二批名單中,還包括來(lái)自澳洲、加拿大、南非、英國(guó)及美國(guó)等頒授醫(yī)學(xué)資格的團(tuán)體。
3.2021年全國(guó)醫(yī)保事業(yè)發(fā)展統(tǒng)計(jì)公報(bào)發(fā)布。國(guó)家醫(yī)保局日前發(fā)布《2021年全國(guó)醫(yī)療保障事業(yè)發(fā)展統(tǒng)計(jì)公報(bào)》。截至2021年底,全國(guó)基本醫(yī)療保險(xiǎn)參保人數(shù)136297萬(wàn)人,參保率穩(wěn)定在95%以上。2021年,全國(guó)基本醫(yī)療保險(xiǎn)(含生育保險(xiǎn))基金總收入28727.58億元,比上年增長(zhǎng)15.6%;全國(guó)基本醫(yī)療保險(xiǎn)(含生育保險(xiǎn))基金總支出24043.10億元,比上年增長(zhǎng)14.3%;全國(guó)基本醫(yī)療保險(xiǎn)(含生育保險(xiǎn))基金當(dāng)期結(jié)存4684.48億元,累計(jì)結(jié)存36156.30億元,其中,職工基本醫(yī)療保險(xiǎn)個(gè)人賬戶累計(jì)結(jié)存11753.98億元。
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(06月09日)
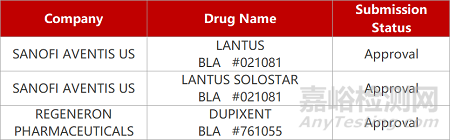
2. FDA新藥獲批情況(北美06月07日)

來(lái)源:藥研發(fā)


