您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-05-20 06:05
摘要:本文闡述了《中國藥典》2020年版新增通則“生物制品病毒安全性控制”的原則和框架起草考量以及該通則的作用、地位和意義。
關鍵詞:生物制品;病毒安全性;病毒污染;核心理念;病毒安全性評價;《中國藥典》2020年版
Viral safety control of biologics
Abstract:This article describes the drafting considerations on principles and framework of the new General Requirement “viral safety control of biologics” in the Chinese Pharmacopoeia 2020, as well as the role, status and significance of the General Requirement.
Key words: biotechnology or biological products; viral safety; viral contamination; core concept; viral safety evaluation; Chinese Pharmacopoeia 2020
生物制品來源多涉及活的生物體,制備過程使用的各種原輔材料亦來源復雜,且制品組分一般不能采用苛刻的終端理化處理。這些特殊性使外源因子特別是潛在的病毒污染成為生物制品質量控制中的挑戰[1]。近年來,人與自然環境相互作用愈加密切,動物病毒向人類溢出的風險日益嚴峻,重大公共衛生威脅事件時有發生[2-5],SARSCoV2大流行疫情更是成為人類歷史上最嚴重的公共衛生威脅[6]。這種背景下,業界和公眾對病毒安全性關注越來越高。生物制品存在較高的病毒污染潛在風險,曾報道多種生物制品制備過程中出現病毒污染事件[7-10],這種污染風險即使未產生臨床上的嚴重后果,但對于藥物的供應特別是罕見病藥物的供應,影響巨大[11],還可能危及相應生物制品的工藝以及廠區其他產品的質量和安全,公眾對生物技術產業的信心也會受到損害。隨著生物技術的蓬勃發展,生物制品使用人群不斷擴大,多種有治療前景的新興療法推向臨床應用,新的工藝理念和方法不斷涌現[12],因此,生物制品的病毒安全性控制需要不斷改進和完善[13-14]。另外,現今的檢測技術在“快、準、全”的理念指導下呈現快速發展[15-16],對于新技術特別是基于核酸檢測技術的成熟應用,外源因子得到更加方便快捷的識別,在很大程度上推動新的理念發展[17-19]。生物制品申請臨床、上市以及上市后病毒安全性控制評估的需求也日益增加[20]。所有這些新的認識和新的技術發展也在一定程度上促進/推動新的生物制品病毒安全性控制法規出臺。目前,國際上歐美日以及人用藥品注冊技術要求協調會(ICH)對生物制品病毒安全性均具有或正在更新相關技術要求[13, 21-23],我國藥典起草病毒安全性控制的技術標準和要求十分必要,對于保證藥品的安全和有效生產具有重要的意義。
1 生物制品病毒安全性控制法規的基本理念及發展
20世紀,一些疫苗產品在生產過程中發生有害病毒污染(如脊髓灰質炎病毒疫苗的SV40污染),相當長一段時間內其對人群健康的影響不完全清楚;20世紀80年代初,血液制品曾遭到諸如人類免疫缺陷病毒(HIV)等經血源傳播病毒的污染而導致接受污染制品治療的患者感染。這些病毒安全性風險導致公眾對行業安全生產的能力產生懷疑[10]。從那時起,治療性蛋白類制品的研發生產逐步轉向對病毒安全可控性較強的重組DNA技術。但重組細胞的培養也同樣易受到外源性因子的污染。為了確保血液制品、疫苗和重組產品等的病毒安全性,世界各國際組織及ICH和國家監管機構制定并實施了盡可能杜絕病毒污染風險的安全策略,發布了一系列指導原則/藥典要求[1,14,22-23]。雖然各法規之間存在適用范圍和具體表述的差異,但其核心理念高度一致。也是本版藥典通則“生物制品病毒安全性控制”所需遵循的核心理念[1]:在風險評估的基礎上,進行原材料/基質的來源控制、生產過程中適當階段產品測試(包括純化前、中間材料、以及成品階段)及病毒清除工藝評估/驗證。生物制品病毒安全性控制以風險評估為基礎,進行來源控制,生產過程控制及檢測,以及清除工藝評估/驗證(圖1A)。
過去的經驗教訓,促成了目前病毒安全性控制的最佳實踐,這依賴于病毒安全性控制策略,評估和降低病毒污染風險的三條互補的原則:預防(來源控制:選擇合適的起始材料和原材料,使其最大限度控制外來病毒的風險)、檢測(生產過程中適當步驟產品的測試,以確認它們沒有可檢測的病毒)、清除(病毒清除工藝的評估:在制備工藝中,加入去除和滅活潛在內/外源性病毒的步驟,以確保產品無污染可感染的潛在內外源病毒)(圖1B)。通過理念指導下的實踐,保障了多種生物制品數十年年的安全使用,使用重組DNA技術生產的治療性蛋白至今沒有出現將污染病毒傳播給患者的案例,保持著優良的病毒安全記錄[10]。
國內外各技術要求或指導原則具有較高的科學性、規范性及嚴謹性,特別是ICH Q5A,但也存在適用范圍窄,框架不夠簡明,核心理念不突出等問題。對于擴大范圍的生物制品,亦缺少明確統一的參考指南,即使是相對品種適用范圍較寬的日本藥典收載的指南,也未將血液制品和疫苗等制品的病毒安全性控制納入其中,更不論有治療前景的新興療法所涉的制品/制劑[21,23]。另外,近年來生物技術、檢測技術、工藝理念等方面均進展迅速,已有的技術要求或指導原則對于一些新的技術和理念,如新型細胞基質、新興分析技術(下一代測序技術,NGS)、新型工藝理念(連續制造,通用制備工藝/模塊化工藝步驟病毒驗證,病毒樣顆粒替代病毒)等,缺乏支持或不能有效適用已有的相應指南/規范[1,24-25]。這就要求我們更新病毒安全性控制理念,與時俱進,在新的理念要求下,根據實際情況實施安全性控制措施,最終保障穩健地生產安全的高質量產品。

2 通則“生物制品病毒安全性控制”遵循的基本原則
美國、歐盟、日本均將病毒安全性控制內容納入到相應藥典。《中華人民共和國藥典》(簡稱《中國藥典》)2020年版之前尚無系統的、通用的病毒安全性控制技術要求。鑒于《中國藥典》在我國醫藥行業的法定權威地位,結合生物制品病毒安全性控制核心理念及理念發展趨勢。2020年版藥典建立和收載能適應研究、生產、監管要求的病毒安全性控制原則勢在必行。
2.1 風險評估原則
生物制品的一個共同特點是存在病毒污染的風險性,這種污染在臨床上可產生嚴重的后果。污染可來自起始原材料本身,也可來自生產過程中偶然帶入的外源病毒。對于潛在的病毒污染源,首先應根據可能的污染風險進行風險評估。通過風險評估,可以達到早期預防早期發現及采取措施的目的。
綜合生物制品病毒安全性控制主要的法規要求,病毒安全性控制的核心理念亦建立在風險評估的基礎上[1]。不同類型的生物制品在來源、潛在污染病毒的特性、制備工藝等方面的不同,導致其病毒安全性風險大小存在差異,對于潛在的病毒污染源和可能的污染途徑,進行風險剖析及評估,找出風險點,以便根據評估結果實施病毒安全性控制策略。依據控制策略實施生物制品病毒安全性控制的措施,可以為制品的病毒安全性架起多道防線,最終確保生物制品的病毒安全性底線。強調風險評估的重要性,也是針對不同品種品類生物制品的病毒安全性,采取不同的具體措施來架設防線,做到安全和資源的平衡。
盡管生物制品病毒污染會造成破壞性后果,但有效地從以前的污染事件中吸取教訓仍然是一項挑戰。通過風險評估的理念進行風險識別、風險評價以及相應的風險降低措施實施,可以應對這一挑戰。因此,生物制品的病毒安全性控制要求,應建立在風險評估的基礎上結合產品特點綜合考慮。
2.2 全過程控制原則
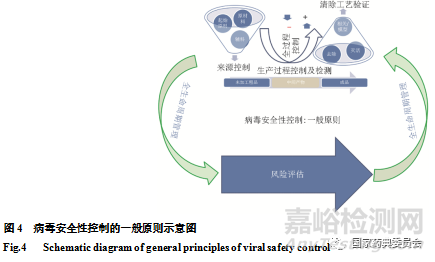
生物制品病毒安全性控制核心理念中“原材料/基質的來源控制、生產過程中適當階段產品測試(包括純化前、中間材料、以及成品階段)及病毒清除工藝評估”涉及產品生產的全過程,可使用外源性因子綜合控制策略(圖2 A)將病毒安全性控制納入產品制備的全過程[1,26],和毒性物質或微生物等質量控制異曲同工。根據風險評估的結果,在產品生產的全過程中的風險點進行必要的干預,實施最佳實踐(預防/檢測/清除)(圖1 B, 2A),便形成了病毒安全性控制的全過程控制原則(圖2 B)。其中潛在病毒污染的源頭控制是關鍵點,如何從源頭上進行有效控制事關病毒安全性控制的成敗。對于潛在病毒污染可能來源的風險點應逐層把控,特別體現在起始原材料的控制上。
生物制品病毒安全性控制應體現在生物制品質量控制的全過程。其基本要素包括對生產過程使用的相關物料(起始原材料、原材料和輔料)的來源控制、病毒污染篩查或處理,生產工藝對病毒的清除作用,以及對產品(包括中間產物和成品)病毒污染的檢測(圖2B)。
2.3 全生命周期管理原則
生物制品質量源于設計(QbD)的理念強調從預期的質量目標開始,強調產品和工藝的理解及工藝控制,通過識別對產品安全性和/或有效性具有重要意義的產品屬性(QTPP)和關鍵質量屬性(CQA),交付這些屬性的工藝設計;然后將質量風險管理結合到對藥品和工藝的深刻理解中,建立適當的控制策略,通過驗證以確保控制策略的有效性并持續監控,從而確保產品生命周期內的穩健工藝性能,并促進產品生命周期內的持續改進[27]。所以風險評估、全過程控制以及全生命周期的理念環環相扣,共同持續保障產品質量(圖3)。通過貫徹全生命周期管理的理念,可以進一步保障生物制品病毒安全性控制的持續有效性。
全生命周期管理理念貫徹于病毒安全性控制始終,工藝變更對病毒清除的影響應加以評估,根據影響程度,對病毒清除步驟進行必要的確認或再驗證。必要時還應通過上市后監測追溯產品病毒安全性,保證生物制品全生命周期的病毒安全性。畢竟,在生物制品本身安全性風險客觀存在的情況下,所謂安全均是相對的[28]。這也說明了生物制品的全生命周期管理的理念(圖3)對于生物制品的病毒安全性控制至關重要貫穿始終。


2.4 生物制品病毒安全性控制核心理念小結
以生物制品病毒安全性控制核心理念為基礎[1],經多個類別生物制品進行適用性確認,結合全生命周期管理的理念[27,29-33],以及和國內外產品品種實際情況,我們進一步對生物制品病毒安全性核心理念進行了精煉升華。最終本版藥典收載的通則“生物制品病毒安全性控制”形成了代表生物制品病毒安全性控制的科學理念和發展趨勢的最基本原則:“風險評估、全過程控制以及全生命周期管理”(圖4),其具有生物制品品種品類的廣泛適用性,其中風險評估是基礎,全過程控制是手段,全生命周期管理是持續保障,賦予了控制原則與時俱進、整體考量的科學內涵。
3 生物制品病毒安全性控制的框架結構
“生物制品病毒安全性控制”通則規范于藥典體例。前言部分明確限定適用范圍和控制對象;該標準全文貫穿于風險評估原則、全過程控制原則和全生命周期管理原則的核心理念,詳細分述病毒安全性控制的般原則、病毒安全性控制的具體要求和上市產品的病毒安全性追蹤三大內容(見圖5)。闡明了收載本標準的目的意義,具體品類的關注重點、執行原則和操作標準。該標準條理清晰,要求明確,查閱方便,術語解釋正確不產生歧義。
生物制品本身具有品類多,性質差異大的特點。尤其近年來,隨著新技術的發展,先進治療性醫藥產品(Advanced Therapy Medicinal Products)呈爆發式增長,其選材及制備過程涉及到一些特定的風險因子,這些特殊性是由原始材料、產品/產物特點和生產工藝的性質所決定,其病毒安全性控制需要采取一些額外的特殊的措施來保證。通則起草編撰時考慮到其需要適用更廣適用范圍,但中國藥典中收載的品種特性差異大,因此既需要符合統一適用性要求的廣度,又能應對特定品種的差異化需求。所以該通則在普適原則的指導下,將具有相似特點的品種品類病毒安全性控制的側重點分別予以明確,體現出生物制品病毒安全性控制的品類特點,達到個別與一般,個性與共性的統一(圖5)。

4 討論
《中國藥典》2020年版生物制品病毒安全性控制的起草編撰,以風險評估、全過程控制和全生命周期管理的核心理念為基礎,并將核心理念與發展趨勢相結合。制定收載的本通則適用于藥典三部收載的全部生物制品定義之范圍,包括人血液制品,動物體液/組織來源制品、疫苗、重組治療性生物制品、基因治療產品等;同時本通則還將藥典已收載于凡例、總論、通則、指導原則及各論中相關生物制品的病毒安全性控制所設立的項目、目的、要求、標準、和檢測方法系統化;本通則強調了生物制品的病毒安全性控制貫穿于風險評估、全過程控制和全生命周期管理的核心理念。
4.1 更完善的理念
通過國內外病毒安全性控制的各相關法規、規定及指導原則,各國藥典標準以及專業文獻等資料進行廣度和深度的比對、分析、歸納、提煉,完善了生物制品病毒安全性控制的核心點,形成了本版藥典通則生物制品病毒安全性控制的“核心理念”,將該核心理念與發展趨勢及所控品種(人血液制品、動物體液/組織來源制品、疫苗、重組治療性生物制品、基因治療產品等)的風險特性相結合,進行“適應癥”外展,形成了對病毒安全性控制覆蓋品種最廣,適用性較好的藥典標準。
4.2 更廣泛的適用性
本通則將一般原則和具體品種實際相結合,綜合品種的應用安全性歷史、病毒風險性評估情況等進行通則制定,以風險評估為基礎,做到了一般原則與品種差異的統一。基于風險進行全生命周期的考量,降低品種病毒污染風險,對當前生物制品的安全和有效生產具有重要意義,對有治療前景的新興療法亦有參考作用。
4.3 適度的前瞻性
生物制品(人血液制品、動物體液/組織來源制品、疫苗、重組治療性生物制品、基因治療產品)品種差異大,風險大小不一。本通則既強調一般原則,又兼顧品種差異,總體體例簡潔明了[34]。
本通則結合質量風險管理及生命周期管理理念等質控理念的發展趨勢,歸納了病毒安全性控制的共性(“一般原則”),體現了品種差異化(對不同類別產品風險控制的重點進行有側重地描述),拓展了適用范圍。基于風險和生命周期,既有針對已知風險的控制策略,也有針對未知風險的控制措施;還包括了上市后跟蹤和變更后的再評價。在總體技術要求上,與當前美國、歐盟、日本、ICH等相關標準一致。先進制造工藝,如連續制造、分布式制造、人工智能輔助等技術的快速發展促進藥物制造現代化[12],需要在更早和更廣的范圍內考慮法規對于新技術的適用性,該通則對當前生物制品的安全和有效生產具有重要意義,對有治療前景的新興療法亦有參考作用。但需要強調的是,任何技術或者措施只是手段,使用的措施或者提供的數據著眼點是支持低病毒安全性風險,我們的最終目的是要全面了解產品的病毒安全風險,保障產品病毒相關的安全性。
參考文獻
[1] 郭懷祖,楊美花,楊匯川,等.生物制品病毒安全性控制的核心理念探討[J].中國新藥雜志,2020,29(24):2781
GUO HZ, YANG MH, YANG HC, et al. Discussion on the core concept for viral safety of biological products[J].Chin J New Drugs,2020,29(24):2781
[2] DE GROOT RJ, BAKER SC, BARIC RS, et al. Commentary: Middle east respiratory syndrome coronavirus (merscov): announcement of the coronavirus study group[J]. J Virol, 2013, 87(14): 7790
[3] ZAKI AM, VAN BOHEEMEN S, BESTEBROER TM, et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia[J]. N Engl J Med, 2012, 367:1814
[4] LU R, ZHAO X, LI J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding[J]. Lancet, 2020, 395(10224): 565
[5] Middle East respiratory syndrome coronavirus (MERSCoV). WHO[EB/OL]. (20190311) [20191101]. https://www.who.int/newsroom/factsheets/detail/middleeastrespiratorysyndromecoronavirus(merscov).
[6] World Health Organization. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected: interim guidance, 25 January 2020[R]. World Health Organization, 2020.
[7] Fletcher, Tom, and Holden Harris. Safety Drives Innovation in AnimalComponentFree CellCulture Media Technology [EB/OL]. (20160914) [20171214]. http://www.processdevelopmentforum.com/articles/safetydrivesinnovationinanimal componentfreecellculturemediatechnology/
[8] KERR A, NIMS R. Adventitious Viruses Detected in Biopharmaceutical Bulk Harvest Samples over a 10 Year Period[J]. PDAJ Pharm SciTechnol, 2010, 64(5):481
[9] 陳琪, 張旻, 楊濱,等. 細胞培養生物制品在不同研發階段病毒清除的要求[J]. 中國新藥雜志, 2014,23(8):962
CHEN Q, ZHANG M, YANG B, et al. Viral clearance requirement for cellline derived biologicsat different stages of development[J].Chin J New Drugs, 2014,23(8):962
[10] BARONE PW, WIEBE ME, LEUNG JC, et al. Viral contamination in biologic manufacture and implications for emerging therapies[J]. Nat Biotechnol, 2020, 38(5): 563
[11] Zachary Brennan, Genzyme offers inside look at Massachusetts plant under consent decree[EB/OL],2014 https://www.biopharmareporter.com/Article/2014/06/25/GenzymeoffersinsidelookatMassachusettsplantunderconsentdecree
[12] National Academies of Sciences, Engineering, and Medicine. Innovations in Manufacturing Drug Products[M]//Innovations in Pharmaceutical Manufacturing on the Horizon: Technical Challenges, Regulatory Issues, and Recommendations. National Academies Press (US), 2021
[13] CDE,生物組織提取制品和真核細胞表達制品的病毒安全性評價技術審評一般原則[S]. 2005(12):GPH31
CDE,General Rules for Technical Review and Evaluation of Viral Safety Evaluation of BiologicalTissue Extraction Products and Eukaryotic Expression Products[S]. 2005(12):GPH31
[14] 李敏, 郭秀俠, 劉伯寧. 關于生物制品工藝驗證的審評實踐與思考[J]. 中國生物制品學雜志, 2017, 30(6):664
LI M, GUO XX, LIU BN. Discussion on general principle and key points of process validation for biologics[J].Chin J Biol, 2017, 30(6): 664
[15] LIU T, GUO H, ZHU L, et al. Fast characterization of Fccontaining proteins by middledown mass spectrometry following IdeS digestion[J]. Chromatographia, 2016, 79(21): 1491
[16] 汪泓, 徐進, 尹紅銳, 等. 多屬性分析方法應用于治療類抗體藥物質量控制的考量與前景[J]. 藥學學報, 2020, 55(9): 2092
WANG H, XU J, YIN HR, et al. Prospects and current use of the multiattribute method for quality control of therapeutic antibodies[J]. Acta Pharm Sin, 2020, 55(9): 2092
[17] KHAN A S, NGSHS, VANDEPUTTE O, et al. A multicenter study to evaluate the performance of highthroughput sequencing for virus detection[J]. Msphere, 2017, 2(5):e00307
[18] WHO/BS/2020.2394 Proposed 1st International Virus Reference Standards for Adventitious Virus Detection in Biological Products by NextGeneration Sequencing (NGS) Technologies (CBER5),[EB/OL].https://www.who.int/publications/m/ item/WHOBS20202394
[19] CLEVELAND MH, ANEKELLA B, BREWER M, et al. Report of the 2019 NISTFDA workshop on standards for next generation sequencing detection of viral adventitious agents in biologics and biomanufacturing[J]. Biologicals, 2020;64:76
[20] 劉伯寧, 羅建輝. 關于創新型抗體藥物藥學評價的思考[J]. 藥學學報, 2017,52(12):1811
LIU BN, LUO JH. Research and development of innovative antibodybased drugs[J]. Acta Pharm Sin, 2017, 52(12): 1811
[21] Guideline, ICH Harmonised Tripartite. viral safety evaluation of biotechnology products derived from cell lines of human or animal origin Q5A (R1)[S]. Current Step 4 (1999)
[22] 國家藥品監督管理局.血液制品去除/滅活病毒技術方法及驗證指導原則[S].2002
NMPA, Technical Methods for Viral Removal/Inactivation of Blood Products, and Technical Guide lines for their Validation[S].2002
[23] JP XVII[S].2016:2435
[24] 賽文博,于鵬麗,李小靜,等.重組表達生物制品生產中病毒清除驗證策略研究進展[J].中國新藥雜志,2021,30(10):876
SAI WB, YU P, LI XJ, et al. Research progress in viral clearance validation strategy of recombinant biological products[J].Chin J New Drugs, 2021,30(10):876
[25] JOHNSON SA, BROWN MR, LUTE SC, et al. Adapting viral safety assurance strategies to continuous processing of biological products[J]. Biotechnol Bioengin, 2017, 114(1): 21
[26] ROUSH DJ. Integrated viral clearance strategies—reflecting on the present, projecting to the future[J]. Curr Opin Biotechnol, 2018, 53: 137
[27] RATHOREAS. Quality by design (QbD)based process development for purification of a biotherapeutic[J]. Tren Biotechnol, 2016, 34(5): 358
[28] KAISER J. Virus used in gene therapies may pose cancer risk, dog study hints[J]. Science, 2020,1:6
[29] Guideline, ICH Harmonised Tripartite. Pharmaceutical Development Q8(R2)[S]. 2009
[30] Guideline, ICH Harmonised Tripartite. Quality Risk Management Q9 (R1)[S]. 2005:Current Step 4
[31] Guideline, ICH Harmonised Tripartite. Pharmaceutical Quality System Q10[S]. 2008:Current Step 4
[32] Parenteral Drug Association, Technical Report No. 56 (Revised 2016),Application of PhaseAppropriate Quality Systems and CGMP to the Developmentof Therapeutic Protein Drug Substance[S].2016
[33] RATHORE AS. Roadmap for implementation of quality by design (QbD) for biotechnology products[J]. Trends Biotechnol, 2009, 27(9):546
[34] Derrick Gingery, Pink Sheet‘Just Say It!′-New Streamlined Guidance Format Coming, FDA′s Woodcock Says[EB/OL]. (20171114) [20180809]. https://pink. pharmaintelligence. informa. com/PS121965/JustSayItNewStreamlined GuidanceFormatComingFDAsWoodcockSays
《中國藥品標準》雜志 2022年第23卷第2期 ,郭懷祖1, 楊美花2, 楊匯川3, 公雪杰4, 侯盛5, 張華捷6,李長清7, 董關木6, 李敏8, 孟淑芳6, 侯繼鋒6, 郭中平9
(1.抗體藥物與靶向治療國家重點實驗室,國家藥品監督管理局治療類單抗質量控制重點實驗室,上海張江生物技術有限公司,上海 201203; 2.廈門特寶生物工程股份有限公司,福建 廈門 361028;3.中國生物技術股份有限公司,北京 100029; 4.北京科興生物制品有限公司,北京 100085;5.上海百邁博制藥有限公司,上海 201203; 6.中國食品藥品檢定研究院,北京 100820;7.中國醫學科學院輸血研究所,成都 610052; 8.國家藥品監督管理局藥品審評中心,北京 100022;9.國家藥典委員會,北京 100061)

來源:《中國藥品標準》雜志


