您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-04-13 05:10
在藥品檢驗中,標準物質通常是指在實驗室藥品檢定中所使用的對照品和標準品。標準物質是按照適當程序進行制備的,并按照規定的程序對其有效性進行監控。
無論國家法定藥品標準,還是企業內部質量標準,只要藥品注冊質量標準中規定需要使用標準物質,標準物質就是藥品標準不可分割的一部分。
根據原國家食品藥品監督管理局令第 28 號《藥品注冊 管理辦法》第十一章第二節藥品標準物質的規定:藥品標準物質是指供藥品標準中物理和化學測試及生物方法試驗用,具有確定特性量值,用于校準設備、評價測量方法或者給供試藥品賦值的物質,包括標準品、對照品、對照藥材、參考品。
在我國,當藥品質量出現爭議時,國家藥品標準( 如《中國藥典》) 及相對應的官方標準物質是進行藥品質量檢驗唯一的仲裁標準。
化學標準物質定值
標準物質用于藥用物質和藥物制劑的鑒別、純度檢查和含量測定。
標準物質適用于規定的用途,不能保證規定以外的其他用途的適用性。
如果將一個標準物質用于規定用途以外的其他任何特定用途,必須徹底證明該標準物質在新用途中的適用性。
一個標準物質所賦的所有量值只在規定用途中使用有效,不保證用于其他用途。
1 化學標準物質的量值
早期的化學標準物質,對純度要求非常高,一般要大于 99. 5% 才可以作為標準物質的候選原料,除一些暫行的品種外,在標簽和說明書中都不對量值進行標識和說明,以 100. 0% 計。
但由于部分化學品種技術水平和工藝等原因, 不能獲得 99. 5% 這樣高純度的原料。這樣就給標準物質的制備帶來了困難。因此,最近的趨勢是從符合藥品標準的合格原料中選出一批質量較好的原料,在經過嚴格的標定后, 采用質量平衡法進行賦值。
目前美國、歐洲等國家或地區的藥品標準物質都采用在標簽中給出量值的方法進行化學標準物質的標定。
2 我國化學標準物質的幾種形式量值
1 鑒別用化學標準物質
用于紙色譜法( PC) 、薄層色譜法( TLC) 、高效液相色譜法( HPLC) 、氣相色譜法( GC) 、毛細管電泳法( CE) 、分光光度法、紅外吸收光譜鑒別用的化學標準物質,如果僅用于鑒別,在標簽和說明書中不標識含量。
2 供系統適用性試驗用化學標準物質
用于 PC、TLC、 HPLC、GC、CE 法系統適用性試驗的化學標準物質,在標簽和說明書中均不標識含量。
3 用于 PC 法和 TLC 法有關物質檢查用化學標準物質
由于這兩種方法為限度檢查法,屬于半定量分析,如果僅用于此項檢查,一般不標識含量,按 100. 0% 計。
4 HPLC、GC 或 CE 法檢查用化學標準物質
對于這類化學標準物質,一般在標簽或說明書中會給出含量,如果未標識含量,按 100. 0% 計。
有些特殊的雜質標準物質,由于數量非常有限,通常將原料用適當的溶劑配制成使用項下的濃度,將溶液精密分裝在小瓶中,然后采用減壓干燥的方法除去溶劑。這些標準物質的量值就采用“微克/每瓶”的方式標識其量值。
5 含量測定用化學標準物質
早期的含量測定用化學標準物質,在標簽和說明書中一般不給出量值,按 100. 0% 計。隨著國際上主要藥典標準物質賦值原則的變化,目前, 我國的含量測定用化學標準物質采用質量平衡法,根據使用項下方法的專屬性,對每個用途都進行賦值。
以甲磺酸酚妥拉明標準物質為例,該標準物質的說明書內容為“本品為甲磺酸酚妥拉明( Phentolamine Mesylate) 。105 ℃干燥 2 h 后使用,按 C17H19N3O·CH4O3S 計,供 HPLC 法測定,本品含量為 99. 9% ; 供 UV 法測定,本品含量為 100. 0% ”。
化學標準物質使用的處理方法
1 化學標準物質使用存在的問題
對于藥品檢驗人員,正確地使用化學標準物質是非常重要的。
2003 年之前,我國的藥品標準中一般都有標準物質的使用方法,比如 105 ℃干燥至恒重后使用。《美國藥典》等一 些藥典也在附錄中給出標準物質的使用方法,所以,標準物質的標簽和說明書中沒有使用前的處理方法,但是,由于歷史的原因,有些藥品標準中并未給出使用方法,給藥品檢驗人員帶來了困擾。
另一方面,藥典的修訂和出版周期與標準物質的換批時間不能同步,不同批次化學標準物質的干燥失重、水分和殘留溶劑情況不可能完全相同,因此,需要根據該批次標準物質的質量特性,制定合理的使用方法。
比如,咖啡因等一些化合物存在無水物和水合物兩種形態,在標準制定時,既可采用無水物作為標準物質,也可采用水合物作為標準物質。若選用無水物作為標準物質,可采用室溫條件下的干燥劑除去吸附水;當只能獲得其水合物,普通的干燥條件就不能完全地除去結晶水,這樣就不能簡單地干燥后使用,而需要測定水分后使用。
2 化學標準物質使用方法的幾種方式
①使用前不需干燥處理;
②減壓干燥后使用,若未給出干燥溫度,系指室溫( 一般 18 ~ 30 ℃ );
③常壓條件下干燥后 使用;
④測定水分后使用;
⑤采用指定溶劑溶解后直接使用 ( 有些標準物質在制備時,將兩種標準物質原料混合,配成溶液,分裝后揮發至干,并附于瓶底及瓶壁,標準物質為兩種化合物的混合物[如奧美沙坦酯雜質]) 。
藥品標準物質的儲存
1 藥品標準物質的儲存條件
目前,包括中檢所在內的國際主要的藥品標準物質制備機構對標準物質的儲存條件有不同的要求,見表 1。
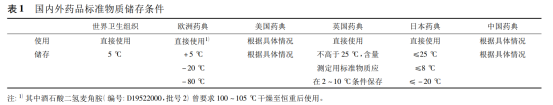
WHO 國際化學標準物質包裝上并不注明保存條件,其指導原則規定國際化學標準物質的保存條件為 5 ℃。
《歐洲藥典》標準 2006 年前大部分品種儲存條件為 4 ℃,后改為 5 ℃,歐洲藥品質量管理局( 簡稱 EDQM) 的長期保存條件為 2 ~ 8 ℃,氟氯西林鈉等少數化學標準物質的保 存條件為 - 20 ℃。硫酸長春新堿的保存條件為 - 80 ℃。
《日本藥局方》標準物質大部分品種的保存條件為 25 ℃ 以下,倍他米松磷酸鈉等一些標準物質的保存條件為不超過 8 ℃。還有廿六烷五烯酸乙酯等個別品種要求在 - 20 ℃ 以下保存。
我國標準物質在藥品標準物質的標簽或說明書中都給出儲存條件,一般情況下與藥典品種項下的保存條件一致。
2 藥品標準物質有效期的相關規定
國際上主要藥品標準物質制備機構在發放標準物質的標簽或說明書中均不給出有效期,但通常會對藥品標準物質的使用期限給予一些建議。
第一種:不給出藥品標準物質的具體使用期限,建議用戶購買后立即使用。
《英國藥典》標準物質官方網站文件規定,從該機構寄出化學標準物質日期起計算,用戶在 3 個月內使用有效,如果超過 3 個月,《英國藥典》委員會不能保證該標準物質的 質量。
《日本藥局方》標準物質也不給出有效期,指出購買足量的標準物質后應按照規定的條件保存,應盡快使用購買的標準物質。
第二種:當新批次的標準物質批準發放后,在藥品標準物質的目錄中給出上一個批號標準物質的有效使用日期。
歐洲藥品質量管理局和《美國藥典》采用這種處理方式。
EDQM 2009 年 12 月的目錄中非那雄胺化學標準物質的當前批號為“2”,批號為“1”的上批標準物質在 2010 年 3 月 31 日前使用有效。
《美國藥典》2009 年 9 月發布的標準物質目錄中,維生素 B12 化學標準物質的當前批號為 O0H288,批號為“N”的上批標準物質在 2010 年 3 月 31 日前使用有效。
但除另有規定外,新批號的標準物質發放后,《美國藥典》允許在一年內繼續使用上批標準物質。
我國目前不對藥品標準物質的有效期進行規定,標準物質換批制備后,在網站及時公示相關信息,部分品種將設置 3 ~ 6 個月的緩沖期。
國際上主要藥品標準物質的制備機構都建議用戶購買到標準物質后立即或盡快使用,并且不能保證開瓶后的標準物質的質量。
按照歐洲藥品質量管理局相關文件的規定,購買分裝在小瓶或安瓿中的標準物質后應“立即使用”,并建議在一次試驗中使用。
《英國藥典》、《美國藥典》、歐洲藥品質量管理局和《日本藥局方》的藥品標準物質也有類似的要求。
對于定量分析用藥品標準物質,開瓶后能夠反復使用幾次或可在多長時間內使用,完全由用戶確定并承擔多次使用中出現的所有風險。
對于非定量分析用藥品標準物質,比如系統適用性試驗中化學標準物質,在確認藥品標準物質符合試驗要求后,可在開瓶后繼續使用。
通常情況下,標準物質的裝量能夠滿足該品種項下全檢用量的 2 倍。稱量時應考慮到稱樣量和天平的選擇,使其符合定量分析的要求。
一般情況下,含量測定用標準物質,一次稱樣量應不少于 20 mg。
標準物質的均勻性與稱樣量相關,稱樣量小于 10 mg 時,標準物質的均勻性可能不能滿足使用的要求,也就是影響到兩份標準物質量值的一致性。
所以多次使用時,除了考慮標準物質的穩定性和引濕性、包裝的嚴密性外,還要考慮標準物質本身的均勻性和最小稱量的關系。
國際上主要的藥品標準物質制備機構
目前國際上主要的藥品標準物質制備機構的相關信息見表 2。

國際上化學標準物質建立、保存和分發的指導原則
目前除世界衛生組織 、《歐洲藥典》和《美國藥典》建立標準物質指導原則外,未見其他公開的關于藥品檢驗用標準物質的指導原則。
1 世界衛生組織化學標準物質指導原則
世界衛生組織藥品標準專家委員會在 1975 年制定了化學標準物質建立、保存和分發的指導原則。其目的是建立不同國家和地區機構在化學標準物質收集過程中的協作性和一致性。
最初起草的指導原則僅被世界衛生組織化學標準物質協作中心使用,用于標定國際藥典中各論項下所使用的標準物質。隨后世界衛生組織藥品標準專家委員會在 1982 年和 1999 年,對此指導原則進行過兩次修訂,并在 2003 年增加了二級標準物質建立的指導原則。
2 歐洲藥品質量管理局化學標準物質指導原則
歐洲藥典標準物質指導原則草案,首先發表在 2004 年 的《歐洲藥典論壇》,經過兩次內部修訂,最后文本于 2006 年 3 月正式生效并在歐洲藥典增補 56 中以附錄 512 的形式收載。

來源:《中國藥學雜志》


