您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-03-11 22:33
美國FDA將醫療器械按照風險從低到高劃分為三類,即Ⅰ類、Ⅱ類及Ⅲ類。不同管理類別的器械上市途徑不同,部分I類、大多數II類及少數Ⅲ類器械需通過上市前通告510(k)申請獲得市場準入許可,該途徑占上市申請器械的60%左右。
第三方 510(k)審核程序是FDA為醫療器械注冊申請人提供的一個自愿的替代性的審核程序,該程序允許有資質認可的第三方 510(k)審核機構(Third Party (3P510k) Review Organization)審核規定的中、低風險的醫療器械,以提高510(k)的審核效率。您家的醫療器械可以申請第三方510(k)審核嗎?今天,小編即為您解答。
一、FDA第三方 510(k)審核基本流程
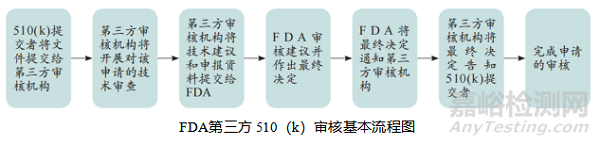
確定申報產品是否在第三方審核項目范圍內
查詢產品代碼分類數據庫或FDA第三方審核項目公開網站,以及是否具備相應專家,以判定申報產品類型是否屬于第三方審核范圍。當前第三方審核項目中的產品包括麻醉學、耳鼻喉、血液學、產科/婦科、心血管及臨床化學等20類產品。FDA會動態更新產品列表,使FDA始終可將審查資源集中于高風險及復雜設備,同時保持對第三方審核項目的高度信任。
如不是,將拒絕該510(k)申請;如是,則為該510(k)申請分派合適的技術審評人員。若必要,將分派具有相關專業背景的技術專家。
申請材料完整性審查
申請人提交510(k)申請前,應將與FDA間的所有咨詢交流信息告知機構。
機構根據21CFR 807.87至807.100中的法規規定,對遞交資料進行受理審查,以確定該申請是否包含所有必要信息,并能得出實質性等同(SE)或非實質性等同(NSE)的決定。FDA推薦機構使用拒絕接受清單[Refuse to accept (RTA) checklist]以判定申報資料是否完整。
實質性等同評審
機構充分利用FDA公開發布的有關信息,包括產品類指導原則、通用指導原則及聯邦法規21章(Title 21-Code of Federal Regulations,21 CFR)中對特定II類產品的特殊控制要求。機構應查閱上市后數據庫,了解臨床使用有關問題或風險。FDA鼓勵機構及時與FDA有關審評人員進行溝通咨詢,特別是審評人員首次審評某一類產品時。
實質性等同的具體判定路徑可參考相應指導原則。機構應在內部指定一位審定員,其不參與此前的審評工作并負責對審評小組的審評建議提出最終評估結論。該審定員應具有充分的權威和能力,確保可獨立評估審評建議的質量及可接受度。
如何處理510(k)申報資料中的缺陷
技術審評過程中,如機構認為申報資料存在缺陷或問題,可采用電話及郵件等方式與申請人溝通。所有溝通交流記錄應規范移交至FDA,同時確保機構不能變成申請人的咨詢機構。
出具審評建議
一旦機構完成審查,應出具一份審評建議,該建議文檔應說明理由并作出上述審評建議的具體步驟,有助于避免FDA對510(k)申請資料重新審查,提高審評效率。
機構將有關資料移交FDA
完成審評后,機構中的審定員遞交510(k)申報資料及審評建議書的電子文檔至FDA文檔控制中心。FDA須在收到材料后的30日內做出最終決定。若申報資料存在缺陷,FDA將具體問題告知機構,并由后者通知申請人補充信息。
二、FDA對第三方510(k)審核機構的監管
符合第三方審核項目的產品類型及考量因素
FDA在2020年發布的第三方510(k)審核項目指南中給出了在確定產品類型是否符合第三方審核項目的考慮因素,主要內容如下:
(1) 產品風險。III類設備不符合第三方審核資格,若產品類型為永久植入、維持生命或生命支持,除非理由充足,否則不會被納入第三方審核項目。
(2) 產品類型的難易程度。如具有新技術的產品,包括某些通過De Novo程序初步分類的需要復雜特殊控制的產品,可能不符合第三方審核條件。
(3) 獲取充分信息的程度。如果與評估該產品類型的相關信息不能在機構外共享(如其為FDA內部專有),則該產品類型可能不符合第三方審核資格。
(4) 上市后數據表明該產品類型本身存在安全風險。如某產品上市后存在安全問題,FDA可能將該產品從第三方審核項目產品清單中移除。
機構的資質管理
FDA對機構的資質認定將在授予認定之日起3年內有效。FDA建議機構在其資質認定狀態到期前至少60日申請重新資質認定。FDA會定期(至少每3年1次)或因地對每個機構的運行情況及所開展的審核項目進行評估。如評估結果顯示該機構不符合FD&C Act法第523條,FDA可采取措施暫停或撤銷第三方審核資質。
三、第三方 510(k)審核常用網址
當前符合第三方審核條件的器械清單
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfThirdParty/current.cfm
FDA認可的第三方 510(k)審核機構清單
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfthirdparty/accredit.cfm?party_key=8
申請材料拒絕接受清單 [Refuse to accept (RTA) checklist]
https://www.fda.gov/media/83888/download
參考資料:俞卉,袁鵬,楊挺,朱文武.關于美國FDA第三方510(k)審核項目的分析研究[J].中國醫學裝備,2021,18(05):191-195.

來源:蘇大衛環


