您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-03-09 13:35
膠囊劑是填充有非水液體、半固體或固體粉 末和顆粒的硬或軟膠囊。溶出度是膠囊劑關鍵質 量屬性,由于膠囊劑內容物與囊殼相互作用、外 部環境對內容物的影響、明膠囊殼交聯等因素, 長期穩定性放置期間可能出現溶出度檢測不合格 的情況。溶出方法選擇不合理如囊殼漂浮或成團、 油狀內容物漂浮等,也可能導致溶出度結果差異 較大。本研究參考 USP 通則<1094>梳理膠囊劑溶 出度試驗的關注點,包括溶出介質、溶出裝置以 及酶法破除明膠交聯等。基于風險考慮從膠囊殼、 膠囊填充物、包裝材料等方面提出膠囊劑溶出度 研究的一些思考。
經檢索 FDA 溶出度數據庫 (Dissolution Methods Database Search),自 2004 年開始收載以 來,共計收載膠囊劑溶出方法 193 個,籃法 62 個, 槳法 131 個,其中 28 個選擇沉降籃。13 個藥物的 溶出介質中使用酶。使用酶的溶出方法占比 6.7%。
1、膠囊劑溶出度試驗
1.1 增溶類物質的選擇
溶出介質應滿足漏槽條件。當膠囊填充物和/ 或原料藥(active pharmaceutical ingredient,API)都 屬于疏水性或者水不溶物質,可能需要選擇含增 溶類物質的介質進行溶出。溶出介質不應與膠囊 殼或制劑產生相互作用,若使用酶破除明膠交聯,介質也不應影響酶的活性。因此開發疏水性或者 水不溶填充物膠囊適用的介質可能需要大量的實 驗考察。常見的增溶類物質包括:①陰離子類:十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)等;②陽離子類:十六烷基三甲基溴化銨(hexadecyl trimethyl ammonium bromide,CTAB)等;③非離 子類:聚山梨醇酯(吐溫)等[1]。
明膠膠囊劑溶出介質應慎重選擇增溶類物 質,因為它們可能與囊殼發生相互作用而阻礙崩 解或溶解,也有可能抑制酶活性。SDS 是一種對 酶有抑制作用的表面活性劑,也是蛋白變性劑, SDS 可能使明膠蛋白變性,進而影響藥物溶出[2]。研究表明在一定濃度的 SDS(0.05%~0.8%)存在下, 胃蛋白酶的活性均顯著降低[3]。此外 SDS 還能與 鉀離子形成不溶性沉淀。溶出介質中建議使用高 純度的 SDS,低純度 SDS 中的雜質可能干擾溶出 度測定。此外,在含有脂肪酸的制劑中,應避免使 用陽離子表面活性劑,因為可能形成不溶性沉淀[4]。
1.2 酶的選擇
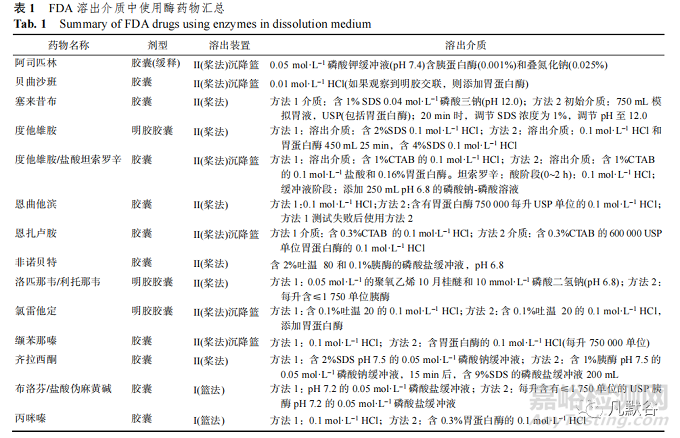
明膠交聯可能導致溶出過程中囊殼內部或外 部表面形成不溶于水的薄膜,阻止膠囊填充物的 釋放[5]。痕量醛(如甲醛、戊二醛、乙二醛等)引起 的交聯是最常見的,此類交聯需使用酶斷裂交聯 的肽鍵。此外還有三價金屬離子(如 Fe3+和 Al3+)和 明膠中離子(如羧酸根、銨根)介導的較弱的離子交 聯,一般可以通過更改介質的離子強度或 pH 值來 破除[6]。只有研究表明確實為明膠交聯導致膠囊溶 出度不符合標準,才可在介質中添加酶。FDA 收 載的溶出介質使用酶的一些具體藥物見表 1。
USP<1094>指南給出了酶選擇的基本原則。酶的種類和用量取決于溶出介質的 pH 值,建議 pH≤4.0 介質使用胃蛋白酶,每升用量≤750 000 單位;pH 4.0~6.8 介質使用木瓜蛋白酶或菠蘿蛋白 酶,木瓜蛋白酶每升用量≤550 000 單位或者菠蘿 蛋白酶每升≤30 明膠消化單位(GDU);pH≥6.8 介 質使用胰酶,每升用量≤2 000 單位。
如果溶出介質包含使酶變性的表面活性劑或 其他成分,溶出試驗中應先用酶進行預處理。預 處理介質不含表面活性劑或其他影響酶活性的成 分。FDA 溶出度數據庫中收載的塞來昔布膠囊采 用兩級溶出度測試程序,方法 1 不使用酶,溶出 介質為含 1% SDS 的 0.04 mmol·L−1 磷酸鈉作為溶 充物比重比介質小,膠囊可能在介質中漂浮;膠 出介質;當溶出介質 1 不滿足溶出度限度時,選擇方法 2,即先使用含胃蛋白酶的模擬胃液 750 mL 預處理 20 min,之后添加 NaOH(調節 pH 至 12.0) 和 SDS 溶液(最終濃度為 1%)至 1 000 mL 完成后 續的溶出度測試。
1.3 溶出裝置選擇
膠囊劑溶出過程中可能會出現以下情況:填囊殼軟化形成黏的或蠟狀團塊,黏附在溶出裝置 上,導致測定結果呈現高變異性;有些膠囊填充 物可在溶出介質表面形成薄膜,如油狀液體,也 可能導致膠囊溶出不完全,或產生高變異的溶出結果。
美國藥典中收載了 4 種溶出裝置,包括籃法、 槳法、往復圓筒法和流通池法。最常見的溶出度 裝置是槳法和籃法。籃法具有固定膠囊的優點, 防止膠囊在介質中自由浮動,缺點是膠囊崩解后 填充物可能堵塞轉籃網孔。解決辦法是采用更大 孔徑篩網。膠囊劑一般使用篩網孔徑 40 目的轉籃, 必要時使用 10~20 目篩網的轉籃。FDA 數據庫收 載的米諾環素膠囊選擇 10 目篩孔的轉籃,異維 A 酸膠囊選擇 20 目孔的轉籃。槳法不能防止膠囊漂 浮,可以使用沉降籃固定膠囊在容器底部。但需 要考察沉降籃的尺寸,因為膠囊與溶出介質接觸 后會膨脹變大。流通池法適用于油脂類膠囊劑溶 出測定。
2、膠囊劑開發及溶出度研究
溶出度是膠囊劑的關鍵質量屬性,膠囊劑的 良好質量應當是生產出來的,而非通過溶出度檢 測出來的。膠囊劑溶出度控制應堅持處方開發研 究在前,檢測檢驗在后的思路。采用風險評估的 理念,對囊殼質量、膠囊內含物(API 和輔料)、包 裝等條件進行評估與控制,確保膠囊劑溶出度結 果持續符合質量標準。
2.1 囊殼
膠囊殼常規檢查項目包括崩解時間、金屬雜 質、水分、微生物限度等。囊殼大部分均為聚合 物材質,為保證質量一致應關注膠囊基材的聚合 度或者分子量,特別是軟膠囊。以明膠為例,明 膠按照凍力強度可分為低強度(50~125 bloom g,分 子量 20 000~25 000)、中強度(175~225 bloom g, 分子量 40 000~50 000)和高強度(225~325 bloom g, 分子量 50 000~100 000)[7]。由于明膠原料來源和生 產工藝的不同,不同生產廠家的明膠強度可能存 在差異,甚至同一廠家不同批次也會不同。生產 中應對囊殼質量以及供應商進行適當的風險評 估,采取適當的控制手段。
為減少或消除膠囊劑本身引發的明膠交聯, 可從以下方面考慮:①基材替換。使用改性纖維 素如羥丙基甲基纖維素 (hydroxypropyl methyl cellulose,HPMC)或其他多聚物代替明膠。這類基 材具備類似于明膠的膠凝特性,不會產生交聯, 而且具備寬 pH 值和高溫耐受性。②明膠化學改 性。可以通過化學改性減少醛誘導的交聯反應, 例如在明膠分子鏈賴氨酸側鏈引入琥珀酸基團[6]。③膠囊內容物處方優化。處方內容物使用低醛輔 料,或在殼處方中使用游離氨基(例如甘氨酸、賴 氨酸)與明膠競爭減少分子間交聯[8]。
2.2 膠囊內容物
內容物與囊殼相容性良好是膠囊劑處方開發 的基本要求。還原糖類輔料的醛基會導致明膠交 聯,從而導致溶出度檢測結果變異較大,其他可 能降解產生痕量醛類雜質的輔料包括聚乙二醇、 聚山梨酯、羥丙基纖維素、微晶纖維素、羥丙甲 纖維素和淀粉等[9]。建議對膠囊內容物的各成分依 次進行風險評估并進行適當的控制,如吸濕性、 含水量、醛類和三價金屬離子雜質水平等。盡可 能少用或不用還原糖。此外,由于外部因素的影 響,內容物中 API 在儲存期間可能發生晶型轉變 導致其穩定性末期溶出度不合格。如紅外光譜和 X 射線粉末衍射(XRPD)技術檢測穩定性末期的苯妥 英鈉膠囊內容物,結果表明苯妥英鈉和輔料乳糖 特征峰消失,苯妥英鈉的相變以及與輔料的相互 作用是導致溶出超限的主要原因,與囊殼質量無 關[10]。HPMC 膠囊不需要考慮明膠交聯的問題, 但由于其透水性與明膠囊殼類似,同樣需要考慮 外部環境因素對內容物理化性質的影響[11]。
2.3 包裝
明膠暴露于劇烈的外部環境條件下會發生交 聯,物理條件如高溫、高濕、紫外線輻射、γ 輻射 和快速干燥;化學條件如醛、酮、亞胺和碳二亞胺 以及酶類,如轉谷氨酰胺酶[12]。對于 API 含有酯鍵 或酰胺鍵的,水分影響其穩定性,應嚴格控制水分 含量。膠囊最常見的包裝是塑料瓶和泡罩,鋁箔的 水分隔離能力強于塑料包裝。包裝研究對于膠囊劑 至關重要,應在產品開發早期進行研究,包括藥品 儲存的研究以及多劑量藥品包裝開啟后的研究。包 裝材料的厚度和材質與包材性能密切相關,評估包裝系統性能的最重要的指標是水蒸氣透過率,其他 指標包括透光率和透氧率[13]。包裝開啟后吲哚美辛 膠囊溶出度不合格,這是由于吲哚美辛吸水導致 晶型變化。采用帶有封口的鋁袋包裝可以有效防 止溶出度顯著下降,這種包裝適合多劑量藥品啟 封后的儲存[14]。新型干燥劑的使用是膠囊包裝保 護的另一種策略。相比傳統的硅膠干燥劑,活性 炭在濕度<50%時吸水較少,但在濕度>50%時水分 吸附能力顯著增加,同時也能夠吸附甲醛等氣體, 這些優勢對于膠囊特別是明膠膠囊可能會有較好 的應用前景[15]。
2.4 溶出試驗
應根據膠囊輕重、膠囊填充物理化性質等, 選擇合適的溶出裝置及溶出介質。對于使用酶破 除明膠交聯的情況,溶出方法可能需要兩級溶出 度測試程序。此外也應評估 pH、離子強度、緩沖 離子對和增溶類物質對 API 溶解度和酶活性的影 響。采用兩級溶出方法,添加木瓜蛋白酶對消除 氟伐他汀膠囊膠囊殼的交聯具有明顯作用,平均 溶出度可提高 5%~7%[16]。溶出度檢測方法也需要 經過驗證,如取樣方法、放置時間、濾膜過濾吸 附等。早期開發階段通過在輔料中摻入一定量的 甲醛或其他交聯劑、或者將膠囊暴露于甲醛蒸汽 中、或者將膠囊暴露于高溫高濕條件下,可以人 為制造明膠交聯囊殼[17]。人為形成的交聯可以對 使用酶的必要性進行論證,同時也有助于溶出方 法的建立,如溶出介質中使用酶的類型、數量、 孵育時間等。
2.5 崩解時限替代溶出度
ICH Q6A 規定,對于溶解度較好且在多種介 質中能夠快速溶出的制劑,如果能夠建立崩解時 限與溶出度的相關性,則可以采用崩解時限替代 溶出度檢查。這主要是基于快速溶解的藥物崩解 后即視為溶解。除了快速溶出的制劑外,也有腸 溶膠囊崩解時限和溶出度相關性的研究報道[18]。部分軟膠囊可采用崩解時限或破裂試驗作為溶出 度檢查的替代方法[19]。中國藥典 2015 年版二部收 載硬膠囊大部分需要進行溶出度試驗,收載的 17 種軟膠囊中,僅尼莫地平軟膠囊需進行溶出度試 驗,其余均進行崩解試驗。
3、展望
溶出度是口服固體制劑的關鍵質量屬性,也 是研發及申報過程中主要關注的質量指標。由于膠囊內容物差異的特點,膠囊劑溶出度方法具有 其特殊性,因此除考慮常規的溶出度方法的區分 力研究外,還應當關注溶出度方法的適宜性,通 過裝置以及方法的選擇和設計保證溶出度檢測方 法的可靠性。新版中國藥典 2020 年版溶出度方法 收載了 7 種裝置方法,較中國藥典 2015 年版增加 往復筒法和流池法,也為今后膠囊劑溶出度研究 提供了更多選擇。膠囊殼材質種類較多,囊殼材 質質量的控制與溶出度相關,因此應該對囊殼供 應商進行適當的審計,并建立適當的囊殼內控標 準。明膠囊殼可能在儲存期間發生交聯導致溶出 結果變化,特別是內容物中存在小分子醛類雜質 或者膠囊處于較為劇烈的外部環境。針對明膠膠 囊,在處方開發中應對原輔料種類及其潛在雜質 進行評估,并選擇適宜的包裝材料避免外部環境 影響,為產品有效期末溶出度結果符合要求提供 保障。

來源:中國現代應用藥學


