您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-02-17 10:55
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
國內藥訊
1.藹睦VEGF/Ang-2雙抗在美獲批臨床。藹睦醫療(曾用名:艾邁醫療)新型VEGF/Ang-2雙抗AM712獲FDA臨床許可,擬開展一項Ⅰ期臨床,評估用于新生血管性年齡相關性黃斑變性(AMD)患者的安全性、耐受性、藥代動力學和療效。AM712(ASKG712)是奧賽康藥業子公司AskGene Pharma開發的一款雙靶點新藥,目前正在中國啟動臨床研究。藹睦醫療擁有AM712在全球亞洲以外地區和日本的開發、生產和商業化獨家權益。
2.安博生物CD70-ADC獲批臨床。安博生物CD70靶向抗體偶聯藥物(ADC)ARX305獲FDA臨床許可,即將在美啟動首次人體試驗,評估用于既往標準治療耐藥或難治的透明細胞性腎細胞癌成人患者的安全性、藥代動力學和初步抗腫瘤活性。在多種腫瘤細胞和模型中,ARX305表現出良好的體外和體內效果,有望直接殺死過表達CD70的腫瘤,并改善腫瘤微環境。
3.奧賽康c-Met抑制劑獲批臨床。奧賽康1類新藥ASKC202獲國家藥監局臨床試驗默示許可。ASKC202是一款口服小分子c-MET抑制劑,已在臨床前腫瘤模型中顯示出抗腫瘤活性,有望為c-MET通路異常腫瘤患者提供新的治療選擇。奧賽康計劃開發ASKC202與其三代EGFR抑制劑ASK120067聯用,治療一代EGFR抑制劑耐藥的T790M陰性患者,以及用于三代EGFR抑制劑耐藥的患者,以拓展非小細胞肺癌的目標人群。
4.創新SGLT-2抑制劑在華獲批臨床。Daewoong Pharmaceuticals公司開發的SGLT-2抑制劑enavogliflozin片獲國家藥監局臨床試驗默示許可,擬臨床用作飲食和運動的輔助藥物,改善2型糖尿病成人患者的血糖控制。2022年1月,enavogliflozin已在2項治療2型糖尿病的Ⅲ期臨床中取得積極結果,與安慰劑組相比,enavogliflozin單藥治療組24周后患者HbA1c水平較基線變化值差異為0.99%,具統計學顯著性(p<0.001);與dapagliflozin聯合二甲雙胍治療相比,enavogliflozin與二甲雙胍聯用也達到非劣效性標準。試驗的最終報告將在今年下半年發布。
5.信立泰抗抑郁癥新藥獲批臨床。信立泰藥業1類新藥SAL0114片獲國家藥監局臨床試驗默示許可,擬開發用于治療重度抑郁癥患者。SAL0114片是信立泰自主研發的一款復方緩釋片劑。目前已上市的抗抑郁藥物,大多起效需要數周,存在未被滿足的臨床需求。此次為SAL0114首次獲批臨床。在中國,抑郁癥的患病率達到2.1%;中國成人抑郁障礙終生患病率為6.8%。
國際藥訊
1.歐盟推薦恩格列凈用于所有心衰分型。勃林格殷格翰與禮來開發的SGLT2抑制劑Jardiance(恩格列凈)獲歐洲藥品管理局(EMA)人用醫藥產品委員會(CHMP)推薦批準,用于治療有癥狀的慢性心力衰竭成人患者。此前,Jardiance已被批準用于治療射血分數降低的有癥狀慢性心力衰竭(HFrEF)成人患者。如果獲批,Jardiance將成為首個經臨床證明的治療整個心力衰竭疾病譜成人患者(無論左室射血分數[LVEF]如何)的治療方法,包括射血分數保留的心力衰竭(HFpEF)。
2.Mirati公司KRAS抑制劑報NDA。FDA受理Mirati Therapeutics公司口服KRAS G12C抑制劑adagrasib的新藥申請,用于治療KRAS G12C突變、非小細胞肺癌(NSCLC)患者。PDUFA日期為2022年12月14日。在一項Ⅱ期臨床KRYSTAL-1中,adagrasib在這類患者中達到43%的客觀緩解率(ORR)和80%的疾病控制率(DCR)。adagrasib用于這一適應癥已獲FDA授予突破性療法認定。再鼎醫藥擁有這款創新藥在大中華區的開發權益。
3.安進KRAS抑制劑胰腺癌臨床積極。安進KRAS G12C抑制劑Lumarkras(sotorasib)治療KRAS G12C突變、晚期胰腺癌的最新結果積極。在38例經治患者中,Lumakras獲得21%的客觀緩解率和84%的疾病控制率;中位隨訪為16.8個月時,中位緩解持續時間為5.7個月;中位無進展生存期為4個月,中位總生存期接近7個月。去年5月,它已獲得FDA的加速批準,治療攜帶KRAS G12C突變的非小細胞肺癌患者。
4.奧拉帕利治療前列腺癌Ⅲ期臨床積極。阿斯利康與默沙東開發的PARP抑制劑奧拉帕利,聯合阿比特龍一線治療轉移性去勢抵抗性前列腺癌(mCRPC)的Ⅲ期試驗PROpel中期結果積極。與阿比特龍單藥相比,聯合治療使疾病進展風險降低34%,兩組放射學無進展生存期分別為24.8個月和16.6個月。而且聯合治療的安全性與已知研究一致。詳細結果將在ASCO2022會議上公布。
5.禮來擬17億美元布局下一代ADC。禮來與ImmunoGen公司將利用后者創新喜樹堿技術平臺,合作開發新一代抗體偶聯藥物(ADC)。ImmunoGen專有的喜樹堿和連接子設計旨在優化現有喜樹堿(靶向I型拓撲異構酶的抗癌藥物)技術,有潛力提供更寬的治療窗口,并增強安全性和療效。根據協議,ImmunoGen將獲得1300萬美元的預付款,和高達17億美元的里程碑潛在付款。禮來將擁有ADC候選療法的全球研發和商業化的獨家權益。
6.Kallyope公司加速開發腸-腦軸創新療法。Kallyope公司完成2.36億美元的D輪融資。該公司成立6年來,已建立了一個高度集成的前沿技術平臺,整合了幾種復雜的技術,包括單細胞測序、光遺傳學和化學遺傳學,類器官等,以發現作用于腸-腦軸的轉化性小分子治療藥物,用于治療包括肥胖、糖尿病、炎癥性疾病等。此輪融資將用于該公司兩個先導項目的臨床開展,以及進一步發展“腸-腦軸”開創性藥物發現平臺。
醫藥熱點
1.4位中國專家入選美國微生物科學院院士。美國微生物科學院(AAM)日前公布了2022年度美國微生物學院院士名單,共計有65名科學家當選。其中,中國大陸有4位專家當選,他們分別是中山大學公共衛生學院(深圳)舒躍龍院長;中國科學院微生物學研究所黃力博士;復旦大學上海市公共衛生臨床中心盧洪洲博士;上海生命科學研究院植物生理生態研究所趙國屏博士。
2.肖海鵬任中山大學附一院院長。16日上午,中山大學附屬第一醫院召開干部大會,宣布任命醫院新一屆行政領導班子成員。經廣東省委批準,中山大學常務副校長肖海鵬同志擔任醫院院長,曾進勝、祁少海、匡銘、王子蓮、殷曉煜、朱慶棠、張弩擔任副院長。肖海鵬,醫學博士,教授,博士生導師。現任中山大學常務副校長,中山大學附屬第一醫院院長、內分泌科首席專家。
3.2021年腫瘤抗體藥銷售TOP10出爐。外媒日前公布了2021年腫瘤單抗藥全球銷售額TOP10榜單。按銷售額排序依次是默沙東的Keytruda(171.8億美元,+20%);BMS的Opdivo(75.2億美元,+8%);羅氏的Tecentriq(35.8億美元,+24%)、Avastin(33億美元)、Herceptin(29.1億美元)和Rituximab(27.7億美元);BMS的Yervoy(20.2億美元);強生的Darzalex(16.4億美元);安進的Xgeva(14.3億美元)和Vectibix(8.73億美元)。
評審動態
1. CDE新藥受理情況(02月
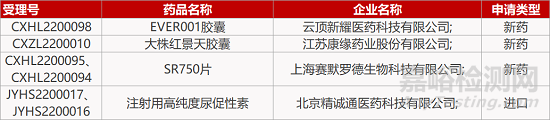


來源:藥研發


