您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2022-01-24 10:48
更多醫藥技術資訊,請點擊醫藥專欄:http://drug.anytesting.com/ 歡迎關注文末微信公眾號:藥研檢測drugtest
今日頭條
海創口服PROTAC上Ⅰ期臨床。海創藥業口服蛋白靶向降解嵌合體(PROTAC)藥物HP518在澳大利亞開展的Ⅰ期臨床中完成首例患者給藥。HP518由海創藥業自主研發,可高選擇性地靶向降解雄性激素受體(AR),具有治療耐藥性前列腺癌的潛力。該項研究旨在評估HP518在轉移性去勢抵抗性前列腺癌患者中的安全性、藥代動力學和抗腫瘤活性。
國內藥訊
1.三葉草新冠疫苗II/III期積極。三葉草三聚體重組蛋白新冠疫苗SCB-2019(CpG 1018加鋁佐劑)的全球關鍵性II/III期SPECTRA研究成果發表在《柳葉刀》上。接種兩劑SCB-2019對預防任何嚴重程度COVID-19的總體保護效力為67%,對預防中重度COVID-19的保護效力為83.7%,對預防重度和需住院治療的COVID-19的保護效力達到100%。預防因德爾塔、伽馬和繆變種引起的任何嚴重程度COVID-19的疫苗效力分別為78.7%、91.8%和58.6%。該公司計劃向歐洲EMA、NMPA及WHO提交附條件上市申請。
2.譽衡PD-1單抗治療宮頸癌報產。譽衡生物PD-1賽帕利單抗治療復發或轉移性宮頸癌的注冊性Ⅱ期臨床結果積極。數據分析顯示,賽帕利單抗達到主要療效終點指標,且安全性數據集滿足對暴露量的要求。該公司計劃提交這項新適應癥的上市申請,這項上市申請有望被CDE納入優先審評。去年8月,NMPA已批準賽帕利單抗注射液上市,用于二線以上治療復發或難治性經典型霍奇金淋巴瘤。
3.復星子公司啟動2款新藥Ⅲ期臨床。復星醫藥旗下奧鴻藥業在國內啟動CDK4/6抑制劑FCN-437c的Ⅲ期臨床,用于治療HR+/HER2-晚期乳腺癌。FCN-437c最早由復創醫藥開發,已在早期臨床中展現出較高的對CDK4/6的選擇性抑制活性;而且FCN-437c能穿透血腦屏障,在腦轉移腫瘤患者中具有治療潛力。復星控股子公司江蘇萬邦也于日前啟動ALK/ROS1抑制劑丁二酸復瑞替尼膠囊(SAF-189)的Ⅲ期臨床,用于治療ALK陽性非小細胞肺癌(NSCLC)。
4.科望CD39單抗上Ⅰ期臨床。科望醫藥CD39抗體ES002在美國完成Ⅰ期臨床首例患者給藥。通過阻斷CD39蛋白ATP酶活性,ES002能夠抑制腺苷的生成,同時維持具有促炎反應的細胞外ATP的水平,從而恢復抗腫瘤微環境。在臨床前動物模型中,ES002展現了顯著的單藥抗腫瘤活性。該療法擬開發用于治療非小細胞肺癌、結直腸癌、胰腺導管腺癌、胃癌等。在中國,ES002已遞交IND申請。
5.信達Claudin18.2靶向CAR-T啟動臨床。信達生物在ClinicalTrials.gov網站登記啟動一項IBI345治療實體瘤的Ⅰ期臨床試驗。IBI345是信達生物采用通用“模塊化”結構設計的一款靶向Claudin18.2的CAR-T細胞治療產品。這項在中國開展的臨床試驗計劃入組經標準療法治療失敗的30例Claudin18.2陽性、晚期胃癌或胰腺癌患者。除了靶向Claudin18.2的CAR-T療法外,信達還開發了Claudin18.2靶向單抗IBI360和Claudin18.2/CD3雙抗IBI389,目前IBI360和IBI389均進入Ⅰ期臨床開發階段。
國際藥訊
1.Keytruda/Lenvima治療子宮內膜癌Ⅲ期成果發表。默沙東PD-1療法Keytruda聯合衛材多受體酪氨酸激酶抑制劑Lenvima治療晚期子宮內膜癌的Ⅲ期研究成果發表在《新英格蘭醫學雜志》上。與化療(多柔比星或紫杉醇)相比,聯合治療的中位PFS(7.2個月VS3.8個月)和中位OS(18.3個月VS11.4個月)均顯著更高;安全性上,兩組發生3級或以上不良事件的比例分別為88.9%和72.7%。FDA于去年7月完全批準該組合方案用于二線治療非MSI-H/dMRR晚期子宮內膜癌患者。
2.RNAi療法治療hATTR-PN長期療效積極。Alnylam公司RNAi療法vutrisiran治療遺傳性轉甲狀腺素蛋白淀粉樣變性多發性神經病(hATTR-PN)的Ⅲ期試驗達到第18個月時的所有次要終點。與安慰劑組平均增加28.09分相比,Vutrisiran組改良神經病變損害評分(mNIS+7)相對基線平均降低0.46分,兩組改善mNIS+7評分的患者比例分別為48%和4%;兩組改善生活質量的患者比例分別為57%和10%;Vutrisiran組血清TTR水平較基線平均降低88%,與patisiran對照組相比達到非劣效性標準。此前,FDA已授予Vutrisiran快速通道資格,PDUFA日期為今年4月。
3.KRAS抑制劑Ⅱ期臨床積極。Mirati公司KRAS G12C抑制劑adagrasib在Ⅱ期KRYSTAL-1研究中達到41%的總體客觀緩解率和100%的疾病控制率。在可評估胰腺癌患者中,緩解率(RR)為50%,中位緩解持續時間(mDOR)為7.0個月,中位隨訪時間為8.1個月,中位無進展生存期(mPFS)為6.6個月(95% CI:1.0-9.7)。在其他胃腸道腫瘤患者中,RR為35%;mDOR為7.9個月,中位隨訪時間為6.3個月,mPFS為7.9個月(95% CI 6.90–11.30)。而且Adagrasib的安全性可控。該新藥已在美遞交NDA申請。
4.拜耳帕金森病細胞療法臨床進展。拜耳旗下BlueRock公司聯合大學健康網絡(UHN)開展的評估DA01治療晚期帕金森病(PD)患者的開放標簽Ⅰ期研究完成首例患者給藥治療。DA01是BlueRock公司使用多能干細胞產生多巴胺能神經元的細胞療法,去年6月已在美國和加拿大啟動國際Ⅰ期試驗,評估DA01細胞移植在移植1年后的安全性和耐受性,次要目標將評估移植后1年期和2年期移植細胞存活和運動效應的證據,2年期間的持續安全性和耐受性。
5.新一代CAR-T公司完成B輪融資。ImmPACT Bio公司宣布完成1.11億美元的B輪融資。該公司基于邏輯回路的CAR-T平臺旨在解決抗原逃逸、針對健康組織的毒性和免疫抑制腫瘤微環境等挑戰。目前,該公司開發的CD19/CD20雙靶標CAR-T療法,已在治療復發/難治性B細胞非霍奇金淋巴瘤的Ⅰ期臨床中獲得積極結果。中位隨訪期為12個月時,7例患者(n=8)達到并保持完全緩解(CR)。具體數據將在科學論壇上展示。
6.禮來與Evotec簽訂10億美元合作。禮來與Evotec SE公司將利用后者數據驅動的藥物發現和開發平臺,針對糖尿病和慢性腎臟病等疾病領域,合作開發治療干預新靶點的潛在候選藥物。根據協議,禮來有權選擇最多5個項目進一步開發、臨床驗證和商業化;Evotec將獲得預付款,每個項目最高達到1.8億美元的開發、監管和商業里程碑付款,以及產品的銷售分成。
醫藥熱點
1.敬靜任四川省衛健委主任。四川省十三屆人大常委會第三十三次會議日前經審議表決,決定任命敬靜為四川省衛健委主任,免去何延政的四川省衛健委主任職務。根據公開資料,敬靜1974年7月出生,女,漢族,四川劍閣人,四川大學華西臨床醫學院外科學專業畢業,在職研究生學歷,醫學博士。現任四川省衛健委黨組書記。
2.浙江規范醫院門診管理和服務。浙江省衛健委日前印發《浙江省醫院門診管理辦法》,以全省二級以上公立醫院為主要管理對象,以門診管理工作為主要管理內容,圍繞組織管理、組織實施、監督管理等方面提出了明確、具體的要求。根據《辦法》,浙江省二級以上公立醫院將設立門診管理部門,以門診管理為突破口,旨在提高醫院門診服務質量、規范門診服務流程,方便群眾就醫。
3.北京大學國際醫院成立醫教研聯盟。1月20日,北京大學國際醫院醫教研聯盟成立儀式在北京舉行,北京大學國際醫院院長陳仲強與成員單位代表北大醫療康復醫院代理院長吳東亮現場簽約并授牌,北大醫療潞安醫院、北大醫療淄博醫院、北大醫療海洋石油醫院、北大醫療株洲愷德心血管病醫院同步揭牌。聯盟醫院將通過信息互聯、互通、共享,促進優質醫療資源合理流動,讓患者在家門口就能享受同等優質的醫療服務。
評審動態
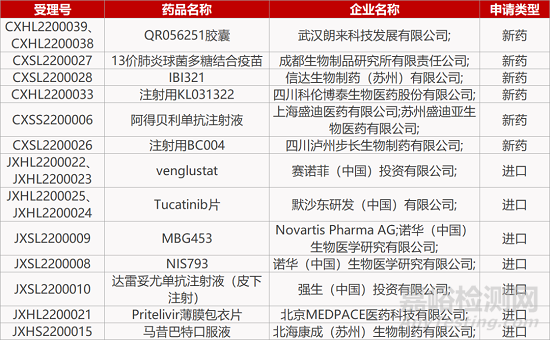
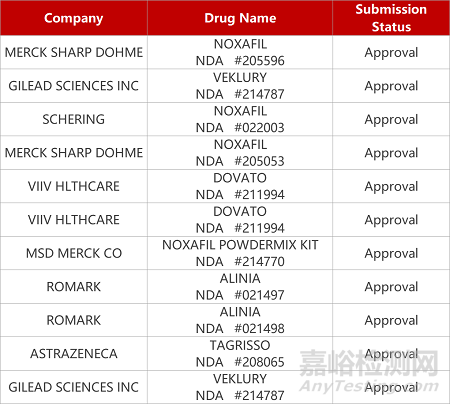
1. CDE新藥受理情況(01月21日)

來源:藥研發


